作者简介: 汤小玉, 1989年生, 北京工业大学生命科学与生物工程学院, 环境与病毒肿瘤学北京市重点实验室博士研究生,e-mail: 892127710@qq.com
选取几种天然抗氧化剂杨梅素、 桑色素、 辣椒碱、 甜菜碱作为研究对象, 运用荧光光谱法、 同步荧光光谱法以及三维荧光光谱法研究了几种抗氧化剂以及DPPH自由基与人血清蛋白相互作用, 结果表明辣椒碱、 甜菜碱、 VC不与人血清蛋白发生猝灭反应, 杨梅素、 桑色素、 DPPH均能够与人血清蛋白发生猝灭反, 反应均为形成了稳定复合物而导致的静态猝灭, 通过疏水作用力与HSA结合, 结合位点数均为1, 主要结合位点在色氨酸基团附近, DPPH与人血清蛋白猝灭过程改变了人血清蛋白结构的疏水性, 引起蛋白质构象发生变化, 而杨梅素、 桑色素与人血清蛋白相互作用未造成其构象发生了变化。 运用荧光光谱法研究了几种抗氧化剂抑制DPPH直接损伤人血清蛋白的能力, 杨梅素、 桑色素、 辣椒碱、 甜菜碱、 VC对DPPH损伤HSA的抑制率分别为25%, 18.30%, 85.38%, 4.02%和84.58%。 根据分子结构分析辣椒碱主要通过清除DPPH自由基作用从而抑制其损伤人血清蛋白, 根据二元体系反应结果可知杨梅素与桑色素三元体系反应过程中两种抗氧化剂与DPPH竞争结合位点, 因此杨梅素、 桑色素主要通过占据结合位点的方式抑制DPPH损伤人血清蛋白, 而甜菜碱既不能占据结合位点也不能清除自由基, 因而抑制能力最弱。 分析表明几种天然抗氧化剂的抑制能力与其分子结构中主要官能团结构密切相关。
In this study, the natural antioxidants myricetin, morin, capsaicin and betaine were selected as the research objects, and the interaction between several antioxidants, DPPH free radical and human albumin was studied by synchronous fluorescence spectroscopy and three-dimensional fluorescence spectroscopy. Results showed that capsaicin, betaine, VC do not have quench effects with human serum albumin, and myricetin, morin and DPPH have quench effects with human albumin. The reactions are static quenching caused by stable complexes, combining hydrophobic interaction with HSA.,The binding sites are 1, the main binding sites are near the tryptophan groups, and DPPH and human serum albumin’s quenching process changes the structure of human serum protein hydrophobicity, causes protein conformation changes, and the interaction between myricetin, morin and human albumin does notcause its conformation changes. Fluorescence spectroscopy were used to study the inhibitory effect of several antioxidants on DPPH-induced direct damage to human serum albumin. The inhibition rate of myricetin, morin, capsaicin, betaine and VC to DPPH damage HSA was 25%, 18.30%, 85.38%, 4.02% and 84.58%. Capsaicin inhibits the damage of human serum albumin by inhibiting the action of DPPH. The binary system reaction results showed that myricetin reacted with Morin ternary system to form competitive binding sites with DPPH, and Myricetin and Morin inhibit DPPH damage to human serum albumin by occupying binding sites, while Betaine can neither occupy the binding sites nor scavenge free radicals, so the inhibition ability is the weakest. The results showed that the inhibitory ability of several natural antioxidants is closely related to the main functional groups in the molecular structure.
DPPH (1, 1-二苯基-2-三硝基苯肼, 1, 1-Diphenyl-2-picrylhydrazyl radical 2, 2-Diphenyl-1-(2, 4, 6-trinitrophenyl) hydrazyl)是一种稳定的含氮自由基, 具有强氧化性[1, 2]。 能够与具有抗氧化性物质的活性成分发生反应生成稳定的DPPH化合物, DPPH检测法常用于研究天然抗氧化活性成分的抗氧化能力[3, 4, 5, 6]。 人血清蛋白(human serum albumin, HSA)在人体内能够与许多种化合物结合, 起着贮存和运输作用[7, 8]。 因此若 HSA 与具有强氧化性的自由基结合引起构象变化, 则会影响人体正常生理代谢循环的运转; 因此有必要探究天然抗氧化剂与自由基以及HSA之间的相互作用机制。
相关研究证明多种天然抗氧化剂具有清除自由基、 抗氧化的能力。 Zhang等[9]研究证明杨梅素能够抑制生物体内超氧根阴离子形成。 Jabeen[10]等研究证明桑色素在较低浓度时即可对羟基自由基(· OH)产生良好的清除作用。 刘安[11]等研究证明辣椒碱具有清除DPPH自由基, 超氧根阴离子自由基(·
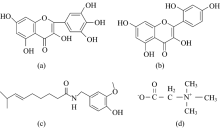
目前关于抗氧化剂与自由基以及自由基与蛋白质之间相互作用已有一定的研究, 但是关于抗氧化剂、 自由基以及蛋白质三元体系的相关研究甚少。 运用同步荧光光谱法以及三维荧光光谱法研究了DPPH、 杨梅素、 桑色素、 辣椒碱、 甜菜碱与HSA之间的相互作用, 以及几种天然抗氧化剂对DPPH与HSA之间相互作用的影响。 几种抗氧化剂的分子结构见图1。 本次研究对进一步天然抗氧化剂抑制自由基损伤能力提供了实验基础和理论依据, 对于药物、 保健品以及食品添加剂行业健康化发展具有重要意义。
DPPH购自于上海阿拉丁, 维生素C、 无水乙醇购自于天津市福晨化学试剂厂, 氢氧化钠、 盐酸购自于北京化工厂, 甲醇(GR)、 杨梅素、 辣椒碱、 桑色素、 甜菜碱购自于上海安谱科学实验仪器有限公司, 三羟甲基氨基甲烷购自于国药集团化学试剂有限公司。 杨梅素、 辣椒碱、 桑色素、 甜菜碱、 DPPH用无水乙醇配置成1× 10-3 mol· L-1的储备液。 VC用超纯水配置成1× 10-3 mol· L-1的储备液。
F-4500荧光分光光度计, BS-210S电子天平购于上海舜宇恒平科学仪器有限公司, 电热恒温水槽购自于上海森信实验仪器有限公司, PHS-25数显酸度计购自于上海精密科学仪器公司, PR020XXM1纯水机购自于北京PALL纯水公司。
准确称取3.9 mg DPPH于10 mL的容量瓶中, 用无水乙醇定容得1× 10-3 mol· L-1的储备液。
天然抗氧化剂以及DPPH和人血清蛋相互作用: 无水乙醇配置1× 10-3 mol· L-1的DPPH储备液, 无水乙醇梯度稀释DPPH储备液浓度分别为3× 10-6, 5× 10-6, 1× 10-5, 2× 10-5, 3× 10-5, 5× 10-5和1× 10-4 mol· L-1。 取一定浓度的DPPH溶液0.2 mL于5 mL的离心管中, 加入0.8 mL浓度为1× 10-6 mol· L-1的HSA溶液, 混匀后加入2 mL预热至37 ℃的pH为7.4的Tris-HCl缓冲溶液, 混匀后于37 ℃水浴保温30 min。 取出上述反应液倒入1 cm的荧光比色皿中, 随后进行波长差为Δ λ =15 nm和Δ λ =60 nm进行同步荧光光谱检测, 以及三维荧光检测。 几种天然抗氧化剂进行相同的实验, VC进行阳性对照。 实验三次结果取平均值。
三元体系之间相互作用: 在5 mL的离心管中加入0.8 mL浓度为1× 10-6 mol· L-1的HSA溶液, 加入pH为7.4的Tris-HCl缓冲溶液, 随后加入0.2 mL浓度为3× 10-5 mol· L-1 的天然抗氧化剂溶液, 混匀后于37 ℃水浴避光反应10 min, 反应后加入0.2 mL不同浓度的DPPH溶液(浓度分别为: 3× 10-6, 5× 10-6, 1× 10-5, 2× 10-5, 3× 10-5, 5× 10-5, 1× 10-4 mol· L-1)混匀后于37 ℃水浴避光反应30 min。 反应结束后于1 cm荧光比色皿中依次检测荧光强度。 本实验使用VC作为阳性对照, 实验结果重复三次取平均值。
荧光检测条件: 荧光光谱仪检测EX=280 nm, EM为300~500 nm的发射光谱与三维荧光光谱, 随后进行波长差为Δ λ =15 nm和Δ λ =60 nm进行同步荧光光谱检测。 荧光参数如下: 扫描模式: Emission/3-D Scan, 数据模式: Fluorescence, 激发波长: 280 nm, 发射波长范围: 300~450 nm, 扫描速度: 1 200 nm· min-1, 激发狭缝: 10.0 nm, 发射狭缝: 5.0 nm。
2.1.1 抗氧化剂/DPPH与HSA之间荧光猝灭光谱
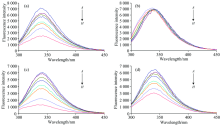
37 ℃下HSA与不同浓度抗氧化剂、 DPPH相互作用的荧光光谱如图2。 不同浓度猝灭率见表1。
| 表1 DPPH-HSA与三元体系的KSV和Kq值 Table 1 The KSV and Kq values of DPPH-HSA and ternary system |
由图2可知随着杨梅素、 桑色素、 DPPH浓度的增大HSA的峰值明显降低, 说明杨梅素、 桑色素、 DPPH与HSA均发生猝灭反应, 辣椒碱在该浓度范围不与HSA发生猝灭反应, 甜菜碱-HSA、 VC-HSA检测结果同辣椒碱。
2.1.2 抗氧化剂/DPPH与HSA之间相互作用猝灭类型
根据Stern-Volmer方程(1)与Lineweaver-Burk方程(2)进行分析
F0和F分别为加入猝灭剂与加入猝灭剂时反应荧光强度, Kq是蛋白质的猝灭速率常数; KSV为Stern-Volmer猝灭常数。 τ 0指蛋白质未加入猝灭剂时的平均荧光寿命(通常为10-8 s), KA为结合常数; Q是指猝灭剂浓度。 以猝灭剂浓度Q为x轴, F0/F为y轴作Stern-Volmer曲线, 如果猝灭反应类型是单一的静态猝灭或者动态猝灭, 则Stern-Volmer曲线呈线性。 如果猝灭反应类型为静态与动态共同参与的混合猝灭, 则Stern-Volmer曲线呈弯曲的非线性曲线。 以lg[Q]为x轴, lg[(F0-F)/F]为y轴作Lineweaver-Burk曲线, DPPH、 杨梅素、 桑色素的Stern-Volmer曲线见图3(a), Lineweaver-Burk曲线见图3(b)。
由图3(a)可知杨梅素、 桑色素、 DPPH与HSA, 之间作用的猝灭率呈良好线性关系, 说明该浓度范围杨梅素、 桑色素、 DPPH与HSA发生作用为单一类型的猝灭; 从线性关系斜率可知杨梅素-HSA、 桑色素-HSA、 DPPH-HSA的KSV值分别为1.73× 104, 3.82× 104和2.24× 104 L· mol-1, 推算出Kq的值分别为1.73× 1012, 3.82× 1012和2.24× 1012 L· mol-1· s-1。 Kq大于2× 1010 L· mol-1· s-1(Kq=2× 1010 L· mol-1· s-1为蛋白质的动态猝灭速率常数的最大值), 表明杨梅素、 桑色素、 DPPH和HSA的猝灭反应均为形成了稳定复合物而导致的静态猝灭。 根据图3(b)中lg[(F0-F)/F]与lg[Q]线性关系的斜率和截距可算出杨梅素-HSA、 桑色素-HSA、 DPPH-HSA结合位点数分别为0.73, 1.20和0.79, 均约等于1。 结果表明, DPPH与HSA、 杨梅素与HSA的结合摩尔比均为1:1。
2.1.4 杨梅素、 桑色素、 DPPH与人血清蛋白猝灭作用同步荧光光谱
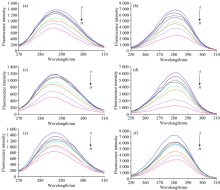
当Δ λ 的值分别为60和15 nm, 同步荧光分别显示出色氨酸和酪氨酸残基的特征信息。 几种抗氧化剂同步荧光光谱图见图4。
由图4可知酪氨酸和色氨酸残基的荧光强度随着猝灭剂浓度的增加逐渐降低, 杨梅素-HSA体系中酪氨酸荧光光谱发生蓝移(从288 nm到285 nm) , 疏水性增加, 而色氨酸荧光光谱呈红移(从282 nm到286 nm), 疏水性降低。 桑色素-HSA检测结果与杨梅素-HSA体系相同。 DPPH-HSA体系中色氨酸最大发射波长发生了轻微红移现象(从282 nm到285 nm), 疏水性降低。 由图5荧光猝灭效率曲线可知几种体系中Δ λ =60 nm的曲线始终比Δ λ =15 nm低, 表明在所研究浓度范围内, 两种物质主要猝灭的是人血清蛋白的色氨酸残基, 说明杨梅素、 桑色素、 DPPH是通过疏水作用力与HSA结合, 在HSA上的结合位点距离酪氨酸较远, 主要在色氨酸附近。
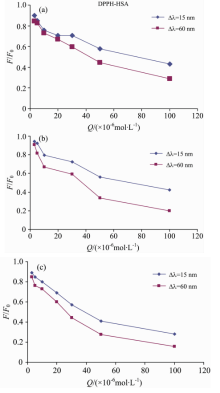 | 图5 二元体系同步荧光猝灭效率曲线(a): 杨梅素-HSA; (b): 桑色素-HSA; (c): DPPH-HSAFig.5 Synchronous fluorescence quenching efficiency curve of Binary system(a): Myricetin-HSA; (b): Morin-HSA; (c): DPPH-HSA |
2.1.5 杨梅素、 桑色素、 DPPH与人血清蛋白猝灭作用三维荧光光谱分析
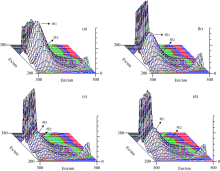
三维荧光光谱见图6。
根据图6三维荧光检测结果可知, HSA的三维荧光峰中峰1:峰2=6 851:4 001=1.71:1; DPPH-HSA峰1:峰2=5 043:2 127=2.37:1, 桑色素-HSA峰1:峰2=3 187:1 821=1.75:1; 杨梅素-HSA峰1:峰2=4 260:2462=1.73:1, 说明在猝灭反应过程中DPPH对峰2的猝灭作用更加明显, 可能是因为几乎所有的疏水腔都存在于HSA的圆筒状结构峰。 DPPH的猝灭作用导致疏水性发生改变, 从而导致HSA构象发生变化, 而杨梅素、 桑色素与HSA相互作用时未造成HSA构象发生了变化。
由图1(d)与图7对比可知DPPH-HSA二元体系的荧光猝灭反应效率强于杨梅素、 桑色素、 辣椒碱、 VC三元体系猝灭反应过程, 甜菜碱-DPPH-HSA的猝灭效果与DPPH-HSA相比无明显变化。 由图8可知杨梅素、 桑色素、 辣椒碱、 VC降低了DPPH-HSA的猝灭效率, 而甜菜碱-DPPH-HSA体系猝灭效率与DPPH-HSA体系相比无明显变化。
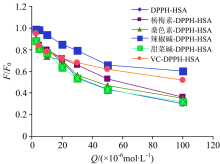 | 图8 DPPH-HSA与三元体系猝灭效率对比图2.2.2 三元体系猝灭机理Fig.8 Comparison of quenching efficiency between DPPH-HSA and ternary system |
根据式(3)计算抗氧化剂对DPPH-与HSA结合损伤的抑制率。
式中, KSV为DPPH对HSA的猝灭常数; K'SV为加入抗氧化剂后DPPH对HSA的猝灭常数。
由图9可知三元体系猝灭反应为单一的猝灭, 由表1可知Kq> 2× 1010(Kq=2× 1010 L· mol-1· s-1为蛋白质的动态猝灭速率常数的最大值), 表明三元体系反应为静态猝灭, 三元体系猝灭速率常数KSV比DPPH-HSA的KSV低。 在3× 10-6~1× 10-4 mol· L-1浓度范围内杨梅素、 桑色素、 辣椒碱、 甜菜碱、 VC对DPPH直接与HSA结合损伤的抑制率分别为25%, 18.30%, 85.38%, 4.02%和84.58%。 因为, 游离的天然抗氧化剂中含有不同的抗氧化活性结构, 能够起到抑制DPPH的作用。 所以, 含有较多OH基团与共轭基团的VC具有较强的抑制能力; 辣椒碱分子结构中含有酚羟基、 C=C、C=O、 — NH等活性基团, 因此辣椒碱与VC是通过清除DPPH的方式从而抑制其损伤HSA。 结合二元体系实验结果分析, 杨梅素、 桑色素、 DPPH和HSA二元体系猝灭反应过程均是通过疏水作用力与HSA结合, 有1个接近色氨酸附近的结合位点, 说明杨梅素、 桑色素三元体系反应过程中主要通过占据结合位点的方式抑制DPPH损伤HSA。 甜菜碱-DPPH-HSA三元体系反应过程中甜菜碱既不能占据结合位点也不能清除自由基, 因而抑制能力最弱。 基于上述分析, 抗氧化剂对DPPH损伤HSA的抑制作用主要通过占据结合位点和自身自由基清除能力两种因素, 在两种因素中自身自由基清除能力占主导作用。
运用荧光光谱法、 同步荧光光谱法以及三维荧光光谱法研究了抗氧化剂、 DPPH与人血清蛋白三元体系的作用, 结果显示DPPH能够与HSA发生猝灭反应, 并引起HSA构象变化。 三元体系中杨梅素与桑色素主要是通过占据结合位点的方式减少损伤, 辣椒碱与VC是通过其抗氧化活性基团抑制自由基损伤蛋白。 本次研究的实验方法适用于研究一些天然化合物的活性成分的抗氧化性, 以及化学食品添加剂对蛋白质的损伤研究, 有助于保护食品安全、 药品安全、 维护人体健康。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|