作者简介: 李星星, 1994年生, 暨南大学理工学院食品科学系硕士研究生 e-mail: 931244501@qq.com
大蒜中的含硫氨基酸, 如脱氧蒜氨酸(SAC)、 蒜氨酸(SACS)、 S-烯丙基巯基半胱氨酸(SAMC), 具有抗肿瘤、 抗氧化等多种生理、 药理活性, 这些活性应当与上述含硫氨基酸和存在于生物体内的蛋白质等生物大分子之间的相互作用有直接关系。 为探明其关系, 本文以牛血清蛋白(BSA)为模型蛋白, 运用荧光光谱法和紫外吸收光谱法, 研究了pH 7.40的Tris-HCl缓冲溶液中, 大蒜中SAC, SACS, SAMC与BSA的相互作用。 采用荧光分光光度计, 以280 nm为激发波长, 扫描300~400 nm的荧光发射光谱; 采用紫外分光光度计, 扫描SAMC的300~400 nm紫外吸收光谱。 荧光光谱和紫外吸收光谱结果分析表明: BSA与SAC, SACS的猝灭类型是动态猝灭。 BSA与SAMC的猝灭类型是静态猝灭, 在298和310 K下两者的结合常数分别为6.18×103和5.54×103 L·mol-1, 结合作用较强; 对应温度下BSA与SAMC均近似为1个结合位点, 可形成1:1的复合物, 推断其在生物体内能被较好的储存与转运; 两者的结合距离为1.61 nm。 两者结合的热力学参数在298和310 K下的Δ G分别为-21.63和-22.21 kJ·mol-1, 说明反应是一个自发进行的过程; 其Δ H为-7.06 kJ·mol-1; 在298和310 K温度下的Δ S分别为48.89和46.99 J·mol-1·K-1, 结合Δ H和Δ S的大小可判断两者的结合以静电引力作用为主。 研究表明SAMC与BSA的结合作用较强, 为其可作为药物分子提供了理论依据, 同时这些结果也为进一步研究三种含硫氨基酸与BSA等大分子的相互作用、 开发与利用提供了理论依据。
Sulfur-containing amino acids (SAA) such as S-allyl cysteine (SAC), S-allyl cysteine sulfoxide (SACS), and S-allyl mercapto cysteine (SAMC) from garlic ( Allium sativum L.) have many bioactivities like anti-tumor, antioxidant and so on. These bioactivities should be directly related to the interaction between the above-mentioned SAA and biomacromolecules such as proteins in organisms. In order to elucidate the relationship, the modle system was made of by bovine serum albumin (BSA) and SAA. The interaction between SAC, SACS or SAMC and BSA was investigated in Tris-HCl buffer solution at pH 7.40 by fluorescence spectroscopy (FS) and ultraviolet absorption spectroscopy (UVS). FS was determined by scanning from 300 to 400 nm at 280 nm excitation wavelength. And UVS was determined by scanning the SAMC solution from 300 to 400 nm. FS and UVS results show that the quenching type of BSA with SAC or SACS is dynamic quenching, and the one of BSA and SAMC is static quenching. The binding constants of BSA and SAMC solution at 298 K and 310 K are 6.18×103 and 5.54×103 L·mol-1, respectively, with strong binding effect. The number of the binding site of BSA and SAMC at above temperature is approximating to 1, i.e. forming a 1:1 complex, which can be deduced that SAMC is well stored and transported in organisms. The binding distance between BSA and SAMC is 1.61 nm. The binding Δ G of BSA and SAMC is -21.63 and -22.21 kJ·mol-1 at 298 and 310 K, respectively, indicating that the reaction is a spontaneous process. The binding Δ H is about -7.06 kJ·mol-1 at the checking temperature; the binding Δ S of BSA and SAMC is 48.89, 46.99 J·mol-1·K-1 at 298 K and 310 K, respectively. The electrostatic attraction is dominated between BSA and SAMC, based on their Δ H and Δ S. It could be concluded that SAMC has a strong binding with BSA, which provides a theoretical basis for SAMC as a drug molecule. At the same time, these results also provide a theoretical basis for further study of the interaction, development and utilization SAA and other macromolecules.
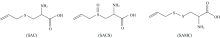
大蒜(Allium sativum L., 又称为葫蒜、 葫、 独蒜等), 富含含硫氨基酸, 如蒜氨酸(S-allyl cysteine sulfoxid, SACS)、 脱氧蒜氨酸(S-allyl cysteine, SAC)、 S-烯丙基巯基半胱氨酸(S-allyl mercapto cysteine, SAMC; 见图1)等, 它们具有清除自由基、 抗糖尿病等多种功效。 大蒜的保健、 药用等生物学功能, 应当同这些含硫氨基酸和存在于生物体内的蛋白质等生物大分子之间的相互作用有直接关系。 药物分子进入体内后与血清白蛋白结合, 在体内被运输、 储存, 发挥药用价值, 常常以BSA作为模型蛋白阐明研究保健功能成分与血清蛋白之间的结合方式、 结合位点等相互作用机制; 这些机制的阐明, 对于保健食品、 药物等产品的开发与应用, 具有重要的理论指导价值。
马雪红[1]报道了SACS与BSA、 HSA的结合作用, 即在298 K下结合常数分别为9.81× 102和2.27× 102 L· mol-1; SAC与BSA之间的作用主要为静电引力, 与HSA之间的作用主要为疏水作用力。 Sun[2]等报道了SACS和HAS的结合作用, 在298 K结合常数为1.58× 104 L· mol-1; SAC与BSA之间的作用主要为氢键和范德华力。 由此可见, 这两种氨基酸因结构不同结合作用相差较大, 而SAMC与血清白蛋白的结合作用还未见报道, 同时三种含硫氨基酸因结构不同引起结合作用变化等也需要进一步阐明。 为弥补这些不足, 本论文拟采用荧光光谱法和紫外吸收光谱法分析三种含硫氨基酸与牛血清白蛋白的相互作用, 计算其结合常数、 结合作用力类型、 热力学参数、 结合距离、 结合位点等, 以为三种含硫氨基酸的开发与利用提供相应的理论依据。
电子分析天平(AX205DR, METTLER TOLEDO); 荧光分光光度计(PE LS 45, 美国Perkin Elmer公司); 紫外分光光度计(UV-9600, 北京瑞利分析仪器公司)。 SAC, SACS和SAMC均来自于实验室化学合成(经MS, HRMS和1H-NMR确定合成的均为目标产物, 纯度均大于95%); 牛血清白蛋白(BSA, 上海伯奥生物科技有限公司, LOT: 080325); 实验用水为超纯水。
1.2.1 荧光光谱的测定
在10 mL容量瓶中依次加入2 mL pH 7.40的Tris-HCl缓冲溶液、 2 mL的0.50 mol· L-1 NaCl溶液, 6 mL浓度为3× 10-5 mol· L-1的BSA溶液。 取3 mL该溶液与石英比色皿中, 依次加入20 μ L SAC, SACS(0.05 mol· L-1), 10 μ L SAMC(0.05 mol· L-1)对照溶液, 共加6次, 混匀, 得到SAC、 SACS浓度分别为: (0.00, 3.31, 6.57, 9.80, 13.0, 16.1, 19.2)× 10-4 mol· L-1的BSA混合溶液, SAMC浓度即为前面两种氨基酸的一半。 最后将反应液分别在298和310 K温度下保持5 min。 在荧光分光光度计操作界面中, 选择荧光扫描模式。 以280 nm为激发波长, 扫描300~400 nm荧光光谱并记录荧光强度的变化。
1.2.2 实验数据分析
使用Origin8.5(Origin Lab Co., Northampton, MA, USA)软件进行绘图, Chemdraw绘制化合物的结构式; 使用Microsoft Excel对数据进行统计分析。
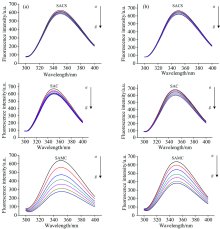
图2中, 在350 nm处出现了较强的荧光峰, 这是BSA分子固有的内源荧光物质色氨酸、 酪氨酸及苯丙氨酸等酚型氨基酸残基的综合效应所发射的荧光[3]; 该峰处的荧光强度变化, 反映了溶剂、 溶质与BSA之间的相互作用。 由图2各图中可以看出:
(1)三种含硫氨基酸均具有荧光猝灭作用, 且荧光猝灭强度大小分别为: SAMC> SAC> SACS。 如在298 K时, SAMC随着浓度的增加(a— g)荧光强度下降了362 a.u., 而SAC荧光强度仅下降了88 a.u, 但高于SACS下降量43 a.u。
(2)三种含硫氨基酸的浓度越高, 对BSA的荧光基团猝灭作用越强。 如在298 K时, SACS样品中随着浓度的增加(a— g), 荧光强度从627 a.u.下降为584 a.u; SAC荧光强度从670 a.u下降为582 a.u; SAMC荧光强度从639 a.u下降为277 a.u。
(3)温度影响三种含硫氨基酸与BSA的荧光猝灭作用。 如在298 K下, SAC和SAMC的荧光强度下降量分别为88和362 a.u, 在310 K的下降量分别为78和257 a.u, 温度越高下降量越少; 而在同样条件下SACS的荧光强度下降量分别为43和44 a.u, 猝灭效果不佳、 温度差异引起的荧光强度的变化较小。
综上所述, 可初步判断SACS, SAC和SAMC均具有荧光猝灭作用, SAMC的荧光猝灭作用最强。
根据Stern-Volmer方程式(1)可得荧光猝灭常数。 以F0/F对[Q]作图, 得到不同温度条件下三种含硫氨基酸对BSA的Stern-Volmer函数(图3), 由截距求得Kq和Ksv(见表1)。
| 表1 三种含硫氨基酸与BSA的线性方程、 相关系数及荧光猝灭常数 Table 1 Linear equations, correlation coefficients and fluorescence quenching constants of three sulfur-containing amino acids and BSA |
式(1)中: F和F0分别表示有无猝灭剂时BSA的荧光强度; [Q]为猝灭剂浓度(mol· L-1); KSV为荧光猝灭常数(L· mol-1); Kq为双分子猝灭速率常数[L· (mol· s)-1]; τ 0为无猝灭剂时荧光分子的平均寿命(一般约10-8 s)。
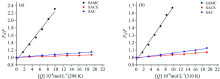 | 图3 不同温度下三种含硫氨基酸的Stern-Volmer函数 (a): 298 K; (b): 310 KFig.3 Stern-volmer function of three kinds of sulfur-containing amino acids at different temperature (a): 298 K; (b): 310 K |
一般地, 各类荧光动态猝灭剂的Kq最大为(1.0~2.0)× 1010 L· (mol· s
因此, 综合Kq和KSV两方面的结果, 可以判断SAMC对BSA的猝灭作用为静态猝灭, SACS, SAC对BSA的猝灭作用为动态猝灭。
静态猝灭剂浓度[Q]、 结合常数KA、 荧光强度F和结合位点之间n的关系可用式(2)Lineweaver-Burk双对数方程来表述。
式中: F0, F和[Q]含义同式(1); KA为化合物与血清白蛋白在不同温度下的结合常数(L· mol-1), 通过式(2)方程的截距求真数即为KA值; n为结合位点数。 按式(2)分别绘制SAMC与BSA在298和310 K温度下的~的双对数图(图4)后, 由其截距和斜率可以求出SAMC与BSA的结合常数及结合位点数(见表2)。
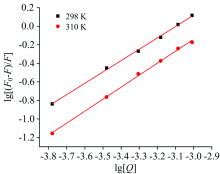 | 图4 不同温度下三种含硫氨基酸的 Stern-Volmer函数Fig.4 Stern-Volmer function of three kinds of sulfur-containing amino acid at different temperature |
| 表2 SAMC与BSA结合常数及结合位点数 Table 2 SAMC and BSA binding constants and number of binding sites |
由表2看出: SAMC和BSA的结合位点数n分别为1.224 0和1.294 2, 即近似形成一个结合位点, 为1:1复合物; 其结合常数KA数量级> 103, 表明它们之间的结合力较强, SAMC在生物体内可以较好的储存与转运。 由图1可以看出: 三种含硫氨基酸都含有相同的烯丙基和丙氨酸的结构, 其差异仅是SAMC有二硫键结构, 而SAC和SACS都没有二硫键, 说明SAMC上二硫键的存在使得SAMC与BSA的结合为静态猝灭, 即相互作用较强。
小分子与蛋白质大分子(如BSA)的作用力包括氢键、 范德华力、 静电引力、 疏水作用力等[6]。 Ross理论[7]认为: 当Δ H≥ 0, Δ S> 0时, 分子间的作用力为典型的疏水作用力; 当Δ H< 0, Δ S> 0时主要为静电引力; 当Δ H> 0, Δ S< 0主要为氢键和范德华力。 当温度变化不大时, Δ H可看作一个常数。 据此, 可以判断化合物与蛋白分子结合作用力的类型。
按式(2)可计算出不同温度下SAMC与BSA作用的结合常数KA, 298和310 K下的分别记为KA1和KA2。 按式(3)和式(4)以lnKA对1/T作图, 求得SAMC与BSA的热力学参数(见表3), 然后根据热力学参数判断作用力类型[8]。
式中, Δ H, Δ G和Δ S分别表示焓, 自由能和熵的变化, KA1和KA2分别为298和310 K下的KA, 其中T1和T2分别为298和310 K。
| 表3 不同温度下SAMC的热力学参数 Table 3 Thermodynamic parameters of SAMC at different temperatures |
据表3结果: Δ G< 0, 即SAMC与BSA的作用(或反应)是自由能减少、 自发进行的过程; 它们作用的Δ H< 0, Δ S> 0, 据Ross理论[7]可以判断SAMC与BSA的结合作用力主要表现为静电引力。
对于小分子与蛋白分子结合形成络合物, 根据偶极-偶极非辐射能量转移效率(E)即Fö rster理论[9][见式(5)], 可以求出结合位置相对于蛋白质分子中发荧光基团之间的距离(r), r越小, 药物分子越有利于被蛋白质存储与转运, 越能发挥其药理作用。
式(5)中, R0是能量转移效率E为50%时的临界距离, R0由式(6)求出
式(6)中, K为偶极空间取向因子, N为介质的折射指数, ϕ 为给体的光量子效率, 给体(蛋白)荧光发射光谱与受体(药物)吸收光谱间的光谱重叠部分为J式(7)
式(7)中, F(λ )为荧光给体(BSA)在波长处的荧光强度, 则ε (λ )为受体(SAMC)在波长处的摩尔吸收系数, 能量转移效率E可由式(8)求出。
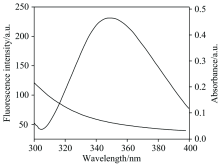
将1.0× 10-6 mol· L-1 BSA荧光发射光谱和等浓度SAMC紫外吸收光谱输入Origin8.5软件中作图(图5), 按式(7)求得图中光谱重叠部分面积。 根据文献[10]报道, 色氨酸的量子产率为0.118, 折射指数N取水和有机物的平均值1.366, 空间取向因子K2取给体和受体各向同性随机分布的平均值2/3。 将以上各量代入式(6)中, 计算临界结合距离R0。 按式(8)求得能量转移效率E, 然后根据E和R0按式(5)求得结合距离r。 计算可得J=8.62× 10-20 cm3· L· mol-1, R0=1.17 nm, E=0.13, r=1.61 nm。 当BSA发射荧光时, BSA的发射光谱与SAMC的紫外吸收光谱应有足够的重叠, 最大距离不应超过7 nm[11]。 而计算结果r=1.61 nm, 且0.5R0< r< 1.5R0, 说明SAMC和BSA的结合距离满足要求、 SAMC和BSA之间存在能量转移。
通过荧光光谱法和紫外吸收光谱法研究了BSA与SAC, SACS和SAMC的相互作用, 其与SAMC之间是静态猝灭, 与SAC和SACS之间则是动态猝灭; SAMC与BSA相互作用的结合位点数接近1; 两者主要以静电引力结合的距离r=1.61 nm。 其结合的热动力学参数Δ H为-7.06 kJ· mol-1; 298和310 K下的Δ G分别为-21.63和-22.21 kJ· mol-1; 对应温度下的Δ S分别为48.89和46.99 J· mol-1· K-1。 这些结果也为进一步研究三种含硫氨基酸与BSA等大分子的相互作用、 开发与利用提供了理论依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|