作者简介: 谢 欢, 1991年生, 南昌大学食品科学与技术国家重点实验室硕士研究生 e-mail: xiehuan08@qq.com
实验研究微波对蛋清蛋白粉与葡萄糖干样混合体系的影响, 构建微波条件下蛋清蛋白-葡萄糖圆柱体反应模型。 通过改变微波的功率, 时间和位置, 采用红外热像仪、 荧光、 紫外, 高效液相色谱等方法研究微波场中蛋清蛋白糖基化产物不均匀性。 将蛋清蛋白粉末与葡萄糖等质量混合, 手工震荡和研钵充分研磨后在平皿表面铺一薄层粉末, 放置于微波炉中心反应。 将反应后的样品按左、中、右分成三个规则区域均匀采样。 热像图表明微波功率越高, 样品表面温度越高。 凝胶电泳图表明240 W微波加热30 min样品边缘已经发生了反应, 而且样品中间部分几乎还未反应; 自由氨基含量测定表明高功率长时间微波作用才会观测到明显糖基化反应而低功率短时间条件下反应不明显, 且边缘部分的样品反应总是比中间部分的样品剧烈; 通过荧光光谱可知, 蛋清蛋白和葡萄糖发生了反应, 而样品边缘部分荧光强度降低得比样品中间部分多说明样品边缘反应更加剧烈; 紫外光谱测定表明越剧烈的微波条件样品紫外吸收越多, 边缘部分紫外吸收最高。 液相结果也证实了这一点, 糖基化样品边缘部分5-羟甲基糠醛(HMF)含量明显高于样品中间部分, 且随时间和功率逐渐增加。
In this study, the mixed system of the powder of egg white and glucose were constructed as the research object of glycosylation reaction model. We changed the power and heat time of the microwave oven to investigate how the position influence the level of the reaction using fluorescence, UV and other methods. In this experiment, egg white protein powder and glucose were quality mixed. By hand shake and full grinding, We full the plate with the mixed powder. We divided the plate into left middle and right and put the plate in the middle of the microwave oven. SDS-PAGE showed that the edge of the sample had reacted at at 240 W for 30 min, and the middle of the sample was almost unresponsive. The determination of free amino groups showed that the microwave had obvious glycosylation reaction under high power and long time .The reaction of the edge part of the sample is always more intense than the middle part of the sample. Through the fluorescence spectrum can be said that egg white protein and glucose reaction, and the edge of the sample part of the fluorescence intensity decreased more than the middle part of the sample Indicating that the edge of the sample was more intense, and the liquid phase results also confirmed the point. The sample edge of the HMF content was significantly higher than the middle part of the sample, and with time and power gradually increased; UV analysis showed that in the glycosylation reaction model plane, the edge enjoyed the highest degree of reaction.
微波加热的原理是材料通过吸收微波能量并将其转化成热量。 微波在干燥、 灭菌、 贮藏等食品加工领域已有广泛应用。 与常规加热手段相比, 微波加热一定程度上能够缓解对食品原有营养和风味的改变。 并且它能够有效减少食品加热时间, 深受大家喜爱。 尽管微波加热有很多的优势, 但与传统水浴加热相比, 它的加热不均匀性非常显著。 加热存在局部冷点和热点。 Chandrasekaran[1]报道, 微波加热的不均匀性与加热材料的形状有关。
鸡蛋是廉价高营养食品, 是世界上为数不多的被不同宗教不同族群广泛接受的食品[2]。 它能提供完善的必须氨基酸, 可以促进骨骼肌蛋白质合成[3]。 它具有许多良好的功能特性, 例如起泡性乳化性以及独特的风味和色泽。 鸡蛋清是一种非常纯净的蛋白质来源, 约90%的干物质是蛋白成分[4]。 蛋清蛋白由卵清蛋白, 卵转铁蛋白, 卵粘蛋白等各种蛋白组成。 鸡蛋许多优良的功能特性来源于蛋清蛋白。 面包, 蛋挞等美食的制作过程中均加入了蛋清以及糖, 高温下蛋清蛋白能够与糖作用产生风味物质并产生诱人的颜色。
糖与蛋白能够发生美拉德反应(Maillard reaction), 是1912年被法国化学家路易斯· 卡米拉· 美拉德发现的一种非酶羰氨脱水缩合反应[5]。 参与反应的羰基基团通常来自于葡萄糖、 果糖以及麦芽糖等还原糖。 美拉德反应通常包含初始, 中间和最终三个阶段。 反应可能会产生大量高级糖基化终产物(AGEs)。 而5-羟甲基糠醛(HMF)是体现反应程度的主要标志物之一[6], Vincent M Monnier等[7]报道糖基化终产物可能会引起糖尿病肥胖等与代谢有关的慢性疾病。 本工作采用手机热像仪, 荧光光谱, 紫外光谱和高效液相色谱等对微波场中不同功率、 时间、 位置的蛋清蛋白糖基化产物进行分析, 探索微波场中蛋清蛋白葡萄糖糖基化反应在样品不同位置的反应程度和有害产物HMF的产生规律, 为解决工业生产存在的微波场中蛋清蛋白糖基化反应不均匀的问题提供参考。
食品级蛋清蛋白粉购于郑州奥冉生物科技有限公司。
葡萄糖邻苯二甲醛(OPA)L-赖氨酸购于sigma限公司, 其他均为国产分析纯。 IRS-S6手机热像仪, 上海热像机电科技股份有限公司; SynergyH1多功能酶标仪, 美国Bio Tek公司; G80F20CN2L-B8微波炉, 广东格兰仕微波炉有限公司; L-2000高效液相色谱, 日本HITACHI公司。
1.2.1 样品模型的建立
(1)用蛋清蛋白粉与葡萄糖按1:1的质量比混合装入自封袋中, 手工来回震荡15 min, 接着用研钵研磨5 min。
(2)将研磨好的样品用调料罐来回撒在直径为9 cm的平皿上几次, 使样品厚度尽量相近, 称量每个平皿中样品, 确保质量相等。 将平皿做上标记置于微波炉中, 并在微波炉底部作标记确保每次平皿都放在相同位置。 240和320 W微波功率下分别加热30, 40和50 min。 处理间隔30 min, 确保每次初始反应温度接近常温。 反应后将每个样品按照标记从左到右均匀分成3个反应区域, 左右部分视作边缘区域, 把各区域样品配成相同浓度溶液备用。 微波反应后对每个区域的样品进行热像图、 电泳、 紫外、 荧光、 液相分析。
1.2.2 手机热像仪扫描表面温度
样品在微波炉中按设定的反应功率和时间加热后, 等待20 s, 带手套将样品取至试验台。 10 s后用带有双摄像头的手机热像仪扫描样品表面。
1.2.3 SDS-PAGE电泳
配制12%分离胶, 5%浓缩胶。 将上样缓冲液与8 mg· mL-1的样品1:3混合。 用离心机离心使样品混合后, 煮沸7 min。 离心2 min。 每孔进样10 μ L。 将凝胶电泳仪调至80 V, 120 min。 跑胶完毕后染色40 min。 脱色阶段, 每10 min脱色一次, 脱色至条带清晰终止。 最后用自封袋将胶包好, 吸水后用扫描仪进行扫描。
1.2.4 自由氨基的测定
根据Nielsen的方法[8], 配置OPA试剂。 取50 μ L 40 mg· mL-1样品加入1 mL OPA试剂。 摇晃5 s, 25 ℃下避光3 min。 将0.1, 0.15, 0.2, 0.3和0.4 mg· mL-1赖氨酸溶液替代样品用酶标仪在340 nm处测吸光值, 制作L-赖氨酸标准曲线计算自由氨基含量, 将水替代样品作为空白。
1.2.5 荧光光谱分析
取4 mg· mL-1 样品200 μ L, 设置激发波长为270 nm, 测量范围为300~370 nm, 步幅5 nm, 采用黑色荧光酶标板进行测量。
1.2.6 紫外光谱分析
取4 mg· mL-1样品200 μ L于透明紫外酶标板, 在230~400 nm处进行紫外光谱扫描, 步幅设置为5 nm。
1.2.7 高效液相色谱检测5-羟甲基糠醛(5-HMF)的含量
(1)取100 μ L, 40 mg· mL-1样品溶液, 加入800 μ L超纯水和100 μ L, 6 mol· L-1盐酸, 煮沸15 min 后4 000 r离心20 min过0.22 nm滤膜。
(2)称0.01 g HMF标品溶于超纯水10 mL配置成1 mg· mL-1 HMF标准溶液。 分别移取5, 10, 15, 20和25 μ L HMF标准溶液于10 mL超纯水中, 得到浓度分别为0.5, 1.0, 1.5, 2.0和2.5μ g· mL-1的HMF溶液。 采用C18柱分离, 流动相甲醇与水的体积比是30:70, 流速设置为0.8 mL· min-1, 进样量为10 μ L。 采用紫外检测器在285 nm处检测。
手机热像仪有两个摄像头, 可以同时记录普通图象和热像图。 从热像图可以粗略观察样品表面温度。 热像图中发亮越黄的部分, 温度较高; 而发红发暗的部分温度相对较低。 从普通图像来看, 随着微波功率和时间的增加, 蛋清蛋白和葡萄糖混合物的颜色越来越黄, 且边缘的颜色总是深于中间部分。 而当微波功率达到320 W, 加热时间达到50 min时, 这种差异最为明显。 美拉德反应是脱水反应, 微波320 W, 50 min的样品边缘甚至有水痕出现, 可能此时的糖基化程度最大。 从热像图来看, 微波处理320 W, 50 min以及微波处理240 W, 50 min的样品热像图最亮, 说明在一定范围内增大微波功率和时间, 样品能够被明显加热。 大部分热像图的最亮点出现在边缘, 说明边缘的反应温度最高。 因此可能边缘的美拉德反应程度最剧烈。 由此发现微波加热是不均匀的, 在微波条件下美拉德反应可能也是不均匀的。
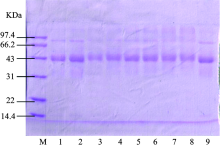
采用电泳图谱诊断糖基化产物中的大分子糖链是否接入。 图3为未经处理蛋清蛋白和不同条件微波处理之后的蛋清蛋白葡萄糖混合物的电泳条带图。 将未处理的蛋清蛋白原样和未处理的葡萄糖蛋清蛋白混合物作为对照, 从电泳图谱可以看出, 蛋清蛋白-葡萄糖混合物经过微波加热之后, 其条带明显上移, 表明葡萄糖已连接到蛋清蛋白分子上, 致使其分子量增大。 随微波功率和时间增大, 条带上移更为明显。 由电泳条带可以看出, 微波对蛋清蛋白与葡萄糖的美拉德反应程度有一定的影响, 高功率处理的蛋清蛋白葡萄糖混合物明显比低功率处理的蛋清蛋白葡萄糖混合物电泳条带上移。 当微波功率为240 W, 反应时间为30 min时, 边缘的样品条带有上移, 而中间的样品没有上移。 表明中间部分的样品可能没发生美拉德反应。 微波加热是不均匀的, 样品边缘的反应程度总是高于样品中间的反应程度。 蛋清蛋白-葡萄糖共聚物的条带宽度不同可能是因为微量进样的误差以及微波加热的不均匀性导致反应程度不一。
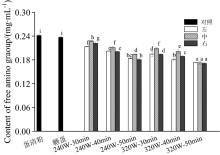
游离氨基含量通常用来评价美拉德反应的程度, 游离氨基减少的越多, 表明美拉德反应程度更高。 从图4可以看出, 当以240 W微波加热蛋清蛋白-葡萄糖30 min时, 蛋清蛋白-葡萄糖的混合物样品中间部分游离氨基的含量与未处理的蛋清粉相比, 仅下降了8.43%, 原因可能是低功率短时间不足以葡萄糖与蛋清蛋白反应。 仅加入葡萄糖未经过微波处理的蛋清蛋白与未处理的蛋清蛋白相比, 游离氨基含量无显著性差异, 说明仅加入葡萄糖而没有微波环境不能令蛋白质与糖发生羰氨缩合。 而当微波加热蛋清蛋白-葡萄糖320 W, 40 min时, 与未处理的蛋清粉相比, 自由氨基含量下降高达31.2%, 表明微波加热会促进美拉德反应。 边缘部分与中间部分比较发现长时间高功率处理便边缘位置的样品有更高程度的美拉德反应。 当蛋清蛋白与葡萄糖经320 W, 50 min微波处理后, 游离氨基含量达到最低值, 此时样品中间部分游离氨基含量也由未处理时的0.249 mg· mL-1下降到0.173 mg· mL-1。 中间与边缘部分样品的游离氨基均随微波时间和功率大幅减少。 但边缘与中间部分的反应程度差异也越来越不明显。 可能是由于高温使得整个反应体系都得以反应, 微波加热不均匀性也随之减少。 游离氨基的含量的减少可能与美拉德反应中希夫碱的生成有关, 蛋白质中的氨基与还原糖共价交联形成糖基化蛋白质。 糖基化反应后游离氨基的减少趋势与孙炜炜等[9]的报道相同, 与电泳结果也相一致。
芳香族氨基酸有紫外吸收, 因此, 可通过测定紫外吸收来判断其结构是否发生变化。 从图5可以看出, 在280 nm附近, 与未经微波处理的蛋清蛋白相比, 微波处理后的样品最大吸收峰明显升高。 而未处理的蛋清粉与只加了葡萄糖未经微波处理的蛋清粉荧光强度曲线几乎重合, 说明单纯加糖不足以使蛋清蛋白与葡萄糖发生反应。 在280 nm附近, 吸光值变大表明蛋白质结构发生了变化。 可能是由于微波加热, 蛋白质疏水性生色基团暴露从而导致紫外吸收变大。 随着微波功率和加热时间的增加, 吸收峰逐渐增大。 此外, 从图中可以看出, 在320 W, 40 min的微波条件下, 边缘部分的样品吸光值比中间部分的要高。 可能是因为边缘部分温度更高, 蛋白质疏水基团更易暴露。 表明处在边缘位置的样品结构改变更明显。 而处在中间位置的样品可能由于温度变化较温和所以结构变化不明显。 该现象符合自由氨基的测定结果一致。
内源荧光与蛋白质中Tyr残基、 Phe残基和Trp残基等芳香族氨基酸残基有关, 其中色氨酸荧光强度要高于酪氨酸, 酪氨酸荧光强度高于苯丙氨酸, 因此内源荧光主要由色氨酸残基形成, 内源荧光可以准确描述蛋白质构造的改变以及氨基酸的损失。 经过微波加热的糖基化蛋清蛋白的荧光如图6所示, 随着时间和微波功率的增加, 荧光强度不断下降。 且当微波强度达到240 W, 50 min后荧光图谱间隔越来越大, 荧光强度下降程度明显增大。 微波为320 W, 50 min时, 荧光强度下降最多。 而且如图6所示, 相同功率相同时间的样品, 边缘部分的荧光强度下降比中间部分的明显。 不论改变微波功率还是时间, 边缘部分的样品荧光总是发生蓝移, 说明随着微波强度变大, 其表面疏水性增加, 极性变小[10]。 微波处理, 荧光强度显著降低, 可能是因为还原糖和蛋白质结合之后导致蛋白质的三级结构发生改变, 从而导致荧光降低。 也可能是因为色氨酸残基等发色基团由于微波作用导致基团暴露于溶剂因猝灭作用导致荧光强度降低。 还可能是因为蛋白质发生聚集现象, 导致色氨酸等芳香族氨基酸残基隐蔽从而导致荧光强度降低。 张腾等[11]报道蛋白质氧化荧光强度会降低, 所以样品荧光强度降低可能是由微波炉中温度的升高, 蛋白被氧化导致。
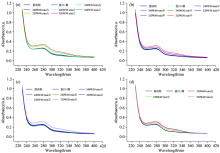 | 图5 微波场中不同位置的蛋清蛋白糖基化产物紫外光谱Fig.5 The ultraviolet spectra of glycosylation products of egg white at different positions in microwave field |
5-羟甲基糠醛是糖基化反应的中间产物, 在人体内可以代谢成有致癌风险的羟甲基糠醛酸和羟甲基糠醛次硫酸盐[12]。 由图7可以看出羟甲基糠醛的出峰时间为9分15秒, 与对照组相比, 经过微波处理后的蛋清蛋白葡萄萄混合物HMF含量显著增加, 未处理的样品几乎未检出。 320 W微波下处理50 min检出量最高达0.493 75 μ g· mL-1。 中间部分样品和边缘部分样品HMF的生成量差异显著。 320 W微波处理40 min的样品边缘HMF含量有0.313 26 μ g· mL-1, 而中间部分只有0.192 74 μ g· mL-1。 进一步证明了微波加热是不均匀的。 这种不均匀性还可能与样品形状有关[1]。 微波加热不均匀可能和微波加热原理有关, 微波加热靠的是食物内部分子吸收微波产热, 而样品材质, 形状可能会影响微波的吸收和热量的传递从而影响样品温度分布进而影响样品的美拉德反应程度。
(1)通过电泳图, 热像图以及自由氨基含量测定可以看出, 微波作用下的糖基化反应存在不均匀性, 有的反应明显, 有的没有反应。
(2)荧光测量可知发生了糖基化反应, 随着微波功率和时间的增加, 荧光强度越来越低, 而且同样的微波条件下, 边缘的荧光总是要比中间部分荧光强度要低。
(3)通过紫外光谱可知, 不管怎样改变微波条件, 边缘部分紫外吸收总高于中间部分。
(4)液相结果证明了之前的猜测, 羟甲基糠醛随着微波功率和时间的增加, 检出量明显增大。 边缘部分的HMF含量远远高于中心部分。 圆柱模型中边缘糖基化反应程度总是高于中心部分。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|