作者简介: 尚艳侠, 1997年生, 河北农业大学农学院硕士研究生 e-mail: shangyx0516@163.com
花生籽仁中蛋白质及其组分含量是重要的品质性状, 探索无损、 高效的含量检测方法是花生育种及生产的重要研究方向。 根据样品外观颜色分别构建近红外模型有利于提高检测的准确性。 利用市场常见的黑色、 红色、 粉色共282个花生种质, 采用考马斯亮蓝法(Bradford)检测蛋白含量, 与近红外光谱值拟合, 采用偏最小二乘回归(PLSR)法构建近红外预测模型。 共构建黑色种皮粗蛋白、 黑色种皮清蛋白、 黑色种皮球蛋白、 黑色种皮伴球蛋白、 红色种皮粗蛋白、 红色种皮清蛋白、 红色种皮球蛋白、 红色种皮伴球蛋白、 粉色种皮清蛋白、 粉色种皮球蛋白、 粉色种皮伴球蛋白等共11个近红外预测模型, 光谱值预处理方法为多种复合处理法, 黑色种皮粗蛋白、 黑色种皮清蛋白、 黑色种皮球蛋白、 黑色种皮伴球蛋白模型的最佳预处理方法分别为Baseline+Detrend、 Detrend+MSC、 2nd-der+Detrend+1st-der、 Baseline+SNV, 红色种皮粗蛋白、 红色种皮清蛋白、 红色种皮球蛋白、 红色种皮伴球蛋白模型的最佳预处理方法分别为Baseline+SNV、 Baseline+SNV+ MSC、 SNV+MSC+Baseline、 SNV+MSC+Baseline, 粉色种皮清蛋白、 粉色种皮球蛋白、 粉色种皮伴球蛋白模型的最佳预处理方法分别为2nd-der+1st-der、 2nd-der+Detrend+1st-der、 2nd-der+Baseline+1st-der, 所建模型的相关系数 Rc为0.825~0.925, 均方根误差RMSEC为0.110~1.383。 对所建模型进行外部验证, 11个模型的外部验证集相关系数 Rp在0.822~0.971之间, 均方根误差RMSEP在0.102~0.954之间。 将不同种皮颜色花生利用其他颜色模型检测并与其化学值进行拟合, 相关系数在0.002~0.877范围内, 标准误差在0.257~9.464范围内, 相关系数均低于外部验证集相关系数, 最佳检测模型为对应种皮颜色的模型。 构建的不同种皮颜色的花生蛋白及其组分含量的模型, 可快速无损的检测其含量, 为花生蛋白加工原料的选择和花生专用型种质的选育提供了依据。
The protein and its component content in peanut seed is an important quality trait of peanuts. Exploring non-destructive and efficient content detection methods is an important research direction of peanut breeding and production. Constructing near-infrared models according to the color of the sample's appearance is beneficial for improving detection accuracy. This study used 282 peanut germplasms with black, red, and pink coats to detect protein content by the Bradford method and the near-infrared spectral value. The Partial Least Squares Regression (PLSR) method was used to construct the near-infrared prediction model. A total of 11 near-infrared prediction models were constructed, including black seed coat crude protein, black seed coat albumin, black seed coat reaching, black seed coat contracting, red seed coat crude protein, red seed coat albumin, red seed coat reaching, red seed coat contracting, pink seed coat albumin, pink seed coat reaching, pink seed coat contracting, etc. The spectral value preprocessing method was a variety of composite processing methods. The best pretreatment methods for black seed coat crude protein, black seed coat albumin, black seed coat reaching, and black seed coat contracting models were Baseline + Detrend, Detrend + MSC, 2nd-der+Detrend+1st-der, Baseline + SNV, respectively. The best pretreatment methods of red seed coat crude protein, red seed coat albumin, red seed coat reaching, and red seed coat contracting model were Baseline + SNV, Baseline + SNV + MSC, SNV + MSC + Baseline, SNV + MSC + Baseline, respectively. The best pretreatment methods of pink seed coat albumin, pink seed coat reaching, and pink seed coat contracting model were 2nd-der+1st-der, 2nd-der+Detrend+1st-der and 2nd-der+Baseline+1st-der, respectively. The model's correlation coefficient ( Rc) was 0.825~0.925, and the root means standard error of calibration (RMSEC) was 0.110 ~1.383. The correlation coefficient ( Rp) of the external validation set of the 11 models ranged from 0.822 to 0.971, and the root mean standard error of prediction (RMSEP) ranged from 0.102 to 0.954. The peanuts with different seed coat colors were detected by other color models and fitted with their chemical values. The correlation coefficients were in the range of 0.002~0.877, and the standard errors were in the range of 0.257~9.464. The correlation coefficients were lower than the correlation coefficients of the external validation set, and the best detection model was the model corresponding to the seed coat color. In this study, a model of peanut protein and its component content with different seed coat colors was constructed, which can quickly and non-destructively detect the content of peanut protein and provide the basis for the selection of raw materials for peanut protein processing and the breeding of specials peanut germplasm.
花生蛋白是世界上优质的蛋白来源, 抗营养因子少。 根据中国营养学会标准, 成年女性日平均需摄入50 g蛋白, 成年男性日平均需摄入60 g蛋白, 以维持生命机体的正常运行[1]。 肉蛋奶是人体补充蛋白的重要形式, 但长期摄入高水平动物蛋白会引起肥胖症, 增加Ⅱ 型糖尿病的患病风险, 如摄入相同水平的花生蛋白则无此顾虑[2, 3]。 花生可直接食用、 可熟食、 可制成小食品食用, 食用方式多样, 易于被人体吸收, 尤其利于乳糖不耐的消费者吸收[4]。 因此花生蛋白逐渐成为替代动物蛋白的重要植物蛋白, 高蛋白花生品种是未来花生育种的重要研究方向。
花生籽仁中蛋白含量在24%~36%, 根据溶解性分为水溶性蛋白和盐溶性蛋白[5]。 水溶性蛋白主要是花生2S清蛋白, 约占10%; 盐溶性蛋白主要包括花生球蛋白、 伴花生球蛋白Ⅰ 、 伴花生球蛋白Ⅱ , 约占90%[6]。 2S清蛋白具高度稳定性, 富含精氨酸、 蛋氨酸等氨基酸, 易溶于水, 但对人体具有过敏原特性[7]。 花生球蛋白的热变性温度为104.84 ℃, 空间构象复杂, 三级结构紧凑, 变性协同性差。 伴球蛋白的热变性温度为89.47 ℃, 其溶解性、 表面疏水性、 乳化活性、 起泡能力和热凝胶特性优于球蛋白[8, 9, 10]。 花生籽仁中各蛋白组分比例影响花生制品, 如花生球蛋白和伴球蛋白具有较高的耐热性, 可降低蛋白质的溶解度, 使得自制花生蛋白饮品具有良好的稳定性和独特的花生风味[11, 12, 13]。 已有研究表明花生籽仁中蛋白及其组分具有种质差异[14], 所以在选育高蛋白含量花生种质时, 还需关注蛋白组分, 以获得更好的质地和口感的花生制品, 满足消费者需求。
蛋白含量检测方法主要有凯氏定氮法、 杜马斯燃烧法、 双缩脲法等, 蛋白质组分提取方法主要有冷冻沉淀法和硫酸铵沉淀法。 这些传统方法鉴定过程复杂, 不仅样品消耗大, 且需预处理, 难以实现批量快速检测。 近红外光谱分析法操作方便快捷、 高效准确, 不破坏样品, 可快速批量鉴定目标样品含量。 现已广泛应用于花生含油量、 花青素、 蔗糖、 黄酮、 水分含量等化学成分的定量分析[15, 16, 17]。 花生蛋白近红外分析模型应用比较广泛, 球蛋白、 伴球蛋白含量近红外分析模型现已应用于便携式花生品质速测仪, 至今未有水溶性蛋白近红外检测模型, 且所有模型仅限于粉色种皮的花生籽仁, 对花生蛋白及其组分含量近红外模型需要进一步研究。
大部分花生籽仁的种皮颜色为粉色, 随着特色花生市场的扩大, 黑色和红色种皮的花生因其少见的颜色和丰富的花青素类抗氧化物质日益受消费者喜爱。 已有研究表明花生样品外观颜色严重影响近红外分析其各品质含量, 不同种皮颜色的花生糖含量近红外模型已得到广泛应用[18, 19]。 所以构建红色、 黑色种皮花生蛋白及其组分含量预测模型有助于高蛋白花生种质选育。
本研究通过不同种皮颜色的花生样品进行蛋白质、 清蛋白、 球蛋白及伴球蛋白含量的测定, 用近红外分析仪采集样品光谱, 构建了不同种皮颜色花生籽仁蛋白及其组分含量近红外分析模型, 为高效筛选高蛋白花生种质、 花生加工企业原料的选用提供参考。
选用282份不同种皮颜色的花生种质, 根据本实验室陈淼等采用日本KONICA MINOLTA公司生产的CR-10 Plus色差仪检测的不同花生种皮的色度值(L* , a* , b*)和综合色差E值将282份花生样品分出100份黑色种皮样品, 82份红色种皮样品, 100份粉色种皮样品。 其中229份为中国地方花生品种及育成品种, 53份来自于四粒红和冀农黑3号为亲本衍生的杂交后代。 以上所有种质为河北农业大学花生创新团队提供, 于2022年5月9日种植于河北农业大学清苑试验站, 2022年9月收获, 干燥后4 ℃保存备用。
模型外部验证的材料为四粒红和冀农黑3号杂交衍生后代, 2023年5月播种, 9月收获, 干燥后4 ℃保存备用。
用瑞典波通DA7250近红外分析仪(DA7250 Diode Array Analyzer)采集光谱。 选用仪器中SimplicityTM软件获取光谱信息, 扫描光谱范围为950~1 650 nm, 扫描样品前, 将样品在25 ℃左右的环境中至少放置48 h, 在采集光谱时, 环境温度保持在24~25 ℃, 仪器开机预热30 min, 将均匀饱满的种子装入样品杯并保持其表面平整。 扫描5次, 重复装样3次, 计算平均光谱值用于建立模型。
采集光谱后的花生籽仁经粉碎加入石油醚(60~90 ℃)反复萃取脱脂[20]。 脱脂后的花生粉参照杜寅等的磷酸盐缓冲液提取法浸提花生粗蛋白, 加入0.01 mol· L-1的磷酸缓冲液, 高速匀浆后将调节pH至7.9, 在50 ℃下水浴振荡反应70 min, 4 000 r· min-1离心10 min, 上清液即为总蛋白质浸提液。
花生清蛋白[21]、 球蛋白和伴球蛋白采用硫酸铵沉淀法分级分离进行收集提取。 将花生总蛋白提取液用硫酸铵调饱和度至65%, 高速匀浆, 4 ℃静置过夜后, 在6 796× g 离心20 min, 取其上清透析24 h得到花生清蛋白; 将花生总蛋白提取液用硫酸铵调饱和度至40%, 静置3 h, 10 000× g 离心20 min, 收集沉淀, 将沉淀装入透析袋中透析24 h, 样品经真空冷冻干燥后即为花生球蛋白; 花生伴球蛋白需将已除去花生球蛋白的溶液用硫酸铵调饱和度至65%, 静置、 离心, 去除沉淀, 硫酸铵饱和度调至85%, 静置、 离心, 收集沉淀, 将沉淀装入透析袋中透析24 h, 样品经真空冷冻干燥后即为花生伴球蛋白。 利用Bradford蛋白浓度测定试剂盒中的微孔酶标仪法进行花生粗蛋白含量、 清蛋白含量、 球蛋白含量和伴球蛋白含量的测定。
将采集到的近红外光谱和计算的花生蛋白及其组分含量导入由挪威CAMO公司研发的化学计量学软件The Unscrambler X10.4进行模型构建。 光谱的采集易受到环境、 仪器、 采集人操作等因素的影响, 需要进行光谱预处理, 方法主要有基准化(Baseline)、 多元散射校正(multiplicative scatter correction, MSC)、 标准正态变量变换(standard normal variate transformation, SNV)、 去趋势(Detrend)、 一阶导数(1st derivative, 1st-der)、 二阶导数(2nd derivative, 2nd-der)、 SG平滑等[22], 选用以上方法对近红外光谱数据进行单一及复合处理, 得到最佳预处理方法, 随后利用偏最小二乘回归法(partial least square regression, PLSR)定标模型。 为保证数据拟合性更好, 需剔除异常值, 反复进行交叉验证, 采用外部验证评价模型的稳定性。 模型的稳定性通过模型的决定系数(R2)和标准误差(RMSE)进行筛选, 决定系数高且标准误差低的模型稳健性更好。
选取黑色、 红色、 粉色种皮的家系各15个, 利用构建的预测模型检测蛋白及其组分含量, 并采用上述蛋白及其组分提取与测定的方法获得其化学值, 比较近红外模型预测值和化学值的相关性和准确性。
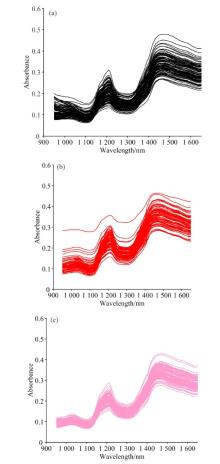
用CR-10 Plus色差仪检测分出的黑色种皮花生, 红色种皮花生, 粉色种皮花生, 样品种皮颜色对比如图1所示。 近红外原始光谱显示不同种皮颜色的花生样品在950~1 650 nm范围内有多个明显的吸收峰, 并且每份花生样品的吸收峰强度均不同(图2), 说明282份花生样品扫描的近红外光谱可用于花生蛋白及其组分含量的定量分析。
 | 图1 不同种皮颜色花生籽仁样品 (a): 红色种皮样品; (b): 黑色种皮样品; (c): 粉色种皮样品Fig.1 Samples of peanut kernels with different coat colors (a): Red peanut kernels; (b): Black peanut kernels; (c): Pink peanut kernels |
采用磷酸盐缓冲液浸提花生粗蛋白, 硫酸铵沉淀法分级分离花生清蛋白、 球蛋白和伴球蛋白, 282份花生籽仁的蛋白及其组分含量的化学值如表1所示, 所测花生种质的粗蛋白含量范围为19.04%~34.87%, 红色种皮花生粗蛋白含量在19.04%~33.89%, 黑色种皮花生粗蛋白含量在19.43%~34.87%, 因前期实验室已有粉色种皮花生粗蛋白含量模型, 所以没有进行粉色种皮花生粗蛋白含量模型的构建。 粉色种皮花生清蛋白含量范围为1.62%~2.98%, 红色种皮花生清蛋白含量范围为1.89%~3.36%, 黑色种皮花生清蛋白差异大于粉色种皮和红色种皮花生, 变异系数达16.33%; 所测花生种质的球蛋白含量范围为10.24%~27.83%, 粉色种皮花生球蛋白含量范围为10.24%~18.23%, 红色种皮花生球蛋白含量范围12.14%~23.68%, 黑色种皮花生球蛋白范围在13.57%~27.83%; 所测花生种质的伴球蛋白含量范围为2.94%~8.07%, 粉色种皮花生伴球蛋白含量范围为2.94%~5.41%, 红色种皮花生伴球蛋白含量范围为3.45%~6.86%, 黑色种皮花生伴球蛋白含量范围在3.14%~8.07%。 在所测花生种质中, 粗蛋白、 清蛋白、 球蛋白和伴球蛋白四种蛋白含量, 均为黑色种皮花生的含量差异大。 与芝麻[23]、 水稻[24]等作物的近红外模型相比较, 本研究所选用的花生种质的蛋白及其组分的变异系数均在11.47%之上, 分布范围广, 具有代表性, 可用于模型构建。
| 表1 不同种皮颜色花生籽仁蛋白及其组分含量的化学测定结果 Table 1 Chemical determination results of protein and its components in peanut seeds with different coat colors |
2.3.1 光谱预处理方法的确定
一般是选用基准化、 多元散射校正、 标准正态变量变换、 去趋势、 导数法SG平滑法、 标准化等预处理方法获得基线校正、 散射校正、 平滑处理和尺度缩放的效果, 提高模型的可靠性和实用性[25, 26, 27, 28, 29]。 本研究根据建模效果选择光谱预处理方法进行构建适用度高且准确的模型, 将光谱预处理方法进行单一预处理以及按照不同顺序进行两个预处理和三个预处理。 根据校正集的决定系数(R2)和标准误差(RMSE)进行筛选, 优先选择决定系数高的为最佳预处理方法。
最终构建11个模型的最佳光谱预处理方法均为复合处理, 如表2所示。 在11个模型最佳预处理方法中Baseline光谱预处理方法用于黑色种皮花生粗蛋白含量、 黑色种皮花生伴球蛋白含量、 红色种皮花生粗蛋白含量、 红色种皮花生清蛋白含量、 红色种皮花生球蛋白含量、 红色种皮花生伴球蛋白含量和粉色种皮花生伴球蛋白含量7个预测模型; SNV光谱预处理方法在5个预测模型中用到; Detrend、 1st-der、 2nd-der、 MSC在4个预测模型中用到; 其中, Baseline+SNV适用于黑色种皮花生的伴球蛋白含量和红色种皮的粗蛋白含量; 2nd-der+Detrend+1st-der适用于黑色种皮花生球蛋白含量和粉色花生球蛋白含量; SNV+MSC+Baseline适用于红色种皮花生球蛋白含量及其伴球蛋白含量。
| 表2 不同种皮颜色花生籽仁蛋白及其组分含量光谱值的最佳预处理方法和预测模型 Table 2 Optimal pretreatment method and prediction model for the spectral values of protein and its components content of peanut seed with different coat colors |
2.3.2 花生蛋白及其组分含量的近红外模型的构建与验证
将筛选出不同种皮颜色花生蛋白及其组分含量的模型与其各自的化学值分别进行拟合光谱处理, 利用偏最小二乘回归法(PLSR)化学计量方法构建模型的同时, 选择偏离趋势线程度较大的数值进行剔除, 综合比较模型间决定系数(R2)和标准误差(RMSE)来筛选最佳模型。
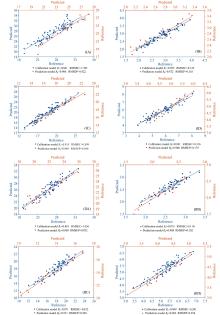
用黑色、 红色、 粉色花生各15份对构建的相应模型进行外部验证(表2), 以确定预测模型的准确性。 在构建的黑色种皮花生测定模型中, 黑色种皮花生粗蛋白含量模型的预测值和化学值相关系数达0.906(图3Ⅰ A); 清蛋白含量模型的预测值和化学值相关系数达0.872(图3Ⅰ B); 球蛋白含量模型的预测值和化学值相关系数达0.969(图3Ⅰ C); 伴球蛋白含量模型的预测值和化学值相关系数达0.940(图3Ⅰ D)。 在构建的红色种皮花生测定模型中, 粗蛋白含量、 清蛋白含量、 球蛋白含量、 伴球蛋白含量模型的预测值和化学值相关系数分别为: 0.869、 0.908、 0.971、 0.963(图3Ⅱ A、 图3Ⅱ B、 图3Ⅱ C、 图3Ⅱ D)。 粉色种皮花生清蛋白、 球蛋白、 伴球蛋白模型的预测值和化学值相关系数分别为: 0.822、 0.886、 0.907(图3Ⅲ B、 图3Ⅲ C、 图3Ⅲ D)。 所有构建的预测模型经外部验证后, 相关系数在0.822~0.971范围内。
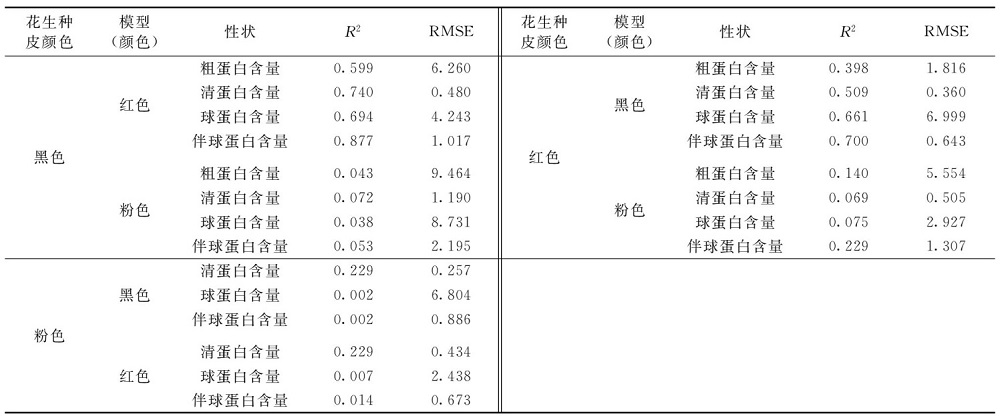
为检测样品外观对预测模型的影响, 利用一种颜色的模型检测另外两种种皮颜色的花生蛋白及其组分含量, 并与其化学值进行拟合分析, 计算其相关系数和标准误差(表3)。 粉色种皮花生用黑色、 红色模型分析, 相关系数低于0.229; 红色种皮花生用黑色、 粉色模型分析, 相关系数低于0.700; 黑色种皮花生用红色、 粉色模型分析相关系数在0.038~0.877之间, 均低于相应的外部验证集相关系数。 其中, 黑色种皮花生用红色模型检测, 各组分含量的相关系数均大于其他检测的相关系数, 用红色模型检测黑色种皮花生伴球蛋白含量相关系数为0.877, 高于近红外模型应用的标准0.8, 但低于黑色种皮花生用黑色模型检测的相关系数0.940, 且红色种皮花生用黑色模型检测的相关系数较低, 这可能由于检测组分越相近, 样品种皮颜色越深, 吸光度越大[18], 导致黑色种皮和红色种皮花生被红色和黑色模型检测时, 相关系数较高; 同时与近红外分析仪本身的性能也有关, 在如何提高机器性能方面进行深入研究, 通过调节参数, 免除区分种皮颜色构建模型的繁琐, 这将是未来近红外仪研制的发展方向。 因此本研究最佳的检测模型是种皮颜色相对应的模型。
| 表3 利用不同种皮颜色模型检测花生籽仁蛋白及其组分含量的相关性 Table 3 The correlation between protein and its components in peanut kernel was detected by using different seed coat color models |
以黑色、 红色、 粉色三种种皮颜色作为检测分类标准, 分别构建检测粗蛋白、 清蛋白、 球蛋白和伴球蛋白含量的近红外模型, 校正集决定系数为0.825~0.925, 外部验证相关系数为 0.822~0.971, 利用不同种皮颜色模型进行相互验证, 相关系数为 0.002~0.877。 本研究构建的近红外检测模型消除了样品种皮颜色的影响, 专色专用, 可快速无损、 准确系统地检测花生蛋白及其组分含量。
本研究构建的近红外模型可在近红外光谱仪(型号DA7250, Perten公司出品)中, 与检测脂肪、 蔗糖等品质性状的模型同步、 整体地检验花生品质, 实现多指标同时鉴定, 为花生品质育种加快进程以及花生蛋白加工原料的选择提供便利。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|