作者简介: 高乐乐, 女, 1995年生, 山东大学齐鲁医学院药学院博士研究生 e-mail: 1597676712@qq.com
作为一种绿色安全的食品药品配料, 甜菊糖具有广阔的应用前景, 然而吸湿性是其面临的一大难题, 同时也是大多数制剂原辅料普遍存在的问题, 研究分析吸湿的过程状态并提出针对性解决办法具有重要的理论意义和应用价值。 利用近红外光谱分析技术结合化学计量学方法对甜菊糖吸湿过程进行表征、 解析, 从而揭示吸湿过程中水的吸附方式和键合作用; 通过吸湿过程光谱并采用外部参数正交(EPO)算法消除样品中水分的影响, 建立甜菊糖中莱鲍迪苷A(RA)含量的快速分析方法。 研究表明, 甜菊糖吸湿过程初始, 水分子迅速吸附在甜菊糖粉末表面形成单分子层; 之后, 表面吸附位点变少, 吸湿速率明显变慢, 水分子将同时吸附在单分子层之上; 最后, 甜菊糖整体吸湿达到饱和状态, 含水量保持稳定。 揭示水分吸收规律后, 利用EPO算法建立RA定量模型, 模型外部测试集的均方根误差、 决定系数和预测相对标准偏差分别为0.669 5%, 0.957 0和4.336 8, 与未使用水分校正所建模型相比有较大提升, 表明EPO算法可以有效去除吸湿的影响。 该研究利用近红外光谱技术对甜菊糖吸湿过程中水的变化进行了表征, 同时利用EPO算法有效消除吸湿的影响, 实现对甜菊糖成品中RA的快速测定, 为其进一步的研究和使用提供参考。
As a green and safe food and drug ingredient, stevia has broad application prospects. However, moisture absorption is a major problem it faces, which is also a common problem in most preparations raw materials. Research and analyze the process state of moisture absorption, then proposed targeted solutions have important theoretical significance and application value. Near-infrared spectroscopy analysis technology combined with chemometric methods were used to analyze the moisture absorption process of stevia in this study. On this basis, the External Parameter Orthogonalisation (EPO) algorithm was used to eliminate the influence of sample moisture, and to establish a rapid analysis method for Rebaudioside A (RA) content in stevia. The results showed that at the beginning of the moisture absorption process of stevia, water molecules were rapidly adsorbed on the surface of the stevia powder to form a monomolecular layer; after that, the surface adsorption sites became fewer, the moisture absorption rate became significantly slower, and water molecules would be adsorbed on top of the monomolecular layer at the same time; finally, the overall moisture absorption of stevia reached its saturated state, and the water content remained stable. After revealing the law of moisture absorption, the RA quantitative model was established using the spectrum preprocessed by the EPO algorithm, the root mean square error, coefficient of determination, and predicted relative standard deviation of the external test set of the model were 0.669 5%, 0.957 0 and 4.336 8, respectively. Compared with the model built before EPO treatment, there was a big improvement, indicating that the EPO algorithm could effectively remove the influence of moisture absorption. In this study, near infrared spectroscopy was used for the first time to characterize the water changes during the moisture absorption of stevia, at the same time, the EPO algorithm was used to effectively eliminate the influence of moisture absorption and realize the rapid determination of RA in stevia products, which provides a reference for its further research and use.
莱鲍迪苷A(rebaudioside A, RA)是新型天然甜味剂甜菊糖苷的主要成分, 甜菊糖苷提取自菊科植物甜叶菊的叶片, 以其高甜度、 低热量、 味质好、 无毒副作用等特点, 在食品、 药品工业中得到了广泛应用, 被国际上誉为“ 世界第三糖源” 。 作为新糖源, 目前报道的甜菊糖生物活性非常广泛, 主要有调节糖代谢、 增强心血管系统和肾脏功能、 抗菌抗病毒、 抗炎等[1]。 然而, 与大多数制剂原辅料相同, RA具有较强的吸湿性, 在与空气接触时极易吸湿, 导致黏性增加, 从而容易造成结块、 增重、 色泽加深等问题, 进而影响产品质量。 吸湿问题一直是生产工作中较为普遍的难题, 研究分析物质吸湿的过程, 对于确定储存条件、 制定生产工艺、 选择包装方法、 预测产品稳定性等具有重要的理论意义和应用价值。
近红外光谱(near infrared spectroscopy, NIRS)主要表征有机物含氢基团的倍频和合频吸收, 已用于研究各种物质的氢键水合作用。 已有研究证明采用NIRS表征吸湿过程是可行的, 但对于甜菊糖吸湿过程的光谱表征还没有相关报道。 本研究利用NIRS对甜菊糖的吸湿过程进行表征, 从分子水平揭示水的吸附方式和键合作用, 更深层次地解释吸湿过程, 为确定生产周期、 建立防潮技术等提供参考。 由于吸湿水分, 甜菊糖的光谱发生变化常常导致模型预测不准确, 外部参数正交(external parameter orthogonalisation, EPO)方法是基于主成分分析(principal component analysis, PCA)把所有光谱投影到不需要干扰变量(如水分、 温度)的正交空间从而达到扣除无用信息的作用[2, 3], 本研究可以用此方法消除吸湿对定量分析模型的影响。 过去EPO算法在构建外部干扰因素时, 仅靠几种限定的人为线性变化, 忽略实际应用的复杂性。 本研究利用NIRS结合化学计量学方法以及重量分析法对甜菊糖的吸湿过程进行表征, 进而将上述的吸湿全过程作为变量构建正交光谱矩阵, 从而获得外部参数的所有信息, 有效消除水分对RA含量测定的影响, 最终建立近红外定量预测模型。
Antaris Ⅱ 傅里叶变换近红外光谱仪(Thermo Fisher Scientific, USA), 附件配置: 漫反射积分球模块, 10 mm样品杯, RESULT-Integration近红外光谱采集软件; 分析天平BSA224S-CW(赛多利斯科学仪器有限公司); 电热恒温鼓风干燥箱DHG-9240A(上海精宏实验设备有限公司)。
不同RA含量的甜菊糖样品由山东圣旺药业股份有限公司提供, 按照《中华人民共和国国家标准(GB 8270— 2014)》中甜菊糖苷检测方法测量得到RA的含量(质量分数, 以干基计), 样品为白色结晶性粉末, 规定含水量不得超过5.0%。
吸湿过程表征: 精密称定干燥至恒重的样品1 g(M0)放入扁形称量瓶中, 称定称量瓶与样品的质量(M1), 称量瓶盖打开并放置于恒温恒湿环境中模拟实际贮存环境进行吸湿, 此过程共持续4 h。 样品每隔10 min精密称定称量瓶与样品的质量(Mi), 根据不同时间点下的质量变化, 计算该时间点的吸湿率, 并以吸湿时间为横坐标, 吸湿百分率为纵坐标, 绘制吸湿动力学曲线[4, 5]。 实验在3 d内重复3次, 取三次实验的平均值作为原始数据。 吸湿率计算如式(1)所示
式(1)中, M0为精密称定的初始干燥失重样品质量; M1为称量瓶与初始样品的总质量; Mi为不同时间点称量瓶与样品的总质量, i=0, 10, 20, …, 240 min, i的间隔为10 min, 共持续4 h。
含量快速测定样品: 为了获得相似的预测精度, 高中低含量样品的均匀分布必不可少, 准备RA含量在90.26%~98.29%范围内的55份样品, 密封储存, 备用。
吸湿样品每隔10 min装于样品杯中(与重量法时间点相对应), 利用近红外光谱仪积分球模块采集样品近红外漫反射光谱, 每个样品重复采集3次, 取平均光谱作为样品原始光谱, 以空气为参比, 每小时采集一次背景光谱, 光谱采集参数设置: 扫描范围为10 000~4 000 cm-1(在本研究中转化为波长), 分辨率8 cm-1, 扫描次数32次, 增益2x。 用于含量测定的55份样品按照上述同样的仪器参数采集光谱。
对于甜菊糖吸湿过程, 本研究从吸湿开始到结束共得到25幅光谱, 分别利用二阶导数、 PCA和二维相关光谱分析(two-dimensional correlation spectroscopy, 2D-COS)进行吸湿过程水分的定性分析, 从而揭示水的吸附方式以及键合作用。
对于甜菊糖RA含量的快速测定, 本研究共得到55幅光谱, 利用偏最小二乘回归(portial least squares regiesscion, PLSR)算法, 将样品的近红外光谱数据与其对应的RA含量数据相关联, 建立RA的定量分析模型。 具体操作: (1)利用SPXY(sample set partitioning based on joint x-y distance)分类方法按照4∶ 1的比例将50幅光谱分为校正集、 验证集, 另有5份样品作为外部测试集; (2)使用EPO算法对光谱进行预处理, 通过第一部分吸湿过程的光谱构建干扰变量, 以消除吸湿水分的影响; (3)采用模型评价参数校正均方根误差(RMSEC)、 验证均方根误差(RMSEP)、 校正集决定系数
数据采用Matlab2016b(MathworksInc., 美国), SPSS Statistics 20.0(IBM, 美国)以及2D Shige软件(森田学理大学, 日本)进行处理。
1.4.1 EPO算法流程
EPO针对外部干扰变量如湿度、 温度等单独构建影响模型, 只对代表性样品进行测试, 从而大大降低模型建立的复杂度。 在本研究中, 主要运用此算法消除甜菊糖吸湿对光谱造成的影响[6]。 在矩阵形式下, 原始光谱矩阵X(m× n)可以表示为式(2)
式(2)中, C为光谱有用部分的投影矩阵(n× n): 有用光谱矩阵X'=XC; Q为光谱中受水分影响的无用部分的投影矩阵(n× n): 无用光谱矩阵X″=XQ; R为残差矩阵(m× n)。
EPO的目的是获得有用的光谱X'=XC, 矩阵C的求取是关键, 具体方法为[7]:
(1)计算外部参数的差异光谱矩阵D, D=Xi-X0, 本研究利用第一部分吸湿全过程的光谱变化构建差异光谱矩阵, 克服了过去单一线性变化的局限;
(2)对D进行PCA分析, D=TPT, P为载荷矩阵;
(3)定义因子个数c, 得到Pc子载荷矩阵, 原则上c为P的前几列, 占据总体的99%以上;
(4)通过PPT计算Q无用信息投影矩阵;
(5)计算有用信息投影矩阵C=I-Q, I为单位矩阵;
(6)对原始光谱数据进行变换X'=XC。
2.1.1 吸湿曲线
甜菊糖的吸湿曲线如图1所示, 含水量随着时间延长逐渐增加并最终因饱和吸附而保持不变。 吸湿曲线在刚开始上升较陡, 吸湿速率较快; 之后曲线上升逐渐平缓, 吸湿速率较慢; 最后逐渐达到平衡状态。
2.1.2 吸湿模型
为了使吸湿数据更为直观准确, 利用SPSS 20.0软件对吸湿数据做二项式回归曲线拟合, 确定吸湿动力学模型[8]。 得到的吸湿方程为F=at2+bt+c(a< 0), 决定系数R2越接近1, 说明模型拟合越好, 吸湿曲线适应性强[9]。 对其进行两次一阶求导, 得到吸湿速度方程v=dF/dt=2at+b、 吸湿加速度方程v'=dv/vt=2a。
吸湿刚开始时t=0, v0=b, 吸湿平衡时间t'=-b/2a, 由表1甜菊糖吸湿动力学模型可知, 甜菊糖吸湿作用在191 min达到平衡, 平衡含水量为7.538%。
| 表1 甜菊糖的吸湿动力学模型 Table 1 Moisture absorption kinetic model of stevia |
2.2.1 吸湿过程光谱
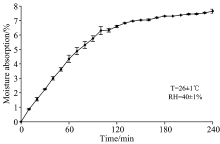
在近红外区域, OH具有两个特征吸收带, 其峰值分别位于1 420 nm(第一倍频)和1 920 nm(组合频)左右, 这些吸收带较强, 尤其是OH的组合频区域, 其确切位置和宽度会随化学和物理环境而略有变化。 图2(a)为甜菊糖样品在吸湿过程中的原始光谱, 可以看出在不同的水分水平下, 样品的光谱特征有显著的差异。 图2(b)为原始光谱经多元散射校正(multiple scattering correction, MSC)处理后的光谱, 该方法可有效消除基线漂移, 消除因颗粒大小不同而对光谱引起的影响, 随后的数据均以此为基础进行分析。 图2(c)为OH的组合频区域局部放大图, 其峰值随着吸湿时间延长不断增加, 表明吸湿过程水分在不断增多。 图2(d)为其对应的二阶导数光谱, 1 911 nm主要与表面水有关, 而1 944 nm与结合水有关[10], 表面水为直接吸附在物质上的水分子, 结合水为吸附在表面水之上的水分子。 吸湿前1 h, 1 911 nm处的表面水峰值(绝对值)迅速升高, 而在之后变化趋势不明显, 这可能意味着吸湿刚开始水分子迅速吸附在甜菊糖粉末表面; 之后, 表面吸附位点减少, 吸湿速率明显变慢; 已被吸附的水分子也具有吸附能力, 额外的水分子将同时在表面附加吸附, 形成不易消散的结合水, 结合吸湿曲线可知此过程持续2 h, 190 min以后甜菊糖总体吸附达到饱和, 吸湿量不再增加[12]。
2.2.2 含量测定光谱
55份不同RA含量的甜菊糖光谱如图3所示, (a)为原始近红外光谱图, (b)为经过MSC处理之后的光谱图。
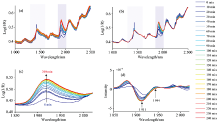
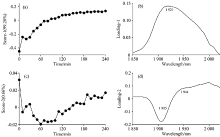
为了明确甜菊糖吸湿过程中水分子的变化情况, 对OH的组合频区域进行了PCA, 图4分别显示了吸湿过程光谱的前两个主成分的得分和载荷。
第一个主成分得分变化趋势如图4(a)所示为逐渐增加而后趋于平稳, 与吸湿曲线相吻合, 其载荷特征在图4(b)为以1 921 nm为中心的宽峰。 第一主成分贡献率为99.28%, 可以认为第一主成分解释为吸湿过程的含水量变化。
第二主成分得分如图4(c)所示, 有先降低再升高, 然后趋于稳定的趋势, 其载荷图4(d)在1 905 nm处以负峰为主, 在1 944 nm处以正峰为主, 其特征分别是氢键较弱的表面水和氢键较强的结合水。 第二个主成分贡献率为0.66%, 整个吸湿过程可分为三个区域, 前1 h和中间2 h以及最后1 h, 可以认为吸湿刚开始表面水较多, 随着吸湿进行, 结合水增多, 最后整体吸附达到饱和而趋于稳定。
为了进一步探究甜菊糖吸湿过程中水的细微变化, 在PCA得到的吸湿过程三阶段的基础上进行二维相关光谱(2D-COS)分析。
图5分别为吸湿1 h、 中间2 h以及最后1 h的同步谱与异步谱, 红色实线表示正号, 蓝色虚线表示负号。 在图5(a1)中, 同步光谱在1 911 nm左右出现自相关峰, 代表水的弱氢键; 在图5(b2)中, 自相关峰在1 936 nm 出现, 自相关峰红移表明形成了更多的氢键, 这代表更多的结合水发挥作用; 在图5(c1)中, 自相关峰位置不变, 提示吸附饱和。 与此同时在1 885和1 936 nm处出现了负交叉峰, 表明1 885 nm的自由水与1 936 nm的结合水变化趋势相反, 自由水随着吸湿不断减少, 而结合水增多。
根据Noda[12]规则, 图5(a2)吸湿开始1 h和(b2)吸湿开始2 h中异步光谱显示的光谱变化序列如下: 吸湿1 h时1 911 nm> 1 890 nm, 相比于自由水, 水更容易与甜菊糖结合形成表面水; 吸湿中间2 h, 1 944 nm< 1 905 nm, 尽管此过程已有大量的结合水, 但水依然更容易与甜菊糖形成表面水, 表面水氢键作用力强于结合水。 随着吸湿进行, 甜菊糖表面吸附位点变少, 吸附速率明显变慢。 最后1 h的异步光谱图5(c2)吸湿最后1 h异步光谱显示噪声谱附近的零相关强度, 此过程甜菊糖整体吸附饱和。
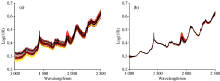
EPO通过消减水分影响的光谱信息, 剔除吸湿对其近红外光谱的影响, 图6(b)为吸湿过程差异光谱图, 从图中可以看出, OH的组合频区域变化最为明显, 符合实际吸湿情况。 接着对其进行PCA投影无关的正交空间, 本模型中需要优化的参数是EPO因子个数c和PLSR的潜在变量数LVs, 通过样品集的交叉验证均方根误差(RMSECV)值进行优化以提高EPO-PLSR模型的预测精度, 不同c和LVs的组合所产生的交叉验证误差如图6(c)所示, 结果表明, 在1个因子作用下时RMSECV值最小, 所以最终选择c=1。 最后通过扣除无用矩阵, 得到的有用光谱如图6(d)所示, 与没有进行水分校正的光谱图6(a)相比, 水分引起的光谱变化减小, 光谱的重复性更好。
2.5.1 模型建立
在RA的NIRS定量模型的建模过程中, RMSECV随着LVs的变化如图7(a)所示。 通过模型优化, 最终以EPO+MSC组合方法对样品的原始近红外光谱进行预处理, 选定最佳主成分数为5, 建立甜菊糖RA含量的NIRS定量分析模型, 模型结果图7(b)所示, 校正集和验证集的参考值与预测值在1∶ 1直线两侧对称且紧密分布, 且RMSEC, RMSEP,
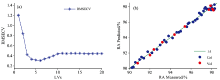 | 图7 (a)RMSECV随着LVs的变化情况; (b)甜菊糖RA的NIRS定量分析模型建模结果Fig.7 (a) LV-RMSECV curve; (b) NIRS quantitative analysis model of RA content in stevia |
2.5.2 模型验证
选取不用于建模的外部测试集样品, 以建立的定量分析模型预测RA含量, 由表2可知, 与未使用水分校正方法相比, 使用EPO算法的RA定量分析模型预测值和参考值更为接近且两组数值之间无显著性差异, 预测误差明显更小, RPD值大于3, 以上结果说明EPO对水分有较好的校正效果, 可以用来消除吸湿对近红外光谱预测带来的影响, 提高模型预测的准确度。
| 表2 RA的NIRS定量分析模型外部测试集结果 Table 2 External test sets results of RA's NIRS quantitative analysis model |
利用近红外光谱结合二阶导数、 PCA和2D-COS分析可以揭示甜菊糖吸湿过程中水的吸附方式和键合作用, 结果表明, 吸湿过程刚开始, 大气中的水分子迅速吸附在甜菊糖粉末表面形成单分子层, 此阶段的水为表面水; 表面吸附趋于饱和之后, 额外的水分子将同步在单分子层之上附加吸附, 形成了结合水, 对氢键网络起稳定作用; 之后, 甜菊糖整体吸湿达到饱和状态, 含水量维持平衡不变。 在此基础上, 利用EPO算法对样品吸湿水分而造成的光谱变化进行校正, 比较EPO算法和无处理的建模效果, 结果显示利用EPO预处理后的校正模型预测误差更小, 表明EPO法对水分有较好的校正效果。 本研究更深层次地理解了甜菊糖吸湿过程, 为确定生产周期、 预测产品稳定性、 建立防潮技术提供参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|