作者简介: 卢礼萍, 女, 1977年生, 南京农业大学理学院副教授 e-mail: lplu0227@njau.edu.cn
利用紫外-可见分光光度计, 检测了乙醇/水溶液中, 不同温度下叶黄素吸收谱, 并探测了光谱随时间的变化。 结果表明, 在1∶1乙醇/水溶液中, 高浓度和低浓度样品中, 叶黄素H-聚集体随温度升高呈线性降低规律。 1∶2溶液中, 叶黄素聚集结构不随温度变化而变化, 结构稳定。 对其吸收光谱的动力学检测发现, 1∶1溶液中, 随着时间的推移, H-聚集体呈指数增加。 分析认为, 溶液中水分子的氢键是形成叶黄素聚集结构的决定因素, 水分子和氢键数目的增加促使叶黄素形成稳定的H-聚集结构。
The absorption spectra of lutein in ethanol/water solution at different temperatures were measured by UV-Vis spectrophotometer and the spectral changes with time were studied. The results showed that in 1∶1 ethanol/water solution, the probability to form H-aggregate in two samples with different concentration (25.6 and 10.2 μmol·L-1) decreased with increasing temperature. In 1∶2 ethanol/water solution the stable aggregated structure didn’t change with temperature. Kinetic detection of absorption spectra of 1∶1 ethanol/water solution indicated that the absorption of H-aggregate increased exponentially as time went by. It was concluded from analysis that the hydrogen bonds of water play an important role in the formation of aggregates. The increase of water molecules and hydrogen in ethanol/water solution leads to the formation of stable aggregated structure.
类胡萝卜素分子是一种线性链状多烯类生物分子, 分子中含有π 电子共轭双键的碳骨架, 两头分布有酮环。 自然界中, 类胡萝卜素分子分布广泛。 在植物中, 类胡萝卜素分子能吸收太阳能并转移给叶绿素a分子, 同时还能通过猝灭三线态的叶绿素来保护光器官[1]。 在动物体内, 类胡萝卜素分子具有猝灭单线态氧、 清除生物体内自由基的功能[2, 3]。 现代研究还表明, 叶黄素类分子具有较好的抗氧化功能, 已经成为功能性食品和药品研究的热点课题[4, 5]。
然而由于类胡萝卜素分子的疏水性, 作为药物试剂发挥其抗氧化功能, 受到了多种因素限制。 大部分的类胡萝卜素分子不溶于水, 而食品和生物体内都存在着水, 类胡萝卜素分子在这类体系中的存在状态受到越来越多的关注[6]。 研究表明, 在含水的有机溶剂中, 类胡萝卜素分子形成聚集状结构, 该结构受到多种因素的影响, 例如温度、 pH值、 表面活性剂等[7, 8]。
紫外-可见吸收光谱法是研究聚集体最常用的方法, 用来判断形成聚集种类[9]。 聚集形成后, 由于协同效应, 激发态能级分裂。 当下能级为允许的跃迁时, 吸收谱发生红移, 对应着首尾相连的J-聚集结构; 当上能级为允许的跃迁时, 吸收谱蓝移, 对应着面对面的H-聚集结构。 紫外-可见光谱结合CD谱、 及各种显微技术, 可用来研究更加复杂的聚集结构, 例如一维螺旋型、 二维鱼骨架型、 三维圆柱形等。 本文利用紫外-可见吸收光谱法研究了叶黄素聚集结构随温度和时间的变化, 其结果可为开发和利用叶黄素的抗氧化功能提供依据。
叶黄素(92%)购买于上海源叶生物技术公司, 溶解于乙醇中形成两种浓度的单体溶液(25.6和10.2 μ mol· L-1)。 每种浓度溶液各取2份, 每份5 mL, 置于水浴加温至指定温度。 待温度稳定后, 分别往样品加入5和10 mL去离子水, 使乙醇/水的比例为1∶ 1和1∶ 2。 5 min后, 用紫外-可见分光光度计(SHIMADZU UV1700)测得吸收谱, 扫描范围为300~550 nm。 研究叶黄素结构动力学时, 倒入水后每隔30 s检测一次样品。
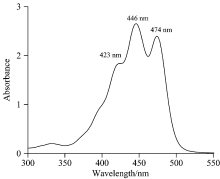
类胡萝卜素单体分子的吸收主要位于350~550 nm范围内, 并伴随多个振动吸收。 由于C2h对称性, 类胡萝卜素分子电子基态S0到第一激发态S1的跃迁是禁止的, 其吸收谱主要来自于电子基态S0到第二激发态S2的π 电子的跃迁。 图1是常温下(20 ℃)叶黄素的单体吸收光谱。 图中位于长波段474 nm处的吸收峰来自于0→ 0的跃迁; 最大的吸收峰位于446 nm, 来自于0→ 1的跃迁; 420 nm的吸收峰来自于0→ 2的跃迁; 短波段300~350 nm处的弱峰来自于更高振动态的跃迁。
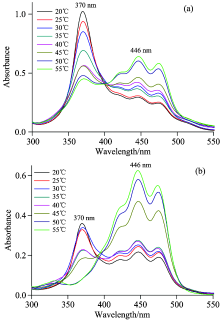
类胡萝卜素的有机溶剂中, 加入水后单体分子会发生聚集。 相对于单体分子, 聚集体的吸收光谱发生红移或蓝移[10, 11]。 图2表示不同温度下, 1∶ 1乙醇/水溶液中聚集体的吸收谱。 由图可知, 1∶ 1乙醇/水溶液中叶黄素的吸收谱分为两部分, 一部分是单体446 nm处的吸收, 另一部分370 nm处的聚集体吸收。 根据蓝移程度(76 nm)判断, 溶液中形成的是紧密结构的H-聚集体。 随着温度的升高, 聚集体吸收减弱, 而单体吸收增强。 室温(20 ℃)时, 图2(a)中聚集体与单体最大吸收值之比为3.479, 随着温度的升高, 这一比值下降, 55 ℃时降低至0.705。 图2(b)中, 室温下聚集体与单体吸收值之比为1.659, 当温度上升到45 ℃时, 这一值降低至0.399, 随着温度进一步升高, 聚集体吸收消失, 只剩单体吸收。 叶黄素聚集体中, 碳骨架之间依靠水分子相连。 温度升高, 水分子热运动加剧, 可能脱离碳骨架, 使聚集体解体。 较高温度时(45 ℃以上), 高浓度叶黄素溶液中(25.6 μ mol· L-1), 热运动又使叶黄素相互碰撞的几率增加, 聚集结构不能完全解体, 浓度小的溶液中(10.2 μ mol· L-1), 由于叶黄素分子间距较大, 因此能以单体形式稳定存在。
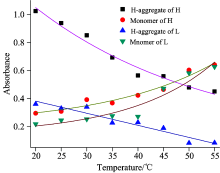
图2中两样品同时存在着单体和聚集体, 我们对溶液中各成分的吸收强度进行了拟合, 如图3所示。 在1∶ 1溶液中, 一部分叶黄素形成H-聚集体。 随着温度的升高, 溶液中聚集体解体成为单体结构。 分子吸收强度与分子浓度成正比, 设溶液中分子浓度随温度的变化关系为
其中[c]表示H-聚集体或单体浓度, [c]0为室温(20 ℃)浓度, K0为常数, k温度变化系数。 利用origin 8.0 对各点进行指数拟合, 得到图3中各拟合曲线, 对应的式(1)中各参数列于表1。 从拟合结果我们发现, 在1∶ 1样品中, H-聚集体的拟合曲线近似成直线形状, 即聚集体浓度随温度增加而线性降低, 用线性关系式表示为
表1中列出了两种线性拟合的参数, 其中高浓度样品中的温度变化系数k高于低浓度样品。
图4为不同温度下, 1∶ 2乙醇/水溶液中两种浓度样品的吸收光谱。 两图中都只出现了370 nm的吸收, 并且随着温度的升高聚集体的吸收光谱峰位不变, 而吸收强度减弱。
| 表1 样品中各组分吸收强度的拟合参数 Table 1 Fitting parameters of absorption intensity of each component in the samples |
由此可知, 当水的比例增到乙醇的2倍后, 溶液中的叶黄素全部聚集成H-聚集结构, 该结构非常稳定, 并未随温度升高而解体。 这是因为当溶剂中的乙醇/水的比例达到1∶ 2时, 溶液中水分子数目大大增加, 虽然温度的升高导致叶黄素和水分子的热运动加剧, 但是即使聚集体内有水分子脱离碳骨架, 周围的水分子又会立刻填入, 确保聚集体结构稳定。
图4中, 两样品中的叶黄素吸收谱均随温度的升高而降低, 其吸收强度随温度变化如小图所示。 图4(a)的高浓度(25.6 μ mol· L-1)样品中, 叶黄素H-聚集体对应的电子吸收强度随着温度的升高迅速下降; 而图4(b)的低浓度(10.2 μ mol· L-1)样品中, 对应的吸收强度下降缓慢。 对比两图, 发现在30~45 ℃范围内, 两者的吸收强度变化最小。 温度的升高导致聚集体的热无序增加, 聚集体的吸收截面减小。 在聚集体浓度较大的溶液中, 由于受到周围聚集结构影响较大, 热运动较低浓度样品中更加无序, 因此随着温度的增加, 吸收强度降低程度较大。
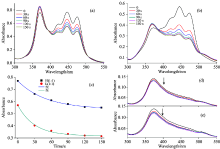
为了研究乙醇/水溶液中, 叶黄素结构的动态变化, 我们对30 ℃下的样品每隔30 s进行一次扫描。 图5(a)和(b)为高浓度和低浓度两样品在1∶ 1乙醇/水溶液的吸收光谱。 由图可知, 两样品中单体吸收随时间减小, 而位于370 nm附近的聚集体吸收谱强度增加。 两样品形成后30 s, 单体和聚集体吸收强度变化最大, 120 s后各吸收谱达到稳定, 即聚集体吸收最大, 单体吸收最小。
图5(c)中的各点为不同时刻两样品中单体吸收强度, 其动力学模型为

得到单体浓度随时间的变化为指数形式
拟合得到的曲线如图5(c)所示, 其拟合参数列于表1。 其中k为单体变化的动力学常数, k为正时, 表示单体减小, 反之表示单体增加。 比较样品发现, 浓度大的溶液中k值较大。
图5(d)和(e)为两浓度样品在1∶ 2乙醇/水溶液中的吸收谱, 随着时间的推移。 聚集体吸收光谱峰位和吸收强度没有变化, 可见溶液中生成的H-聚集体较为稳定。 叶黄素形成聚集体的过程中, 必须要有水分子中的氢键参与。 在1∶ 1的乙醇/水溶液中, 水分子不足以使所有叶黄素都形成聚集结构, 因此形成了单体和聚集体共存的状态。 乙醇与水的溶剂形成后, 放置时间过程中, 水分子的氢键有所增加, 导致溶液中的一部分叶黄素单体又转化为聚集体, 聚集体浓度增加, 叶黄素单体浓度减小。 当乙醇/水的体积比增加到1∶ 2时, 溶液中存在大量的水分子, 足够使得所有的叶黄素单体都形成聚集结构, 随着时间的变化, 聚集体基本保持不变。
利用紫外-可见分光光度计, 检测了不同温度下, 叶黄素乙醇/水溶液的吸收光谱, 及光谱随时间的变化过程。 结果表明, 1∶ 1的乙醇/水溶液中叶黄素单体与H-聚集共存, 并且随着温度的升高, 聚集体解体称为单体。 对各组分吸收强度拟合结果表明, 高浓度样品中具有较高的温度变化系数; 1∶ 2乙醇/水溶液中, 叶黄素均形成较为稳定的H-聚集结构, 随着温度的升高, 聚集体热无序增加, 吸收截面减小, 吸收强度减弱; 对溶液中聚集体结构的动力学研究发现, 随着时间的推移, 溶液也中氢键数目的增加, 使得一部分单体转化为聚集体。 结构变化动力学模拟得到, 高浓度样品中动力学常数为50.588, 比低浓度样品大。 本文的研究结果可为开发可溶性类胡萝卜素的功能食品和药品提供参考。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|