作者简介: 许 晴, 1993年生, 南京大学医学院附属金陵医院(东部战区总医院)放射诊断科博士研究生 e-mail: xuqing_zoey@163.com
脑胶质瘤是最常见的原发性中枢神经系统肿瘤, 其病理分级对患者的治疗决策和预后评估具有重要意义。 回顾性收集2023年1月至2024年1月于东部战区总医院接受胶质瘤手术的患者共53例, 其中高级别胶质瘤33例, 低级别20例。 采用英国InVia激光共焦拉曼光谱仪, 采集胶质瘤患者组织样本的拉曼光谱数据, 每个样本采集50个点。 采用Savitzky-Golay(SG)算法、 平滑光谱曲线和最大最小归一化(max-min normalization)等不同预处理方法对光谱数据进行处理。 通过构建卷积神经网络(CNN)对胶质瘤的高低级别分类诊断, 并将其与支持向量机(SVM)、 随机森林(RF)、 决策树(DT)模型的性能进行了对比。 每个预测模型都使用ROC曲线进行评估。 采用以下四种指标: 准确率、 精确度、 召回率和5折交叉验证(5Fold), 以评价不同预测模型的性能。 实验结果表明, CNN模型在不同分类任务上均显著优于SVM、 RF和DT模型, 其AUC达到0.983 9, 高于其他三种传统模型(SVM, 0.915 7; RF, 0.903 1; DT, 0.780 9)。 因此, 将拉曼光谱与深度学习技术结合, 为脑胶质瘤的分级诊断提供了一种创新思路。 此方法不仅能够提高诊断效率和准确性, 还为未来构建自动化癌症诊断系统奠定了基础。
Gliomas are the most common primary tumors of the central nervous system, and their pathological grading plays a critical role in guiding treatment decisions and prognostic evaluation. In this study, we retrospectively collected data from 53 patients who underwent glioma surgery at the Eastern Theater General Hospital between January 2023 and January 2024. Among these, 33 cases were high-grade gliomas, and 20 were low-grade gliomas. Raman spectral data of tumor tissue samples were obtained using the InVia laser confocal Raman spectrometer (UK), with 50 points collected for each sample. The spectral data were preprocessed using various methods, including the Savitzky-Golay (SG) algorithm, spectral curve smoothing, and min-max normalization. A convolutional neural network (CNN) was developed to classify gliomas into high- and low-grade categories, and its performance was compared with traditional machine learning models, including support vector machines (SVM), random forests (RF), and decision trees (DT). Each predictive model was evaluated using receiver operating characteristic (ROC) curves, and four key metrics- accuracy, precision, recall, and five-fold cross-validation- were employed to assess model performance. Experimental results demonstrated that the CNN model significantly outperformed the SVM, RF, and DT models in various classification tasks, achieving an area under the curve (AUC) of 0.983 9, compared to 0.915 7 for SVM, 0.903 1 for RF, and 0.780 9 for DT. These findings suggest that integrating Raman spectroscopy with deep learning techniques offers an innovative approach to the grading diagnosis of gliomas. This method improves diagnostic accuracy and efficiency and lays a solid foundation for the future development of automated cancer diagnostic systems.
胶质瘤是脑部最常见的原发性肿瘤[1]。 根据世界卫生组织(WHO)分级系统将脑胶质瘤分为Ⅰ — Ⅳ 级。 其中Ⅰ — Ⅱ 级为低级别胶质瘤, 预后相对乐观; Ⅲ — Ⅳ 级为高级别胶质瘤, 肿瘤细胞增殖速度快, 预后较差[2]。 胶质瘤的准确分级对于制定最佳的治疗方案十分重要。 然而, 当前临床主要依赖于组织病理学分析, 该方法不仅存在主观性强、 易受取样误差影响等问题, 还需要较长的检测时间, 难以满足临床快速诊断的需求。
拉曼光谱(Raman spectra, RS)是一种非侵入性、 无标记、 实时的分子成像技术, 能够提供组织微观化学成分信息, 在生物医学领域具有广泛的应用潜力[3, 4, 5]。 目前拉曼光谱识别算法主要采用传统的机器学习方法, 如主成分分析(PCA)、 支持向量机(SVM)等[6, 7]。 然而, 这些方法依赖于人工特征提取, 可能导致信息损失, 且难以有效建模光谱数据的高维非线性特征。 相较而言, 以卷积神经网络(convolutional neural network, CNN)为代表的深度学习方法能够自动学习特征模式, 无需手动干预, 并通过局部感知和参数共享策略提高特征提取的效率[8]。 深度学习联合拉曼光谱在临床实践中已有广泛应用, 如疾病诊断、 抗生素耐药和生物标志物检测[9], 但在胶质瘤分级领域的研究仍较少, 其优势尚未被充分挖掘。
因此, 本研究提出了一种基于深度学习的拉曼光谱胶质瘤分级诊断方法, 利用CNN对拉曼光谱数据进行自动学习, 并与传统分类模型(SVM、 RF、 DT)进行对比分析, 评估CNN在胶质瘤分级中的应用价值。
本研究通过东部战区总医院伦理委员会批准[批件号: 2021DZGZR-YBB-066]。 本研究内容及方法均符合《赫尔辛基宣言》的原则。 回顾性分析2023年1月至2024年1月于东部战区总医院行手术切除的胶质瘤患者, 将经病理证实为胶质瘤者纳入研究。 共纳入53例, 其中男32例, 女21例, 年龄(44.72± 14.49)岁。 新鲜脑组织样本随脑胶质瘤手术取材离体后立即存入液氮, 并于离体后48 h内制作冰冻切片(德国, Leica CM 1950)。 从每个样品中, 切割一个厚度为8 μ m的切片并安装在不锈钢载玻片上进行拉曼光谱检测, 切割一个3 μ m切片并安装在标准载玻片上进行H& E染色, 两个切片是相邻的。
采用In Via显微聚焦拉曼光谱仪(英国, Renishaw公司)进行冰冻切片样本拉曼光谱信号检测。 在本次数据采集工作中, 采用波长785 nm激光光源进行样本扫描, 将激光功率设置为90 mW, 积分时间设置为10 s, L× 50物镜, 光斑直径约1.2 μ m。 使用硅片(520 cm-1)进行光谱校准, 每个光谱信号累积3次。 对每个组织样品选择三个不同的位置进行测量, 扫描范围是400~1 800 cm-1。 由于胶质瘤组织的异质性和复杂性, 从每个组织样品表面随机选择的点收集50个光谱。 因此, 总共收集了2 650个单独的光谱, 其中高级别1 650个, 低级别1 000个。 所有光谱均从肿瘤样本中确认的癌变的最典型处获得, 这些区域由常驻病理学家在拉曼测量之前定位。
采集后的光谱数据使用WIRE(version 4.3 64-bit)软件去除宇宙尖峰, 采用Savitzky-Golay(SG)算法去除由机械振动和背景噪声产生的干扰信号, 平滑光谱曲线以提高信噪比。 经过前期预实验结果, 我们对SG算法的窗口长度和多项式阶数进行了调试。 最终选择了最佳参数组合可以在平滑噪声的同时, 能够较好地保留与胶质瘤分级相关的重要光谱特征。 然后使用最大最小归一化(max-min normalization)来减少信号强度对分析结果的干扰, 将所有光谱强度范围所见到[0, 1]之间。 由于不同样本间的光谱测量存在一定的波动, 通过SG平滑处理可以在一定程度上消除这种随机波动, 使得各样本之间的数据更具一致性和可比性。 这不仅有助于减少因测量波动带来的分类误差, 也提升了模型的鲁棒性和泛化能力。 本研究采用 Savitzky-Golay(SG)算法进行平滑、 基线校正和最大最小归一化(max-min normalization) 作为光谱数据的主要预处理方法。 对于SG平滑算法, 该方法因其能够有效去除随机噪声, 同时保留关键光谱特征, 在拉曼光谱分析中被广泛应用。 在实验初期为证实该方法的可行性, 我们对SG算法中多项式拟合阶数(degree)和滑动窗口大小(size)两个参数进行了优化。 根据信噪比(SNR)和均方根误差(RMSE)判断预处理后数据的质量。 特征峰的查找采用LabSpec6(HORIBA Scientific, Kyoto, Japan) 进行自动检测与拟合, 拟合过程使用Gauss-Loren函数, 参数设定为Level=15%, Size=20。 所有预处理流程均使用Python(version 3.7.1)完成。
基于预处理后的拉曼光谱, 本研究使用了四种经典机器学习算法支持向量机(support vector machine, SVM)、 随机森林(random forest, RF)、 决策树(decision tree, DT), 和深度学习算法卷积神经网络(convolutional neural network, CNN)。 鉴于胶质瘤拉曼光谱数据的复杂性, 目前尚不清楚哪种建模技术能实现对本研究疾病类别的区分, 因此, 本研究旨在通过对比人工智能算法, 构建最优智能诊断模型。 模型性能的好坏取决于模型参数的选择, 因此, 我们使用网格搜索算法, 为每个机器学习模型预先设置尽可能全面的超参数范围, 通过Gridsearch CV函数计算每一种参数组合的准确率; 对CNN模型使用hyperopt进行参数优化。 最终选出最佳参数组合用于模型的训练和验证。 在算法获取拉曼矩阵之前, 我们将输入矩阵按6∶ 2∶ 2的比例划分为训练集、 验证集和测试集。 其中训练集和验证集用于模型构建过程中的校正。 测试集不参与模型的训练, 仅用于测试模型在未知数据中的表现。
本研究所使用的CNN模型的结构如图1所示。 该模型主要由输入层、 卷积层、 池化层和全连接层组成。 输入层用于读取输入矩阵, 分析特征维度, 所使用的信号维度input_shape=(1 376, 1)。 卷积层(Conv1D)用于提取输入层提供的数据特征, 通过滑动滤波器(Filter=8, 16, 32, 64)对输入进行扫描, 捕获数据中的局部模式和结构, 本研究共使用6个卷积层。 为提高模型的表达能力, 在每一个卷积层中我们嵌入一个ReLU激活函数, 用于引入非线性变化, 使得模型能够更好地适应不同类型的数据分布和模式。 在每两层卷积层后, 我们引入一层最大池化层(pool_size=2), 减少冗余信息的传递, 提高模型的泛化能力。 在最后一层池化层, 所有数据特征使用扁平层函数进行“ 拉伸” , 将数据平铺输入全连接层, 本研究仅使用一层全连接层, 在该层中使用sigmoid函数对数据特征进行判别和分类, 给出最终鉴定结果。
采用IBM SPSS 25.0软件进行数据分析, 2组间比较采用独立样本t检验; 定性资料的比较采用χ 2检验。 为了评估四种算法的分类和预测能力, 我们使用了四种评价指标, 即准确率、 精确度、 召回率和5折交叉验证(5Fold), 以及两种可视化方式ROC和混淆矩阵来综合评估模型性能。
53例胶质瘤患者中, 高级别胶质瘤(Ⅲ — Ⅳ 级33例), 低级别胶质瘤(WHO Ⅰ — Ⅱ 级20例)。 高级别胶质瘤患者中男19例、 女14例, 年龄(44.30± 14.41)岁; 低级别胶质瘤患者中男13例、 女7例, 年龄(45.40± 14.96)岁, 2组患者年龄(t=-0.265, p=0.792)、 性别(χ 2=0.287, p=0.592)差异无统计学意义。
表1提供了每个参数组合下所获取的光谱数据质量, 可以看到当size=7, degree=3时, 光谱质量最佳, SNR=31.932 009 5, RMSE=30.105 000 86。
| 表1 SG参数优化 Table 1 SG parameter optimization |
归一化操作能够确保所有拉曼信号在同一量纲下进行分析, 有效提高模型的拟合速度。 最大最小归一化能够不改变数据的相对分布, 保持数据的原始形状和特征。 在这里提供了最优模型CNN在归一化前后性能的变化, 可以发现归一化后的模型准确率得到有效提升(表2)。
| 表2 CNN归一化前后性能 Table 2 CNN performance before and after normalization |
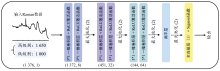
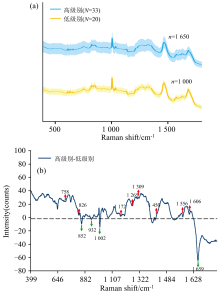
图2(a)显示了从低级别胶质瘤(n=1 000, 黄线)和高级别胶质瘤(n=1 650, 蓝线)获得的平均标准化拉曼光谱图。 尽管两种类型的组织具有几乎相似的模式, 但拉曼位移的强度存在差异。 高级别胶质瘤组和低级别胶质瘤组拉曼信号强度的主要差异在于大多数氨基酸、 脂质和核酸相关峰(758、 828、 1 172、 1 265、 1 309、 1 556和1 606 cm-1)在高级别胶质瘤组中明显更高。 相比之下, 而少数氨基酸相关峰如1 002和1 659 cm-1, 在低级别胶质瘤组中更高[图2(b)]。 根据现有文献, 本研究胶质瘤组织拉曼峰的位置和主要归属列在表3 中。
| 表3 脑胶质瘤组织切片拉曼峰归属表 Table 3 The Raman peak positions and major assignments in glioma tissue sections |
各种光谱分类器(CNN、 SVM、 RF、 DT)的分类结果如表4所示。 从表4中可以看出, CNN对高低级别胶质瘤组织样本光谱数据所建模型分类正确率为(98.15%)、 精确度(98.40%)和召回率(96.76%), SVM对高低级别胶质瘤组织样本光谱数据所建模型分类正确率为(90.34%)、 精确度(94.20%)和召回率(82.63%), RF对高低级别胶质瘤组织样本光谱数据所建模型分类正确率为(88.64%)、 精确度(83.10%)和召回率(86.29%), DT对高低级别胶质瘤组织样本光谱数据所建模型分类正确率为(80.83%)、 精确度(82.20%)和召回率(71.35%)。 显然, CNN模型均优于其他三种传统分类方法。
| 表4 不同算法分类结果对比 Table 4 Comparison of classification results using different algorithms |
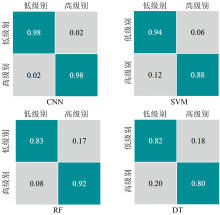
为了进一步比较CNN模型和传统算法对高低级别胶质瘤的鉴别能力, 分别得到CNN, SVM, RF和DT模型的混淆矩阵, 如图3所示。 从图3中可以看出, 基于CNN方法所建模型的误判个数最少, 同时CNN模型对鉴别高低级别胶质瘤的灵敏度和特异性均高于其他算法所建模型, 结果表明CNN模型相比传统算法模型在鉴别高低级别胶质瘤方面具有明显优势。
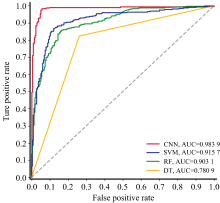
为了定量评估各分类器的性能, 本研究采用了ROC曲线(receiver operating characteristic curve)分析。 ROC曲线是评估二分类器在不同决策阈值下表现的常用工具, 它通过绘制真阳性率(true positive rate, TPR)与假阳性率(false positive rate, FPR)之间的关系, 直观反映了分类器在敏感性(sensitivity)和特异性(specificity)之间的权衡情况。 与此同时, 曲线下面积(area under the curve, AUC)作为综合评价指标, 其数值介于0与1之间, AUC值越高表明分类器整体性能越好, 能够更有效地区分正负样本。 在本研究中, 我们绘制了CNN、 SVM、 RF和DT四种算法的ROC曲线(见图4), 并计算了各自的AUC值, 分别为0.983 9、 0.915 7、 0.903 1和0.780 9。 可以看出, CNN的AUC值最高, 显示出极高的敏感性和特异性, 证明其在胶质瘤高低级别的鉴别上具有显著优势。 相比之下, 其他传统分类方法虽然也表现出较好的分类能力, 但在性能上仍不及CNN。 因此, CNN 在该任务中表现更优, 验证了深度学习联合拉曼光谱在胶质瘤分级中的应用潜力。
脑胶质瘤的组织学分级是评估肿瘤生物学行为的关键指标之一, 同时也是制定临床治疗方案的重要依据。 低级别胶质瘤侵袭性较低, 通常可以进行较大范围的切除, 从而减少复发的风险。 高级别胶质瘤由于其边界模糊和高侵袭性, 在保留功能的前提下应尽量彻底和更扩大范围切除包括一些非功能区的水肿带。 近年来, 拉曼光谱分子成像技术凭借其出色的化学特异性, 可以提供生物样品微观生化信息的变化, 为肿瘤的分类提供支持。 已有研究结合拉曼光谱与传统机器学习方法, 用于肿瘤分级和边界识别, 并取得了一定成效。 既往研究中, Hollon等[10]使用受激拉曼组织学(stimulated Raman histology, SRH)结合人工智能开发DeepGlioma系统, 实现了IDH突变、 1p19q共缺失和ATRX 突变 的快速预测。 余新光等[11]利用便携式拉曼光谱仪结合主成分分析-支持向量机(PCA-SVM)进行了胶质瘤分级研究, 展示了较好的边界识别能力。 尽管这些研究验证了拉曼光谱在胶质瘤诊断中的潜力, 但其主要依赖于传统机器学习方法, 仍面临一定局限。 由于拉曼光谱较高的特征维度和非线性分布, 这可能使得传统方法很难获得令人满意的结果。 而深度学习算法作为机器学习算法的先进迭代, 拥有强大的非线性建模能力, 通过多层神经网络组合的非线性模式, 能够学习到更复杂的规则和关系。 因此, 本研究基于CNN进行端到端学习, 能够自动提取光谱特征并建立更稳定的分类边界, 从而在胶质瘤分级任务中取得更优的分类效果。
实验结果表明, 在高级别胶质瘤中, 大部分蛋白质相关峰(758、 1 309、 1 556和1 606 cm-1)的强度更高, 而仅有少部分蛋白质相关峰(1 002、 1 659 cm-1)在低级别胶质瘤中强度更高。 这些特征峰的变化主要反映了胶质瘤组织在不同分级状态下的生化成分差异。 这与组织病理学结果一致, 显示随着胶质瘤的进展, 源自蛋白质的峰值在拉曼光谱中变得更加明显。 这是因为蛋白质在细胞增殖和侵袭迁移过程中发挥着重要作用[12, 13]。 此外, 在高级别胶质瘤中, 核酸相关峰和脂质相关峰(828、 1 265和1 172 cm-1)的强度也更高, 这是由于脂质和核酸是维持肿瘤细胞快速增殖所必需的重要物质[14, 15]。 这些生化特征的变化为基于拉曼光谱的分类模型提供了重要信息, 也进一步支持了本研究的实验结果。
CNN模型在本研究中的分类准确率达到98.15%, 显著高于 SVM(90.34%)、 RF(88.64%)和 DT(80.83%)。 相比传统方法, CNN具备强大的自动特征学习能力, 能够直接从原始光谱数据中提取关键模式, 而无需依赖人工特征选择。 SVM依赖于超平面进行分类, 适用于低维、 线性可分的数据, 面对复杂光谱特征时表现不稳定; RF和DT通过特征分裂进行决策, 但容易受到数据噪声影响, 泛化能力相对较弱。 相比之下CNN通过卷积运算逐步提取局部和全局特征, 并结合池化层减少数据冗余, 使得模型能够在高噪声数据中保持较好的分类稳定性。 这一特性使得CNN在拉曼光谱分类任务中展现出更强的适应性, 能够更精准地识别光谱模式, 提高分类精度。
利用拉曼光谱结合CNN的方法不仅无需进行光谱预处理, 还能更充分地挖掘光谱特征, 缩短计算时间, 并在分类准确率上优于传统算法。 因此, 将拉曼光谱与深度学习相结合可以作为胶质瘤分级诊断的有效手段。 拉曼光谱分子成像技术在活体中的应用前景广阔, 有望在不久的将来成为活体分子影像工具的潜力。 在临床应用场景中, 拉曼光谱技术尤其适合用于术中实时检测, 帮助外科医生进行更精准的肿瘤切除并制定个性化的手术方案。
本研究的局限性在于, 首先, 目前的样本量较少, 今后将进一步收集更多的胶质瘤组织样本, 为CNN模型提供更丰富的训练数据, 以提高其泛化能力。 其次, 研究构建的诊断模型数据格式仅对inViaTM拉曼光谱仪有效, 其功能扩展性有待讨论; 最后, 本研究中拉曼光谱是基于病理组织切片进行采集的, 术中实时检测仍受检测速度、 信号稳定性和抗干扰能力的限制。 便携式拉曼设备虽有所发展, 但仍需优化积分时间、 便携性和操作简便性。 未来研究将改进实时光谱分析算法, 开发高灵敏度手持式设备, 结合人工智能提升检测准确性和稳定性, 为临床提供更高效的诊断工具。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|