作者简介: 赵晶蕊,女, 1995年生,石河子大学食品学院葡萄与葡萄酒工程系硕士研究生 e-mail: zjr95516@126.com
氨基甲酸乙酯是一种广泛存在于葡萄酒、 酱油、 泡菜等发酵食品中的发酵产物, 由于其具有毒性和致癌性, 可在生物体内积累产生多种病变, 已成为现代食品加工行业的潜在威胁。 氨基甲酸乙酯传统检测方法存在样品前处理过程繁琐、 分析时间长、 仪器设备昂贵、 对测试人员的要求较高等缺点, 不能对大批样本量进行快速检测。 亟需研究一种快速、 准确、 高效的氨基甲酸乙酯检测方法。 表面增强拉曼光谱(SERS)技术具有灵敏度高、 高选择性、 抗光漂白、 响应时间短和非破坏性等特点, SERS克服了拉曼光谱的散射信号微弱、 背景干扰大等问题, 可实现快速对痕量物质的定性、 定量检测分析, 在食品安全检测领域展现出了较好的应用前景。 采用表面增强拉曼光谱技术对葡萄蒸馏酒中氨基甲酸乙酯含量进行了快速检测研究, 以银纳米球硅锥阵列和金银合金纳米球硅锥阵列为SERS基底, 探究了SERS基底结构、 混合时间、 基底保存时间和激发波长对拉曼散射信号的影响, 并确定最佳SERS基底。 结果表明, 以Ag-Au/SiNCA为SERS增强基底, 当激发波长为785 nm, 混合时间为60 min, 银纳米颗粒厚度为10 nm时可以获得较好的拉曼信号。 利用密度泛函理论对氨基甲酸乙酯分子基团进行谱峰归属分析, 确定了葡萄蒸馏酒中氨基甲酸乙酯定量分析的特征峰位1 442 cm-1, 以1 442 cm-1处特征峰的峰强与EC浓度建立了线性方程, 该方程在1×10-3~1×10-8 mol·L-1浓度范围内线性关系良好, 决定系数 R2=0.821 3, 该方法回收率在83.06%~110.00%之间, 最低检出限可达到3.28×10-8 mol·L-1, 每个样本检测约在6 min内完成。 该方法的建立为酒精饮料中EC的快速检测提供了思路和参考。
Ethyl carbamate,A group 2A carcinogen, is commonly found in fermented foods such as grape, soy sauce, and pickles. Due to its toxicity and carcinogenicity, it can accumulate in organisms and produce a variety of lesions and has become a potential threat to the modern food processing industry. The traditional detection method of ethyl carbamate has the disadvantages of a complicated sample pretreatment process, long analysis time, expensive equipment, high requirements for testers, and the inability to detect large samples quickly. Therefore, there is an urgent need to develop a rapid, accurate, and efficient method for urethane detection. Surface-enhanced Raman spectroscopy (SERS) technology has the characteristics of high sensitivity, high selectivity, resistant photo bleaching, short response time, and non-destructive. SERS overcomes the problems of Raman spectroscopy, such as weak scattering signals and large background interference, and can realize the rapid qualitative and quantitative detection and analysis of trace substances, showing good application prospects in the territory of food safety detection. In this study, surface-enhanced Raman spectroscopy was used to detect the content of ethyl carbamate in grape spirit rapidly. Silver nanosphere silicon cone array and gold-silver alloy nanosphere silicon cone array were used as SERS substrates. The effects of SERS substrate structure, mixing time, storage time, and excitation wavelength on Raman scattering signals were investigated, and the optimal SERS substrate was determined. The results show that good Raman signals can be obtained when the excitation wavelength is 785 nm, the mixing time is 60 min, and the thickness of silver nanoparticles is 10 nm using Ag-Au/SiNCA as the SERS-enhanced substrate. The characteristic peak position of 1 442 cm-1for quantitative analysis of ethyl carbamate in grape spirit was determined using density functional theory, and a linear equation was established between the peak intensity of the characteristic peak at 1 442 cm-1and the EC concentration. The equation has a good linear relationship in the concentration range of 1×10-3~1×10-8 mol·L-1, and the coefficient of determination R2=0.821 3. The recovery rate of the method is between 83.06% and 110.00%, and the minimum detection limit can reach 3.28×10-8 mol·L-1. This detection method is very simple and quick to operate, and analyze. If this method applies EC in grape spirit, an effective and rapid detection method can be provided with ideas and references.
氨基甲酸乙酯(ethyl carbamate, EC)广泛存在于发酵食品(如酱油、 腐乳等)、 酿造酒(如黄酒、 葡萄酒等)和蒸馏酒(如白兰地等)中[1]。 在科技迅猛发展的今天, 人们的健康意识不断增强, 对食品安全也有了更高的要求[2]。 研究表明, EC具有毒性、 致癌性以及诱导生物体细胞发生变异等作用, 危害人们的身体健康, 2007年EC被国际癌症研究机构(IARC)列为2A级致癌物[3]。 欧盟对发酵食品中的EC(尤其是酒精饮料)做出了严格的限量标准, 限定酒精饮料中EC含量不得超过20 μ g· L-1 [4]。 调查研究表明, 市售的一些酒精饮料中存在着不同浓度的EC, 其中葡萄酒所能检测到的平均值为18 μ g· L-1; 啤酒为2 μ g· L-1; 黄酒为100.63 μ g· L-1 [4]。 随着对EC研究不断深入, 各种检测方法也不尽相同, 传统的EC检测方法一般为气相色谱法、 高效液相色谱法、 气相色谱-质谱联用法、 薄层色谱法等[5]。 由于这些检测技术在检测前需要除去样品中的杂质, 对样品质量要求较高, 操作时需要较为专业的人员操作且耗时长, 不适用于大批量样品的快速检测, 需要一种技术用于大批量样品的快速检测。
表面增强拉曼光谱(surface enhanced Raman scattering, SERS)是一种能够检测痕量物质的技术, 通过增强基底放大拉曼信号达到检测微量有害物质的目的。 SERS克服了拉曼光谱的散射信号微弱、 背景干扰大等问题, 可快速实现对痕量物质的定性、 定量分析[6]。 SERS不仅灵敏度高、 检测快速, 同时还兼具操作简便、 无需复杂前处理的优势, 现已广泛应用于环境监测、 化学分析、 食品安全检测等领域[7]。 SERS可以使待测物质信号增强, 其信号增强的核心之一为增强基底的性能, 制备出灵敏度高、 稳定的增强基底是提高EC快速检测能力的有效途径之一[8]。 研究表明, 当贵金属银和金作为样品检测基底时, 样品的拉曼信号可以得到明显放大, 近年来, 有研究采用这两种金属制备了拉曼增强基底, 期望小分子物质的拉曼信号可以得到有效增强。 Du[9]等采用从头计算法和离散偶极分子分配法研究了氨基甲酸乙酯吸附在Ag20团簇上的SERS增强机制, 其拉曼增强因子为104倍, 总的拉曼增强因子可达3.6× 1010, 采用Ag20团簇的拉曼增强效应可应用于EC的定性或定量检测。 Li[10]等采用表面增强拉曼光谱检测白酒中的EC, 并利用银纳米星基底作为信号放大工具, 使其拉曼信号增强了105倍, 检出限可达1.37× 10-9 mol· L-1。 Qi[11]等采用花形银纳米粒子作为SERS基底, 检测了白酒中的EC含量, 其有效线性范围为10-5~10-9 mol· L-1, 可用于定量评价酒精饮料中的EC。 SERS基底的研发不仅有利于光谱技术的发展, 还可为食品工业检测方法的应用提供技术支持, 尽管目前所研制出的基底都具有较强的增强能力, 对于一些染料大分子的检测也表现出了更低的检测限, 而对于一些其他小分子物质如EC的实际检测还是存在信号强度弱、 杂峰多、 目标分子与基底结合力弱等问题, 限制了基底的实际应用范围。 开发稳定且具有普适性的SERS基底或构建强有效的SERS检测方法是实现快速检测技术应用的重点。
本工作以银纳米球硅锥阵列和金银合金纳米球硅锥阵列为SERS基底, 优化了基底结构、 混合时间、 基底保存时间等实验条件, 讨论分析了不同结构基底对结晶紫分子拉曼散射信号的影响, 并确定最佳SERS基底。 结合线性回归模型分析葡萄蒸馏酒中EC的含量, 建立葡萄蒸馏酒中EC的快速定量分析方法。
氨基甲酸乙酯(EC)(纯度≥ 99%)购于上海百灵威公司; 聚苯乙烯球(PS, 直径300 nm)悬浮液(5% wt)购自上海辉质生物科技有限公司; (001)面抛光硅面购自于浙江立晶硅材料有限公司; 分析纯标准的乙醇、 丙酮、 结晶紫(CV)均购自于上海麦克林生化科技有限公司; 六氟化硫(SF6)刻蚀气体购自于南京特种气体厂有限公司; 葡萄蒸馏酒: 购于新疆当地超市。 实验用水为Millipore Milli-Q系统生产的18.3 MΩ · cm的去离子水。
Shimadzu UV-2600光谱仪: 日本岛津; NDK200-1氮吹仪: 杭州米欧仪器有限公司; KQ-100DE型 数控超声波清洗机: 昆山市超声仪器有限公司; SOP电子天平(精确到0.000 1 g): 赛多利斯科学仪器(北京)有限公司; UMV-2小型漩涡振荡器: 北京优晟联合科技; 配备有能谱仪的(Oxford IE250X-Max50)场发射扫描电子显微镜: 日本日立集团; 傅里叶变换拉曼光谱仪: 布鲁克公司; EMITECH K550X 磁控溅射仪: 北京泰科诺有限公司。
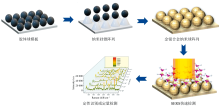
通过气液界面自组装和整体转移, 在经过清洗的Si晶片(尺寸为3 cm× 3 cm)上制备了直径约为320 nm的均匀紧密堆积的聚苯乙烯球单分子层胶体球模板。 将购买的PS悬浮液稀释到乙醇中形成体积比为1∶ 1的混合物, 将配置好的聚苯乙烯球混合液逐滴从边缘缓慢滴到覆盖去离子水膜的亲水性处理的硅片上, 由于能量最小化, 聚苯乙烯球在空气-水界面上自组装, 形成密排单层薄膜; 用滤纸从硅片的边缘吸去自组装薄膜底部的水并自然干燥后, 在硅片上形成单层有序的聚苯乙烯胶体球模板[12]。
将硅衬底上的聚苯乙烯球胶体模板在120 ℃的烘箱中保持1 min, 以使PS球体与底部的硅衬底紧密结合, SF6等离子体进入传统的反应离子刻蚀(RIE)机上进行刻蚀, 功率为205 W, SF6流速为36 mL· min-1, 压力为2.3 Pa, 使用聚苯乙烯球胶体单分子层作为掩膜, 刻蚀30 s后, 在硅片上形成了排列良好的硅纳米球阵列和其顶部残余的聚苯乙烯胶体球; 将刻蚀完成后的硅板用乙醇冲洗15 s并在500 ℃下焙烧180 min去除硅纳米锥顶部残留的聚苯乙烯球; 在带有厚度监测器的磁控溅射仪中以每分钟20 nm的沉积速率在硅纳米球阵列上覆盖一层薄薄的金膜, 沉积时间为2 min, 获得镀银硅锥阵列(Ag/SiNCA)表面增强拉曼散射衬底[12]。 以每分钟5、 10、 15、 20 nm的沉积速度分别在金纳米层上面沉积一层不同厚度的银纳米颗粒, 沉积时间为1 min, 得到不同厚度的金银合金SERS基底。 金银合金硅锥阵列(Au-Ag/SiNCA)基底制备流程示意图如图1所示。
1.4.1 探针分子溶液制备
以超纯水为溶剂, 将CV配制成1× 10-2 mol· L-1的母液, 再将其稀释为1× 10-3、 1× 10-4、 1× 10-5、 1× 10-6、 1× 10-7和1× 10-8 mol· L-1的CV溶液, 以此来比较不同基底的增强效果, 将Ag/SiNCA浸泡在不同浓度的CV溶液中, 60 min后取出芯片进行拉曼光谱采集[13]。 用待测分子EC来验证CV的结果, 即将5 μ L待测溶液滴在已经处理过的SERS硅片中, 待测液自然晾干后采集其拉曼信号。 考察基底的稳定性和表面增强效应, 金银合金纳米基底操作步骤同上。
将不同沉积程度的金银合金SERS基底分别浸泡在上述CV溶液中60 min, 待干燥后进行拉曼光谱采集, 每个样品重复三次, 保证样品未被激光烧毁。 通过对不同浓度结晶紫溶液进行检测, 并确定不同厚度的金银合金基底的CV检测线性范围与最低检出限, 筛选出SERS性能最优的基底。
1.4.2 EC标准溶液制备
取EC白色晶体溶于超纯水中, 获得浓度分别为10-3、 10-4、 10-5、 10-6、 10-7和10-8mol· L-1的EC水溶液, 为保证实验准确度, 每个样品重复采集3次, 在测试时要防止样品被激光烧毁[13]。 将金银合金纳米球衬底芯片浸泡在不同浓度的EC水溶液中, 1 h后取出进行拉曼检测, 在检测过程中, 每个样品重复检测3次。
1.4.3 EC酒样溶液制备
取EC固体晶体粉末溶解于葡萄蒸馏酒中, 分别配置成10-3、 10-4、 10-5、 10-6、 10-7、 10-8 mol· L-1的溶液, 最后将Au-Ag/SiNCA基底浸泡在配置好的酒样溶液中12 h, 晾干后进行SERS检测。
本数据采用Origin 2018对所采集的拉曼光谱数据进行处理。 实验均使用785 nm的激光作为激发光源, 激光强度25 mW, 本实验还使用了532 nm的激光光源, 激光强度32 mW; 633 nm激光光源, 激光强度为14 mW, 其他设置均与785 nm一致, 光谱的检测范围均为200~2 000 cm-1, 分辨率为1 cm-1, 样品检测过程中参数设置保持一致, 每个样品至少重复检测3次[13]。
为了分析基底的表面结构及各元素分布, 采用FESEM对纳米增强基底的结构进行表征。 由图2(a)可以看出, Ag/SiNCAs的硅片上面铺着一层有序排列的银纳米球阵列, FESEM图像显示平均直径大小约为(150± 10) nm。 其在相应的能量色散光谱(EDS)中如图2(b)所示, 阵列中仅包含了Ag、 Si、 O三种元素, Ag则是较为均匀地覆盖在Si表面。 而Ag-Au/SiNCAs基底从图2(c)中可以看出其FESEM图像与Ag/SiNCAs很相似, 球平均直径约为(110± 5) nm, Ag-Au/SiNCAs基底以六边形图案均匀的排列在硅片基板上, 其形貌较为均一。 而在PS胶体球表面沉积的金膜层和银膜层如图2(d)所示, 银纳米粒子基本都较为均匀的覆盖在金膜层外部, 而金膜层则紧密的覆盖在PS胶体球的外部。 与之相应的能量色散光谱(EDS)如图2(e)所示, 阵列中包含了Au、 Ag、 Si、 O四种元素, Au和Ag两种元素都较为均匀地分布在带有PS胶体球的硅片基板上, 形成了本研究所需要的Ag/SiNCAs和Ag-Au/SiNCAs基底。
如图3(a)所示, 固态EC的拉曼图谱中显示出几个主要的特征峰, 在500~1 800 cm-1的范围内EC标品的主要特征峰分别是512, 672, 857, 996, 1 127, 1 274, 1 387, 1 440, 1 459和1 624 cm-1, 以上特征峰主要归属于羰基、 C— C键、 C— H键和N— H键的振动模式, 其中996和1 440 cm-1分别归属于C— C键的对称伸缩振动、 C— H键的面外摇摆振动, C— C键的对称伸缩振动, — CH3的伸缩振动[14]。 将1× 10-3 mol· L-1 EC的SERS光谱和EC固体拉曼图进行对比, EC在金银合金纳米球阵列基底中被明显增强的特征峰为685、 830、 1 001、 1 128和1 442 cm-1。 发现相对于EC固体峰, EC的SERS峰均发生了不同程度的偏移, 其中996 cm-1处的特征峰在SERS光谱中的位置偏移到1 001 cm-1处, 而1 440 cm-1处的特征峰偏移到了1 442 cm-1处, 分析认为EC分子吸附到SERS基质的表面, 导致分子基团化学键的振动发生变化[15]。 实验中还发现随着EC浓度逐渐降低, 有些特征峰逐渐消失, 而1 001和1 442 cm-1处的特征峰较为稳定, 因此选用这两个特征峰作为SERS中的定量分析峰。
根据密度泛函理论(DFT), 基于SERS的表面选择原则, ν s(CC)+ν (CH3)和δ (NH)+ν s(OC)+δ (CH2)基团的振动使得1 442 cm-1处的特征峰增强, 这是由于EC分子和金银合金纳米球阵列基底表面结合时, EC分子的化学键发生了构象变化, 使得EC分子的C— C键可垂直取向吸附在基底的表面[16]。 图3(a)是以Ag-Au/SiNCA为基底检测10-3的EC水溶液, 其SERS谱图与EC的RS谱图并不一一对应, 分析认为由于基底或溶液中其他物质的影响。 对应EC的RS谱图的特征峰位, 尽管试验特征峰的位置发生了略微偏移, 但都在可控偏差范围之内, 可用作EC的定量分析峰[17]。 图3(b)则是分别对比分析了以银纳米球阵列(Ag/SiNCA)和金银合金纳米球阵列(Ag-Au/SiNCA)为基底时EC水溶液的拉曼增强信号, 图中Ag-Au/SiNCA的峰强高于Ag/SiNCA, 且特征峰位置明显, 说明Ag-Au/SiNCA基底比Ag/SiNCA基底表现出了更好的增强效果, 可能是由于Ag-Au/SiNCA表面覆盖银层厚度的不同导致了纳米球表面粗糙度的改变, 使得银纳米粒子与金纳米粒子之间的LSPR效应得到进一步增强, 放大了EC分子的拉曼散射信号, 因此选用Ag-Au/SiNCA基底用作后续检测试验。
2.3.1 基底制备条件优化
采用FESEM观察金银合金纳米球阵列基底的结构, 结果显示, 不同厚度的Au-Ag/SiNCA均具有均一的形貌, 如图4所示。 由图可以得出金银合金纳米球均匀的排列在芯片的表面, 由于基底是基于表面粗糙的纳米硅锥阵列沉积金银纳米颗粒得到的Ag/SiNCA, 因此当改变沉积速率时就会使得基底表面的纳米颗粒厚度改变, 沉积时间不变, 随着沉积速率的增大基底纳米球表面的厚度逐渐增大, 从而导致基底表面粗糙度逐渐增大。 有研究表明, 在可见光激发条件下, 自由电子金属金、 银产生的LSPR现象较为突出, 增强因子与自身金属性质和金属表面粗糙度等因素密切相关, 较粗糙的金属表面会产生更多的“ 热点” [18]。 因此研究并对比分析了不同厚度的金银合金纳米基底的SERS效应。 实验结果表明, 图4(a— d)中可以得出A、 B、 C、 D四种基底的表面沉积厚度分别约为120、 115、 110和105 nm, 其厚度逐渐增加, 选取FESEM 10个的纳米银球进行计算, 算得其平均直径为(100± 5) nm, 说明本研究成功合成了不同厚度的金银合金纳米衬底。
由图4可以得出吸附在Au-Ag/SiNCA-3基底上不同浓度结晶紫的SERS光谱, 拉曼特征峰清晰明显。 分析图4可知, 随着CV浓度的降低, 基底的拉曼特征峰强度也在逐渐降低, 但不同厚度的金银合金纳米基底可检测到的结晶紫溶液的浓度不同, 证明了这四种基底的增强性能差异较大, 图4(e)为Au-Ag/SiNCA-1基底, 其在结晶紫溶液中的检出限为10-6 mol· L-1, 图4(f)为Au-Ag/SiNCA-2基底, 其检出限为10-6 mol· L-1, 图4(g)为Au-Ag/SiNCA-3基底, 其检出限为10-10 mol· L-1, 图4(h)为Au-Ag/SiNCA-4基底, 其检出限为10-7 mol· L-1。 说明只有沉积适宜厚度的纳米粒子所形成的粗糙度才会有更强的SERS活性。 对比四种金银合金纳米基底, Au-Ag/SiNCA-3基底表现出了较好的增强性能, 可用作EC的定量分析研究。
2.3.2 激发波长的选择和基底稳定性研究
当特定频率的激发光与金属纳米粒子结合时, 两者会发生相互作用, 在交变电磁场的激励下, 纳米粒子内部的导电电子会发生集体震荡。 若激发光的频率和金属纳米粒子表面电子振荡的固有频率相同, 产生LSPR导致纳米粒子周围产生增强的局域电场, 其表面局域电场强度大幅度增加, 从而表面吸附的待测分子信号就会得到极大的提高[19]。 图5(a)为不同激发波长下的10-4 mol· L-1 CV表面增强拉曼光谱, 图中体现出当激发光的波长为532和785 nm时, 基底产生的LSPR效应最强, 但较大波长的激发光极易使待测分子产生热效应和荧光效应, 会覆盖待测分子较多特征峰, 影响其定量分析的准确度, 因此本试验选用785 nm波长下的激发光为最佳试验条件。
为检验Au-Ag/SiNCA衬底的稳定性, 随机取3条探针分子光谱进行对比分析[20]。 由图5(b)得出, 本实验采集的拉曼信号峰具有较好重复性, 且结晶紫特征峰的拉曼强度较高。 合成的Au-Ag/SiNCA基底可作为可靠的增强基底应用于SERS实验中。
2.3.3 基底与待测分子混合时间优化
根据现有的SERS理论研究, SERS增强机理主要包括两种方式: 其一是电磁增强, 金属所产生的LSPR, 该效应被激发光激发进而感应电场, 此时金属就会与被结合的目标分子作用; 其二为化学增强, 当金属和被结合的分子的化学键产生相互作用时, 会发生电荷转移进而使得分子信号增强[21]。 因此, 目标分子与基底表面金属纳米粒子的结合也是影响其SERS性能的重要因素。
实验以10-5 mol· L-1 CV溶液确定基底和待测分子最佳吸附时间。 由图6可以看出, 随着基底浸泡在CV溶液中的时间不断延长, 在1~60 min内, 随着目标分子与基底的结合越来越多, CV分子的拉曼吸收峰越来越强, 直到60 min以后, 目标分子与基底的结合达到饱和, 随着时间的增长, 其拉曼峰慢慢减弱, 分析认为由于更多的分子被结合在基底表面的金属纳米粒子上而发生团聚, 导致了“ 热点” 减少, 从而影响最终的增强效果[22]。 当待测分子与基底的混合时长为60 min时, EC分子的拉曼峰强度达到最大, 因此本试验选用混合时长60 min用作后续试验。
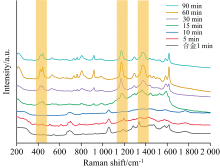 | 图6 不同混合时间下的10-4 mol· L-1 EC分子的表面增强拉曼光谱2.4 基底增强效应和保存时间Fig.6 Surface enhanced Raman spectra of 10-4 mol· L-1 EC molecules at different adsorption times |
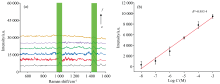
较好的稳定性和SERS性能是优良基底的共性, 如较高的灵敏度就能够较好地放大待测分子的信号; 较好的SERS性能可以提高低浓度待测分子的灵敏度; 较高的稳定性则可以使基底更好地捕捉信号分子[23]。 由图7(a)可以看出, 在1× 10-3~1× 10-10 mol· L-1浓度范围内, CV分子的SERS强度都随着浓度的降低而减小。 当CV浓度为10-10 mol· L-1时, CV分子的特征峰可见但强度很低, 因此该基底对CV分子的最低检测浓度为10-10 mol· L-1。
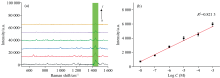
 | 图7 (a): 不同浓度结晶紫SERS光谱; (b): 基底保存时间对I1442的影响Fig.7 (a): SERS spectra of crystal violet with different concentrations; (b): The influence of substrate preservation time on I1 442 |
由于Ag-Au/SiNCAs基底最外面覆盖了一层银膜, 其表面容易被氧化, 需要氮气密封保存, 每次使用前需要用无水乙醇冲洗基底2~3次, 自然风干后使用[24]。 为考察基底存放时间稳定性, 在第0、 1、 3、 5、 10、 15和30 d进行基底活性测试。 由图7(b)中可以得出基底在0~30 d内, I1 442基本趋于稳定, RSD=8.12%, 基底从第0 d~第15 d时, 基底性能基本保持良好, 从第15 d开始基底的增强性能开始下降, 因此该基底最佳使用期限为15 d。
图8(a)为不同浓度EC标准溶液的表面增强拉曼光谱, 当浓度为10-3 mol· L-1时, EC的拉曼谱峰有1 002和1 442 cm-1。 根据密度泛函理论分析, 这两个拉曼峰是EC分子的特征峰。 随着EC分子的浓度降低, 其特征峰的强度逐渐减弱; 当EC分子浓度为10-6 mol· L-1时, 1 002和1 442 cm-1特征峰仍清晰可见; 当EC分子浓度继续降至10-8 mol· L-1时, 大部分特征峰已无法识别, 但1 442 cm-1处的特征峰依旧可见, 因此选择1 442 cm-1处的特征峰峰强作为葡萄蒸馏酒样品的EC定量分析峰, 通过1 442 cm-1处的峰强建立了EC分子1× 10-3~1× 10-8 mol· L-1浓度范围内的线性关系, 如图8(b)所示, 其线性关系良好, 决定系数R2=0.953 4。 说明本方法检测EC水溶液的最低检出浓度可达到1× 10-8 mol· L-1。
本实验采用785 nm激发光, 将110 nm粒径的Ag-Au/SiNCAs基底浸泡在不同EC浓度的葡萄蒸馏酒溶液中60 min, 随后采集拉曼光谱。 图9(a)是以葡萄蒸馏酒为基质的不同浓度氨基甲酸乙酯溶液的SERS谱图, 以1 442 cm-1处的峰作为葡萄蒸馏酒中EC分子的定量分析峰。 分析图9(a)可知, 随着EC浓度逐渐降低, EC特征峰强度也逐渐减弱, 当酒样浓度为10-5 mol· L-1时, 1 442 cm-1处的EC分子特征峰尽管强度略有降低, 但其谱峰依旧清晰可见, 当EC浓度继续降至10-8 mol· L-1时, 1 442 cm-1处EC分子特征峰强度几乎消失, 但未完全消失, 而其余各个特征峰均已无法识别。 故此方法对葡萄蒸馏酒中EC的最低检测限为3.28× 10-8 mol· L-1。
由图9(a)中可以看出1 442 cm-1处特征峰峰型好且稳定, 故选用1 442 cm-1的峰强度与葡萄蒸馏酒中EC浓度建立相关定量分析曲线, 在浓度1× 10-3~1× 10-8 mol· L-1范围内线性关系良好, R2=0.8213, 如图9(b)所示, 此为本研究所建立方法能达到的最佳效果。
向葡萄蒸馏酒中加入EC标准溶液, 配制0.1、 0.01和0.001 mol· L-1三个浓度的待测液, 每个浓度同时测定3个平行样本。 加标回收率实验结果见表1, 本方法加标回收率在83.06%~110.00%之间, 表明本实验建立的葡萄蒸馏酒中EC表面增强拉曼光谱快速检测方法的准确度良好。
| 表1 加标回收率(n=3) Table 1 Standard recovery (n=3) |
本研究建立了葡萄蒸馏酒中氨基甲酸乙酯的表面增强拉曼光谱快速检测方法。 采用金银合金纳米球阵列为增强基底, 优化并分析了基底结构、 激发波长、 混合时间、 保存时间等检测条件对EC拉曼信号强度的影响, 确定当激发波长为785 nm, 银纳米颗粒厚度为10 nm, 混合时间为60 min时, 基底的增强能力达到最大, 且该基底最长保存时间为30 d。 同时结合密度泛函理论, 确定了EC拉曼定量特征峰, 以1 442 cm-1处的拉曼峰强和EC浓度建立了葡萄蒸馏酒中EC的定量分析曲线。 在1× 10-3~1× 10-8 mol· L-1浓度范围内, 该方法对葡萄蒸馏酒中EC的最低检出限为3.28× 10-8mol· L-1。 加标回收率实验表明此方法的准确度良好。 本方法定量分析葡萄蒸馏酒中的EC时, 不需要进行前处理, 每个样本检测时间约在6 min中内完成, 可为葡萄蒸馏酒中有害物质实时快速检测技术的应用开发提供方法参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|