作者简介: 任林娇, 女, 1987年生, 郑州轻工业大学电气信息工程学院讲师 e-mail: renlinjiao@zzuli.edu.cn
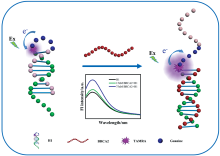
筛查乳腺癌易感基因2(BRCA2)基因突变对于乳腺癌患病风险评估、 发病检测、 早期诊断及基因治疗均具有重要临床意义。 现有乳腺癌基因传感检测方法大多需要复杂的处理过程, 成本较高且对单碱基突变识别能力较弱。 为简化基因传感器制备过程, 提高其应用可能性, 文章通过DNA分子发夹结构设计, 一步实现了BRCA2的检测。 其中分子发夹茎部含BRCA2互补序列, 茎与环连接处标记四甲基罗丹明荧光基团(TAMRA), 环部5个G碱基通过光诱导电子转移猝灭部分荧光信号, 降低背景荧光信号; 待测BRCA2序列与发夹茎部序列竞争结合, 发夹结构被打开, 荧光信号上升, 测量上升的荧光信号强度即可实现一步法定量检测靶基因。 优化实验结果表明, 分子发夹浓度不同时, 传感器检测范围不同。 当分子发夹浓度为150 nmol·L-1时, 对BRCA2的线性检测区间为1~50 nmol·L-1; 浓度为300和600 nmol·L-1时, 线性检测区间分别为1~100和1~200 nmol·L-1。 三种浓度传感器检出限分别为0.54、 0.72和1.81 nmol·L-1。 此外, 传感器对BRCA2的特异性检测较为突出, 尤其对单碱基突变的识别能力较强。 该方法制备与检测过程简单且特异性突出, 不仅可用于乳腺癌高危人群的早期筛查, 还可拓展应用于其他种类的基因检测, 为基因传感器的推广应用提供一种制备简单、 操作便捷的新方法。
Screening for BRCA2 gene mutations is clinically important for breast cancer risk assessment, morbidity detection, early diagnosis and gene therapy. Most existing breast cancer gene sensing assays require complex processing, high cost and weak recognition of single-base mutations. To simplify the process of gene-sensor preparation and improve its application possibility, the article realized the detection of BRCA2 in one step through the design of DNA molecular hairpin structure. The molecular hairpin stem contains BRCA2 complementary sequences, and the stem-loop junction is labeled with a tetramethylrhodamine fluorescent group. The target gene can be measured in one step. The optimized experimental results showed that the sensor's detection range was different when the concentration of molecular hairpin was different. The linear detection range of BRCA2 was 1~50 nmol·L-1 at 150 nmol·L-1, 1~100 and 1~200 nmol·L-1 at 300 and 600 nmol·L-1, respectively, and the detection limits for the three concentrations were 0.54, 0.72, and 1.81 nmol·L-1, respectively. In addition, the specificity of the sensor for detecting BRCA2 was outstanding, especially for identifying single-base mutations. The method is simple and specific and can be used not only for early screening of breast cancer in high-risk groups but also for other types of genetic tests, providing a new method with simple preparation and convenient operation for applying genetic sensors.
乳腺癌作为一种严重威胁女性生命健康的癌症, 在世界范围内的发病率与死亡率处于逐年上升的趋势[1, 2]。 乳腺癌易感基因2(breast cancer susceptibility gene 2, BRCA2)是在1995年发现的一个与遗传性乳腺-卵巢癌综合征相关的易感基因位点, 参与调控细胞周期、 修复DNA损伤、 基因转录与细胞凋亡等多种活动, 是维持基因组稳定性的重要部分[3, 4], 其突变可诱导女性患乳腺癌风险达69%[5, 6]。 因此, 筛查BRCA2基因突变对于乳腺癌患者患病风险评估、 发病检测、 早期诊断及基因治疗均具有重要的临床意义[7]。
国内外学者对乳腺癌基因及其突变的检测方法进行了长期研究。 电化学传感器分析方法由于其灵敏度高、 检测限低等优点近些年成为BRCA基因(breast cancer susceptibility gene, BRCA1/2)检测的普遍方法。 Ribovski[8]等以单链硫醇修饰DNA序列(HS-ssDNA)作为探针固定于金电极中, 以[Fe(CN)6]4-作为氧化还原探针进行杂交研究, 得到DNA 传感器的检测下限为0.15 nmol· L-1, 线性范围为1~200 nmol· L-1, 最高可区分双碱基突变。 Ehzari[9]等采用均匀聚醚静电纺丝法构建带纳米管的纳米纤维(RCNFs-MWCNTs), 将BRCA1基因的DNA探针很好地固定在NFs-MWCNTs上, 运用阻抗法测BRCA1序列, 检出限为2.4 pmol· L-1, 可特异性区分双碱基突变。 以上电化学法灵敏度较高, 但其设计方法复杂, 制备过程繁琐或需在电极表面上进行特殊材料修饰导致传感器制备成本较高, 且传感器对单碱基突变的识别能力较弱[8, 9, 10, 11, 12, 13]。 Liu[14]等建立了基于发夹DNA模板铜纳米团簇的无标记荧光法检测BRCA1基因, 降低了检测成本, 实现了2~600 nmol· L-1的宽范围检测, 检出限为2 nmol· L-1, 但其单碱基错配与靶基因的荧光强度几乎相同。 Zhong[15]等设计了一种新颖的以CDs和AuNPs为核心的双通道生物传感器供体-受体对, 同时在发夹结构5’ 端标记荧光基团cy3, 3’ 端标记荧光猝灭剂BHQ2, 辅助实现双基因的探测, BRCA1检出限为1.5 nmol· L-1。 Dong[16]等通过前期12 h的准备工作, 制备出一种手性miniPEG-γ PNA阵列, 实现对BRCA1基因相关寡核苷酸序列(3099delT)的大规模单碱基突变灵敏检测, 检出限5.97 nmol· L-1。 以上荧光传感器免去了电极修饰, 制备过程相对简单, 但对单碱基突变的特异性不明显[14, 15, 17]或前期准备时间较长[16], 不利于传感器的进一步推广应用。
文章通过特殊设计的分子发夹结构, 一步实现了对BRCA2的检测, 无需修饰猝灭基团及其他特殊材料, 为乳腺癌疾病的早期预测与评估提供一种制备简单、 操作便捷的新方法。
仪器: F-7000荧光分光光度计(HITACHI, 日本); pH计FE-20K (Mettler Toledo, 瑞士); HZQ-F200恒温振动筛(北京东联哈尔仪器有限公司, 中国); 离心机5418(Eppendorf, 德国); ME204称量天平(Mettler Toledo, 瑞士), PURELAB Option-R纯水机(ELGA, 英国)。
试剂: 寡核苷酸来自上海生工生物工程技术有限公司; 盐酸(HCl)、 氢氧化钠(NaOH)、 氯化钠(NaCl)购自郑州新迈捷; 磷酸二氢钠(NaH2PO4)购自上海泰坦科技股份有限公司; 以上试剂均为分析纯, 溶液由超纯水(18.2 MΩ · cm)配制。 BRCA2序列来自于(GenBank no.NM_000059)。 实验中用到的DNA序列如下。 H1: AATCAGAAGCCCTTT-TAMRA-GGGGGAAAGGGCTTC、 BRCA2: AAAGGGCTTCTGATT、 MT1: AAAGGGCTCCTGATT、 MT2: AAAGGTCTTTTGATT、 MT3: AAAGTGCCTCCGATT、 NCT: GGGTTTTCCTCTGGG。
首先将H1放在离心机中7 000 r· min-1离心1 min, 拿出后加入SPSC缓冲液(50 mmol· L-1 NaH2PO4; 1 mol· L-1 NaCl; pH 8.0), 避光静置2 h, 4 ℃放置冰箱避光保存。 分别将10、 20、 40 μ L的H1(9.0 μ mol· L-1)以及20 μ L不同浓度的BRCA2混合, 加SPSC缓冲液(pH 8.0)至总体积为600 μ L, 在25 ℃的培养箱中反应3.5 h。 将600 μ L的样品置于石英比色皿中, 设置荧光分光光度计的激发波长为561 nm, 发射波长的检测范围为565~650 nm, 激发狭缝5 nm, 发射狭缝5 nm, 测定荧光光谱。
如图1所示, 发夹H1由环、 茎和粘性末端三部分组成, 环部由5个鸟嘌呤碱基构成, 茎部由10个互补碱基对构成, 环与茎连接处标记荧光基团四甲基罗丹明。 受激发后荧光基团的电子由基态跃迁到激发态, 当电子恢复到基态时, 能量将以光的形式释放, 产生荧光。 然而在环部5个G碱基构成的单链DNA中, 来自鸟嘌呤碱基的电子占据荧光基团的激发态最高占有轨道[18], 导致荧光基团的电子不能恢复到基态, 产生荧光猝灭现象。 未引入靶基因时, 溶液中H1以发夹结构稳定存在, TAMRA荧光处于猝灭状态; 加入靶基因后, BRCA2与H1的茎及其粘性末端完全互补结合, 发夹茎部解螺旋, 环部G碱基构象变化, 导致TAMRA荧光上升。
为优化传感器检测性能, 实验固定传感器制备条件, 仅改变反应时间、 pH、 温度等参数, 分析其对检测结果的影响, 具体结果如下:
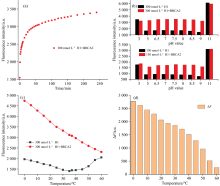
反应时间优化: 加入待测靶基因后溶液荧光值会随时间逐渐变化, 加入靶基因后立即测定荧光强度, 探究其稳定时间。 由图2(a)可知, 反应时间在0~50 min, 溶液荧光强度显著上升; 在50~200 min范围内, 荧光强度值微弱上升; 200 min后, 荧光值趋于平稳。 综合考虑实验效果, 选择该反应的最佳时间为50 min。
pH优化: 强酸或强碱环境易造成发夹茎部氢键的断裂[19], 因此选取H1分别为150和300 nmol· L-1两种浓度对溶液反应环境的pH进行了优化。 两种浓度下H1均准备有靶与无靶DNA两组样本, 每组样本分别滴定至3、 5、 6.5、 7、 7.5、 8、 8.5、 9、 11九个pH值。 由图2(b)可知, pH值为3和11时, 发夹结构可能已遭到破坏, 因此G碱基对TAMRA的猝灭作用被抑制, 溶液的荧光值显著上升。 对于加入靶基因前后的荧光差值, 两种浓度下H1均呈现微弱的先升后降的趋势, 由图2(b)可以看到, 当pH值在7~8范围内, 荧光差值达到了最强, 实验选择pH 8作为反应条件。
反应温度优化: 选取0~60 ℃检测区间, 每间隔5 ℃测量加靶前后的荧光强度。 由图2(C)可知, 加入靶基因前, 在0~35 ℃范围内, 荧光强度逐渐下降, 35~60 ℃时, 荧光强度随温度增加而逐渐上升。 加靶后, 荧光强度在0~60 ℃范围内明显逐渐下降。 定义Δ F=F-F0(F0与F分别为加待测物前后的荧光强度), 由图2(d)可知, 加靶前后差值也随温度增加呈下降趋势。 为简化实验条件, 选择25 ℃室温作为反应温度。
利用优化实验条件, 分析不同浓度传感器对不同浓度BRCA2的检测效果, 结果如图3。 利用SPSC缓冲液(pH 8), 分别配制150、 300和600 nmol· L-1三个浓度的H1作为传感器工作溶液。 取不同浓度样品分别与150 nmol· L-1的H1混合后测荧光, 结果见图3(a, b), 随着BRCA2浓度的增加, 传感器荧光强度逐渐增强, BRCA2的检测范围为1~100 nmol· L-1, 在1~50 nmol· L-1区间输入与输出有良好的线性关系, 线性回归方程为Δ F=10.362c+83.629。 同理, 将H1的浓度调节为300和600 nmol· L-1, 检测结果如图3(c— f), 线性检测区间分别为1~100和1~200 nmol· L-1, 回归方程为Δ F=10.511c+104.194, Δ F=12.408c+162.828。 采用检测限的计算公式: cL=3Sb/k(Sb为空白溶液平行多次检测的标准差, k为拟合曲线的斜率), 计算得到三种浓度下传感器检测限分别为0.54、 0.72和1.81 nmol· L-1, 相关系数均大于0.99, 调节传感器中H1发夹的浓度, 即可实现BRCA2检测范围的调节, 且检测范围越小传感器信噪比越高, 该方法也可拓展应用于其他基因检测。
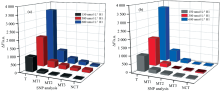
为验证传感器的特异性, 取相同体积与浓度的靶基因BRCA2(T)、 与靶基因单碱基(MT1)、 双碱基(MT2)、 三碱基(MT3)错配的DNA和完全不互补的DNA(NCT)分别加入相同体积和浓度的H1, 定容至600 μ L测荧光。 结果如图4(a)所示, 以η =Δ FM/Δ FT量化特异性结果, (其中Δ FM表示靶基因错配时传感器的输出信号强度与背景荧光信号强度的差值, Δ FT表示加入同样浓度靶基因时传感器的输出信号强度与背景荧光信号强度的差值, 下同), H1=150 nmol· L-1时, MT1、 MT2、 MT3、 NCT错配碱基序列的η 分别为13.9%、 4.6%、 6.2%、 1.5%, H1为300 nmol· L-1时为21.7%、 13.0%、 9.2%、 8.8%; H1=600 nmol· L-1时为23.1%、 10.4%、 6.2%、 2.2%。
采用该传感器对人血清样品中的靶DNA进行特异性检测, 以验证方法的实用性。 其中人血清样品购自北京索莱宝科技有限公司, 用超纯水稀释10倍。 结果见图4(b), H1=150 nmol· L-1时, 错配碱基序列的η 分别为21.6%、 9.3%、 5.7%、 4.3%, H1为300 nmol· L-1时为13.2%、 -0.4%、 -2.4%、 -3.6%; H1=600 nmol· L-1时为20.8%、 5.0%、 0.4%、 0.9%。 对比表1可知, 本方法制备的传感器对单碱基错配序列的区分能力较强, 可较早地实现疾病预测与评估。
| 表1 对比不同方法对BRCA基因的检测 Table 1 Detection of BRCA gene by different methods |
通过设计一种特殊的DNA发夹, 一步实现了对BRCA2的准确检测。 在温度为25 ℃, pH为8时, 改变H1浓度, 传感器对BRCA2的线性检测范围可在1~200 nmol· L-1之间调节, 检测限为0.54 nmol· L-1且特异性突出, 尤其对单碱基突变的识别能力较强。 该传感器的构建为DNA的快速检测提供了新方法, 且该方法特异性突出、 操作简单, 有望拓展到其他癌基因的检测领域。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|