作者简介: 张金伟, 1989年生, 四川大学博士研究生 e-mail: scutanner@163.com
胶原蛋白的三股螺旋结构是其不同于其他蛋白质的特殊结构, 也是其具有特殊功能的基础, 然而, 胶原的三股螺旋结构易在外界条件的影响下被破坏。 目前微波已被越来越多的应用于胶原蛋白的提取和改性过程, 但是关于微波辐照对胶原蛋白结构影响的研究还相对较少。 首先从牛跟腱中提取胶原蛋白, 然后采用0.5 mg·mL-1的胶原蛋白溶液在30 ℃下以微波辐照保温为实验样, 水浴加热和未经加热处理为对比样, 最后采用紫外-可见光谱、 傅里叶变换红外光谱、 圆二色谱以及荧光发射光谱等方法, 对不同加热方法中胶原蛋白的三股螺旋结构和超分子结构进行表征, 研究了微波辐照对胶原蛋白结构的影响。 实验结果表明, 在低于胶原变性温度的条件下, 无论是微波辐照还是水浴加热都不会破坏胶原蛋白的三股螺旋结构, 也不会使胶原蛋白变性。 但是, 与水浴加热相比, 微波辐照会对胶原蛋白的聚集行为产生抑制作用。 微波辐照对胶原蛋白的作用既有与常规加热相同的热效应, 又有常规加热过程中不存在的非热效应, 非热效应表现为抑制胶原蛋白的聚集行为。 研究结果可为微波场中胶原蛋白结构和性质的变化提供科学依据。
Collagen has a unique triple helix structure, which is quite different from that of other proteins and a basis of its special effects. However, collagen triple helix structure is sensitive to environment and easy to be damaged. Recently, microwave has been used more frequently in collagen extraction and modification processes, however, there is few research of microwave irradiation on collagen structure. In this study, collagen was extracted from cattle tendon at first; then 0.5 mg·mL-1 collagen solution was irradiated with microwave at 30 ℃ as an experiment sample, at the same time, collagen with water bath heating and without heating as controls; finally, the Ultraviolet-Visible Spectroscopy, and Flourier Transformation Infrared Spectroscopy, Circular Dichroism and Fluorescent Spectroscopy were used to characterize the changes of collagen triple helix and supermolecular structure under microwave. It was an innovative study of the influence of microwave irradiation on collagen structure. The result showed that water bath heating and microwave could neither destroy the triple helix structure nor make collagen denaturing below the denaturizing temperature. However, microwave had a negative effect on collagen aggregation compared with water heating. In the interaction between microwave irradiation and collagen, there are both thermal effect same as traditional heating and non-thermal effect representing as negative effect on collagen aggregation. This research would provide a scientific basis of collagen structures and properties under microwave irradiation.
微波因其可以迅速、 均匀和节能的方式进行加热, 被广泛用于食品加工; 又因其可以加快化学反应速度、 提高反应程度以及降低反应活化能, 具有不同于常规加热的非热效应, 被广泛用于各类化学反应中。 微波加热不同于常规加热, 是通过极性分子在高频变化的电磁场中产生摩擦而生热, 在此过程中分子之间会产生常规加热过程中不存在的额外碰撞, 使得物质在微波场中会表现出与其在相同温度的常规加热体系中截然不同的相互作用。 研究表明微波辐照会对蛋白质的组成和结构造成常规加热所不能产生的影响[1, 2]。
胶原蛋白是一种广泛存在于哺乳动物体内的结构性蛋白, 约占其体内蛋白含量的三分之一。 目前已经分离出超过28种类型的胶原蛋白, 其中I型胶原约占胶原总量的90%[3]。 I型胶原分子是由三条左手螺旋的肽链组成, 每条肽链含氨基酸约1 000个, 且氨基酸具有特征性的Gly-Pro-Hyp重复单元; 三条肽链通过右手螺旋缠绕成胶原蛋白特殊的三股螺旋结构[4]。 由于胶原特殊的物理化学性质, 其用途已远远不止制革和明胶等传统领域, 而越来越多的用于创伤敷料、 组织工程和药物载体等生物医用材料领域[5, 6, 7]。 然而, 天然胶原的结构稳定性相对较差, 在温度[8, 9]和紫外光等的作用下结构均会发生改变, 甚至变性。 胶原蛋白变性后, 三股螺旋结构被破坏, 生物活性基本完全丧失。
通过化学交联可以明显地提高胶原的稳定性, 目前, 微波辐照已在胶原的交联过程中得到了一定的应用[10, 11]。 然而, 在这些微波辅助的交联过程中, 微波辐照是否会在胶原蛋白这种温敏性材料完成交联前就对其结构产生破坏呢? 此外, 除了Li等[12]研究发现在不高于变性温度时, 微波辐照不会使胶原变性外, 关于微波辐照对胶原蛋白结构影响的研究, 国内外目前尚未见报道。 本研究在低于胶原变性温度的情况下, 以微波辐照I型胶原蛋白为微波样, 相同温度下利用水浴加热保温相同时间为水浴对比样, 未经加热处理为空白对比样, 利用紫外-可见光谱(UV-Vis)、 傅里叶变换红外光谱(FTIR)、 圆二色谱(CD)以及荧光光谱等方法, 对不同处理方式保温后胶原蛋白的三股螺旋和超分子结构进行表征, 阐明微波辐照对胶原蛋白结构的影响, 为将微波辐照用于胶原基材料的加工与改性提供参考, 同时为微波场中胶原结构和性质的变化提供科学依据。
新鲜牛跟腱, 购于成都农贸市场; 胃蛋白酶1∶ 3 000, 上海华舜生物工程有限公司; 丙酮、 冰乙酸、 氯化钠, 均为分析纯, 成都科龙化工试剂厂; 35000Da透析袋, 上海华美生化试剂公司; 实验所用水均为二次去离子水。
MCR-3S常压微波合成萃取仪, 西安予辉仪器有限公司; DF-101S集热式恒温加热磁力搅拌器, 武汉科尔仪器设备有限公司; Lambda25紫外可见分光光度计, 美国珀金埃尔默公司; Nicolet iS10傅里叶变换红外光谱仪, 赛默飞世尔科技分子光谱部; J-1500 CD圆二色光谱仪, 日本Jasco公司; F-7000荧光分光光度计, 日本日立公司。
1.2.1 胶原蛋白的提取
将新鲜牛跟腱剔膜洗净, 切成约0.5 cm× 0.5 cm碎块, 先用0.15 mol· L-1的氯化钠溶液浸泡24 h, 去除盐溶性蛋白, 再用用丙酮脱脂12 h, 然后用0.5 mol· L-1的乙酸为溶剂, 并加入牛跟腱重量10%的胃蛋白酶, 采用酸酶结合的方法于4 ℃下搅拌提取, 分离上清液得到粗胶原, 再经过滤、 离心、 盐析、 透析和冷冻干燥处理后, 得到I型胶原蛋白固体。
1.2.2 不同保温方式处理胶原蛋白
以0.5 mol· L-1的乙酸为溶剂, 配制浓度为0.5 mg· mL-1的胶原蛋白溶液, 于4 ℃下冷藏待用。 取20 mL胶原蛋白溶液于100 mL高型烧杯, 利用微波反应器在30℃下对胶原溶液保温60 min为微波样, 保温过程中打开换气扇(空气流量600 L· h-1)以促进热量交换, 使胶原溶液接受更多的微波能量; 相同温度下, 利用磁力搅拌器在30 ℃下对胶原溶液保温60 min作为水浴对比样。 未经保温处理的胶原蛋白为空白对比样。
1.2.1 UV-Vis光谱测试
以0.5 mol· L-1乙酸为参比, 利用紫外光谱仪测定微波样、 水浴对比样和空白对比样胶原蛋白溶液在250~325 nm范围内的紫外吸收光谱, 扫描速度为100 nm· min-1, 扫描间隔1 nm。
1.2.4 FTIR光谱测试
微波样、 水浴对比样和空白对比样胶原蛋白溶液冻干后, 进行FTIR测试。 取微量样品与溴化钾充分研磨后压片, 红外光谱仪光谱范围4 000~500 cm-1、 分辨率4 cm-1扫描32次。
1.2.5 CD光谱测试
将微波样、 水浴对比样和空白对比样胶原蛋白溶液稀释成0.05 mg· mL-1, 以溶剂(0.05 mol· L-1乙酸)为参比, 采用1 mm石英比色皿, 在25 ℃下, 于氮气气氛中用圆二色谱仪测定微波样、 水浴对比样和空白对比样胶原蛋白溶液在185~250 nm处的圆二色性, 扫描速度为50 nm· min-1, 每个样品重复扫描3次。
1.2.6 荧光光谱测试
在25 ℃下, 以0.5 mol· L-1乙酸为参比, 在激发波长为275 nm的条件下, 测定微波样、 水浴对比样和空白对比样胶原蛋白溶液在285~400 nm范围内的荧光发射光谱, 扫描速度120 nm· min-1, 扫描间隔1 nm。
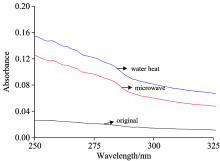
由于胶原蛋白中含有芳香族氨基酸酪氨酸和苯丙氨酸, 其在近紫外具有吸收峰。 微波样、 水浴对比样和空白对比样胶原蛋白溶液的紫外扫描结果如图1所示。 胶原蛋白在280 nm左右有一个宽而钝的吸收峰, 这是由278 nm左右酪氨酸残基的紫外吸收峰和259 nm左右苯丙氨酸残基特征吸收峰叠加形成的。 从图1可以看出, 与空白样相比, 无论是微波辐照还是水浴加热, 胶原蛋白溶液的吸光度均出现了明显的增加, 其中水浴样增加得更明显, 但是, 两种加热方式均未改变胶原紫外特征吸收峰的位置。 在加热过程中, 由于温度升高, 稳定胶原蛋白三股螺旋结构中的氢键相比于低温下有着被破坏的趋势, 因此胶原蛋白分子趋于收缩以使构象稳定, 在此过程中芳香族氨基酸残基间距离接近, 导致吸光度增加。 然而在微波场中, 由于极性分子在微波高频变化的电磁场中会产生受迫振荡, 振荡过程中相同电荷的基团受到静电斥力的作用, 会产生排斥, 阻碍了胶原分子中芳香族氨基酸残基的相互接近, 因此微波辐照下胶原蛋白吸光度的改变小于水浴加热。
红外光谱中酰胺带的特征吸收峰可以反映胶原的三股螺旋构象, 图2为微波样、 水浴对比样和空白对比样胶原蛋白的红外光谱图, 酰胺A带位于3 400 cm-1左右, 是由N— H伸缩振动与氢键形成了缔合体产生的; 酰胺B带位于2 950和2 850 cm-1左右, 是由— CH2的非对称和对称伸缩振动引起的; 酰胺Ⅰ 带位于1 660cm-1左右, 是由C=O伸缩振动引起的; 酰胺Ⅱ 带位于1 550和1 450 cm-1左右, 是由N— H弯曲振动和C— N伸缩振动的耦合以及— CH2弯曲振动引起的; 酰胺Ⅲ 带位于1 240 cm-1左右, 是由C— N伸缩振动、 肽链骨架N— H弯曲振动以及— CH2的摇摆振动引起的。 由图2可知, 无论是微波辐照还是水浴加热, 胶原蛋白酰胺A带和B带的位置未发生明显变化, 表明胶原结构未明显的破坏; 同时, 空白对比样、 水浴对比样和微波样的峰形依次变宽, 表明胶原分子间缔合氢键的数量减少, 这是由于升温过程中, 分子间相互碰撞更为剧烈, 减弱了彼此间的氢键作用。 胶原三股螺旋结构的破坏, 往往表现为酰胺Ⅰ 带和酰胺Ⅱ 带吸收峰的峰强度减弱, 峰形也发生明显变化, 酰胺Ⅰ 带由宽而钝的峰型逐渐变成尖峰, 而酰胺Ⅱ 带由比较尖的峰型逐渐变成比较宽而钝的峰, 图2表明, 微波样、 水浴样和空白样胶原蛋白酰胺Ⅰ 带、 Ⅱ 带和Ⅲ 带的位置和峰形均未发生明显的移动, 说明胶原的三股螺旋结构并未被破坏。 因此, 通过红外光谱图可以发现, 在低于胶原变性温度的条件下, 微波辐照不会破坏胶原的三股螺旋结构。
此外, 酰胺Ⅲ 带与1 450 cm-1处吸光度的比值可以衡量胶原三股螺旋结构是否完整, 当胶原三股螺旋结构被破坏时, 该比值明显降低[13]。 由图2结果可计算出微波样、 水浴对比样和空白对比样胶原蛋白酰胺Ⅲ 带与1 450 cm-1处吸光度的比值分别为0.993 9, 0.983 6和0.965 7, 该比值在加热过程中出现了一定程度的减小, 其中微波辐照减小的更多一些, 但减小幅度均不明显, 明显大于变性胶原和明胶的该比值(约0.6)。
民用微波中常用的微波频率为2 450 MHz, 其光量子能量为10-5 eV, 而共价键键能约为5 eV, 离子键键能约为7.6 eV, 即使氢键键能也在0.04~0.44 eV之间[14], 所以就微波而言, 它不会直接破坏任何化学键。 因此, 在低于胶原变性温度的情况下, 微波辐照并不会破坏胶原的三股螺旋结构。 然而, 胶原分子在高频变换的微波场中受到常规加热条件下没有的高频受迫振荡, 会对胶原蛋白的超分子结构造成一定的影响, 这可能是微波辐照后胶原蛋白酰胺Ⅲ 带与1 450 cm-1处吸光度比值更低, 以及酰胺A带峰形变宽的原因。
胶原有三条左旋α 螺旋结构的肽链, 以平行、 右旋螺旋形式缠绕成“ 绳索状” 三股螺旋结构, 其在远紫外区(185~250 nm) 存在特征吸收光谱, 即在197 nm处有一负峰, 在220 nm左右处有一正峰。 图3为微波样、 水浴对比样和空白对比样胶原蛋白溶液的圆二色谱图。 通常, 胶原蛋白的变性或者其三股螺旋结构的破坏会使得胶原圆二色谱图在198 nm 处的负峰发生红移和在221 nm处的正峰消失。 由图3可知, 三个胶原蛋白样品的负峰均位于197 nm处, 未发生红移, 正峰均位于222 nm处, 且均未消失, 说明胶原的三股螺旋结构在水浴加热和微波辐照中未受到破坏。
胶原圆二色谱中, 正峰强度与负峰强度的比值(Rpn)通常被用来表征胶原溶液的构象, Rpn的变化在一定程度上能够反映胶原结构的变化。 胶原三股螺旋结构受到显著破坏时时, Rpn值下降至0甚至负数。 根据计算, 微波样、 水浴对比样和空白对比样胶原溶液的Rpn值分别为0.138, 0.123和0.097。 Rpn值的变化说明加热过程胶原的三股螺旋结构均受到了一定的影响, 主要是由于温度升高, 对胶原分子内部的氢键造成影响, 从而对其构象产生了影响。 然而, 即便是微波辐照的胶原溶液的Rpn值也为0.097, 与完全变性后胶原或者明胶Rpn值为0甚至负数有着很大的差异。
胶原生物大分子在浓度、 温度和溶剂等的影响下, 会产生不同的聚集行为, 本研究采用0.5 mg· mL-1的胶原溶液, 浓度已超过其临界聚集浓度, 会在溶液中产生聚集现象。 胶原溶液产生聚集, 圆二色谱图中表现为负峰强度降低。 由图3可以看出, 微波样、 水浴对比样和空白对比样胶原蛋白溶液负峰处的强度逐渐降低, 表明无论是微波辐照还是水浴加热, 都促进了胶原蛋白的聚集, 但是, 水浴加热的胶原蛋白, 负峰强度降低得更多, 表明胶原的聚集更明显。 同时, 微波辐照胶原的Rpn值较水浴加热的低, 表明微波辐照的胶原蛋白发生了部分解聚, 聚集行为受到抑制。 这是由于胶原分子在微波电磁场中快速地翻转、 移动, 分子间相互作用增强, 再加上相同电荷的基团在微波场作用下取向趋于一致而产生的斥力, 阻碍了胶原分子的聚集。
胶原中没有色氨酸, 苯丙氨酸含量也较少, 同时, 苯丙氨酸的荧光强度较酪氨酸低得多, 因此酪氨酸残基是胶原蛋白荧光特性的主要来源。 在激发波长为275 nm时, 微波样、 水浴对比样和空白对比样胶原溶液的荧光发射光谱如图4所示。
由图4可以看出, 胶原蛋白的荧光发射特征峰从空白对比样的316 nm, 紫移至微波样的313 nm和水浴样的312 nm, 表明在微波辐照和水浴加热过程中, 胶原蛋白均发生了聚集现象。 然而水浴对比样红移更多, 表明胶原蛋白的聚集更为显著, 由此也可以说明微波辐照抑制了胶原蛋白的聚集行为。
利用紫外-可见光谱、 傅里叶变换红外光谱、 圆二色谱以及荧光发射等光谱分析, 对在30 ℃下微波辐照的0.5 mg· mL-1胶原蛋白的三股螺旋结构进行了表征, 发现在胶原变性温度以下, 微波辐照不会破坏胶原蛋白的三股螺旋结构, 胶原蛋白分子结构没有受到破坏。 然而, 微波辐照会对胶原蛋白分子的超分子结构产生一定的影响, 表现为抑制胶原蛋白分子聚集。 总之, 微波辐照对胶原蛋白的作用既有与常规加热相同的热效应, 又有常规加热过程中不存在的非热效应, 非热效应表现为抑制胶原蛋白的聚集行为。 研究结果表明, 在不超过胶原变性温度的情况下, 将微波辐照用于胶原蛋白的加工过程, 不会对胶原结构产生显著的负面影响。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|