作者简介: 曾玉萍, 女, 1998年生, 吉林农业科技学院农学院硕士研究生 e-mail: yupingzeng0422@163.com
腐殖质(HS)是由各类前体物质缩聚而成, 前体物质是调控HS形成的关键。 Maillard反应前体物质能否对木质素转化、 HS形成有促进作用有待验证。 鉴于此, 采用液体摇瓶培养法, 以木质素培养液为研究对象, 通过添加邻苯二酚、 葡萄糖和甘氨酸的单一及组合溶液, 启动120 d的液体摇瓶培养, 采用离心法收集上清液(细胞代谢产物)和沉淀(菌体残留物), 分析两者性质并深入研究菌体残留物FTIR的光谱特性, 系统评价各前体物质对木质素向HS转化的贡献。 结果表明: (1)在木质素培养液中添加甘氨酸, 历经液体摇瓶培养更有利于细胞代谢产物有机分子的缩合, 使其结构趋于复杂, 而邻苯二酚参与的4个处理及单独添加葡萄糖更易促进细胞代谢产物的降解, 使其分子结构更加简单。 与作为空白对照(CK)的无菌去离子水相比, 外源添加Maillard反应前体物质能够促进细胞代谢产物矿化, 使总有机碳(total organic carbon, TOC)含量下降, 单一添加邻苯二酚能够使细胞代谢产物TOC含量始终高于其他处理; (2)添加Maillard反应前体物质可显著提升木质素微生物转化形成菌体残留物的回收率, 单一添加邻苯二酚的菌体残留物回收率提升幅度最大, 而邻苯二酚、 葡萄糖和甘氨酸三者组合溶液对菌体残留物回收率的提升幅度最小, 葡萄糖和甘氨酸的组合溶液使菌体残留物回收率在整个培养期间始终处于最高水平。 添加Maillard反应前体物质使菌体残留物TOC含量的增加幅度小于CK, 尽管如此, 培养结束时, 邻苯二酚参与的4个处理、 葡萄糖和甘氨酸组合溶液的添加使菌体残留物TOC含量显著高于CK; (3)木质素经微生物转化形成的菌体残留物拥有羟基O—H、 不对称脂族—CH3、 对称脂族—CH2—、 芳香碳C=C及多糖类物质, 与土壤胡敏酸有着相似的FTIR特征, 但其分子缩合度尚无法达到土壤胡敏酸的复杂程度。 各处理在完成培养后, 菌体残留物中的羟基含量有着不同程度增加, 而多糖含量有所下降, 单一甘氨酸以及葡萄糖和甘氨酸组合溶液的添加使菌体残留物的脂族化程度提高, 而邻苯二酚参与的4个处理及单独添加葡萄糖可使菌体残留物中的芳香碳比例进一步提高。 综上, 添加Maillard反应前体物质可促进细胞代谢产物矿化, 使TOC含量下降、 提高菌体残留物回收率, 同时使其羟基含量增加、 多糖含量降低, 不同前体物质对菌体残留物脂族化和芳香化的影响规律不同, 邻苯二酚参与的4个处理及单一添加葡萄糖可使菌体残留物中的芳香碳比例提高。
Humic substances (HS) are formed by the polycondensation of various precursors, and the precursors are the key to regulating the formation of HS. Whether the Maillard reaction precursors can promote the microbial transformation of lignin and the formation of HS remains to be verified. Given this, the method of liquid shake flask culture was adopted, the lignin culture medium serving as the research object, and the liquid shake flask culture of 120 d was started by adding single and combined solutions of catechol, glucose and glycine, and collected the supernatant (cell metabolites) and precipitate (microbial residues) by the centrifugation method. The properties of the cell metabolites and microbial residues were analyzed, and an in-depth study of the FTIR spectral characteristics of bacterial residues was necessary, which was used to evaluate the contribution of each precursor to the microbial transformation of lignin to HS more systematically. The results showed that: (1) Adding glycine into the lignin culture medium after the liquid shake flask culture was more conducive to the condensation of cell metabolites organic molecules, making their structures more complex, while the treatments involving catechol and the addition of glucose alone could promote the degradation of cell metabolites and make their molecular structures simpler. Compared with CK, exogenous addition of Maillard reaction precursors could promote the TOC content loss of cellular metabolites, and single catechol could make the TOC content of cellular metabolites always higher than other treatments; (2) The addition of Maillard reaction precursors could significantly increase the recovery rate of microbial residues formed from the microbial transformation of lignin, in which the recovery rate of microbial residues formed from the treatment of single catechol was the largest. In contrast, the combined solution of catechol, glucose and glycine had the smallest effect on the improvement of the recovery rate of microbial residues. The combined solution of glucose and glycine could keep the recovery rate of microbial residue at the highest level throughout the culture period. Adding Maillard reaction precursors could result in a smaller increase in the TOC content of microbial residues than CK. However, at the end of the culture, the four treatments involving catechol and the addition of a combination solution of glucose and glycine could enhance the TOC content of microbial residues significantly higher than CK; (3) The microbial residues formed from the microbial transformation of lignin had hydroxyl O—H, asymmetric aliphatic —CH3, symmetrical aliphatic —CH2—, aromatic C=C and polysaccharides, which had similar FTIR characteristics to soil humic acid, but its molecular condensation degree could not reach the complexity of soil humic acid. After the completion of the culture, the hydroxyl content in the microbial residues was increased to different degrees, while the polysaccharide content decreased. The addition of a single glycine and the combined solution of glucose and glycine could increase the aliphatic degree of the microbial residues while the content of polysaccharides decreased. The four treatments involving catechol and a single addition of glucose could further increase the proportion of aromatic C in the microbial residues. In conclusion, the addition of Maillard reaction precursors could reduce the TOC content of cell metabolites, improve the recovery rate of microbial residues, and, at the same time, increase the content of hydroxyl groups and reduce the content of polysaccharides. Different precursors had different effects on the aliphatic and aromatization of microbial residues. The effects of aromatization were different. Four treatments involving catechol and a single addition of glucose could increase the proportion of aromatic C in microbial residues.
木质素是自然界中来自于动植物、 含量仅次于纤维素且具有三维稳定结构的高分子聚合物[1], 也是输入土壤碳源类型中芳香结构最丰富的天然有机大分子。 在堆肥过程中, 木质素的难降解特性使其成为堆肥腐熟的限速因子。 腐殖质(humus, HS)是堆肥腐熟的标志性产物, 木质素与HS形成关系密切, HS的芳香性主要源于木质素, HS是由木质素、 蛋白质及其中间分解产物在微生物作用下发生聚合反应而形成, 木质素对HS形成的贡献远大于纤维素[2]。
在木质素腐殖化过程中, 酚类、 醌类及脂类化合物等木质素降解产物是HS形成的主要前体物质[3]。 HS是由各类前体物质缩聚而成, 前体物质是调控HS形成的关键[4]。 Yavmetdinov等[5]指出, 木质素的降解产物、 苯丙烷与氨基酸间的共聚合作用可形成类似于HS的高分子聚合物。 在Maillard反应中, 氨基酸、 糖和奎宁等前体物质对HS形成至关重要, 上述前体物质通过氧化和亲核反应可聚合形成类似于HS的暗色物质[6]。 Wu等[4]研究了堆肥过程中多酚、 羧酸、 氨基酸、 还原糖和多糖等5类前体物质的含量变化, 指出: 前体物质通过木质素-蛋白质途径、 多酚途径和Maillard反应等机制显著促进HS的形成[7]。 Zhang等[8]在玉米秸秆和鸡粪共堆肥中添加苯甲酸及提取油后的大豆渣来研究前体物质对堆肥HS的影响, 结果表明, 添加前体物质可促进堆肥HS的形成, 使腐殖酸得以累积。
可见, 前体物质对木质素转化、 HS形成确有激发效应。 然而, 关于Maillard反应前体物质激发效应在木质素向HS转化的影响规律及机理方面, 尚缺乏相关报道。 鉴于此, 本研究采用液体摇瓶培养法, 以木质素培养液为研究对象, 通过添加邻苯二酚、 葡萄糖和甘氨酸的单一及组合溶液, 启动120 d的液体摇瓶培养, 采用离心法收集上清液(细胞代谢产物)和沉淀(菌体残留物), 从两者性质入手, 重点分析菌体残留物的FTIR光谱特性, 系统评价各前体物质对木质素向HS转化的贡献, 以期为加快堆肥腐熟进程、 促进木质素向HS转化提供科学依据。
木质素(CAS No.[9005-53-2])购于东京化成工业株式会社; 邻苯二酚(C6H6O2, 分子量: 110.11, 含碳量65.4%)、 葡萄糖(C6H12O6, 分子量180.16, 含碳量40.0%)及甘氨酸(C2H5NO2, 分子量: 75.07, 含碳量32.0%)均购于国药集团试剂。
木质素培养液的制备: 将木质素1.0 g、 NaNO3 2.0 g、 K2HPO4 1.0 g、 KCl 0.5 g、 MgSO4 0.5 g和FeSO4 0.01 g溶于1 000 mL蒸馏水中, 不调pH值。
菌悬液的制备: 在吉林市猴石山(E 126° 30'24″, N 43° 57'13″)海拔263 m针阔混交林下采集枯枝落叶层与地表界面的新鲜土壤, 去除肉眼可见的植物残体, 用1.0 mm孔径塑料筛就地筛分, 均匀混合、 密封带回实验室, 保存于4 ℃冰箱。 称取100 g新鲜土壤于1 000 mL锥形瓶中, 用200 mL无菌去离子水混合, 在28 ℃气浴振荡器中以120 r· min-1的转数振荡提取2 h, 静止沉降30 min后以3 500 r· min-1的转数离心15 min收集上清液, 制得混合菌悬液。 经牛肉膏蛋白胨培养基、 改良高氏1号培养基、 马丁-孟加拉红培养基的稀释平板法测定, 悬液中细菌数量19.6× 106 cfu· mL-1、 放线菌数量3.5× 105 cfu· mL-1、 真菌数量4.7× 104 cfu· mL-1。
采用液体摇瓶培养法, 量取若干300 mL木质素培养液装入500 mL锥形瓶中。 以添加15 mL无菌去离子水为空白对照(CK), 另设7个添加Maillard反应前体物质的处理: (1)15 mL 0.12 mol· L-1邻苯二酚(L); (2)15 mL 0.12 mol· L-1葡萄糖(P); (3)15 mL 0.12 mol· L-1甘氨酸(G); (4)7.5 mL 0.12 mol· L-1邻苯二酚+7.5 mL 0.12 mol· L-1葡萄糖(LP); (5)7.5 mL 0.12 mol· L-1邻苯二酚+7.5 mL 0.12 mol· L-1甘氨酸(LG); (6)7.5 mL 0.12 mol· L-1葡萄糖+7.5 mL 0.12 mol· L-1甘氨酸(PG); (7)5 mL 0.12 mol· L-1邻苯二酚+5 mL 0.12 mol· L-1葡萄糖+5 mL 0.12 mol· L-1甘氨酸(LPG)。 每个处理在0、 60和120 d三个培养时间下均重复三次, 将上述用于培养的锥形瓶用无菌透气膜统一包扎并进行121 ℃的高压蒸汽灭菌20 min, 待灭菌完全且在无菌条件下自然冷却后, 按照20 mL菌悬液/培养瓶的接种量在无菌操作条件下进行接种, 接种后再次包扎, 在28 ℃恒温条件下转数为180~200 r· min-1的摇床中培养; 分别在0、 60和120 d进行动态取样, 取样后立即高速离心(16 000 r· min-1, 10 min), 离心后上清液为细胞代谢产物, 沉淀为菌体残留物, 菌体残留物收集后在60 ℃下鼓风干燥, 磨细过0.01 mm孔径筛, 备用。
FTIR(Fourier transform infrared spectra): 将菌体残留物粉末状样品与光谱纯KBr 1:100混合、 研磨、 压片, 利用FTIR-850傅里叶变换红外光谱仪(天津港东科技发展股份有限公司)对样品进行FTIR测试: 扫描次数32, 分辨率4 cm-1, Y轴格式: 透过率, 切趾方式: Triangle, 每次采集样品前需进行背景扣除。
采用北京普析通用仪器有限责任公司生产的TU-1901型紫外可见分光光度计对细胞代谢产物的光密度(A465 nm和A665 nm)进行测定, 用A465和A665表示, 由此计算E4/E6=A465/A665; 采用SPSS 18.0对数据进行差异显著性分析, 用Excel 2003整理数据并绘图。
通常, 用腐殖质E4/E6可表征其芳香度, 即E4/E6越高, 表明腐殖质的芳香度越低[9]。 在本试验中, 鉴于腐殖质和细胞代谢产物均为暗棕色物质, 因此借用E4/E6来评价细胞代谢产物分子的复杂程度。 由图1可知, 添加不同Maillard反应前体物质对细胞代谢产物E4/E6的影响规律不一。 随着液体培养进行, L、 LP和LG处理的细胞代谢产物E4/E6逐渐增加, P、 G和PG处理的E4/E6先大幅度增高再降低, LPG处理的E4/E6先略有降低再增高, 而CK则表现为渐趋降低的规律。 与0 d相比, 在培养结束时(120 d), L、 P、 LP、 LG和LPG处理的E4/E6分别增高了7.0%、 7.8%、 21.5%、 44.0%和21.4%, 而G、 PG和CK分别下降了26.4%、 3.6%和19.0%。 可见, 由邻苯二酚参与的4个处理(L、 LP、 LG和LPG)及单独添加葡萄糖更有利于木质素培养液细胞代谢产物的降解、 使其分子结构更加简单, 其中, 添加邻苯二酚和甘氨酸的组合溶液在提高细胞代谢产物E4/E6、 促进有机分子结构简单化方面的优势最大, 邻苯二酚的加入能够促进细胞代谢产物的降解, 使其分子结构更加简单, 而单一添加甘氨酸在降低细胞代谢产物E4/E6、 促进有机分子缩合、 使其结构复杂方面更有优势。 木质素-蛋白质理论和酚-蛋白质理论均涉及到多酚和氨基酸之间的缩聚反应, 是自然界中重要的腐殖化途径[10]。 Wu等[11]报道指出, 在堆肥过程中, 堆料氨基酸含量下降了68.3%, 而HS的形成数量增加了37.33%, 可见, 氨基酸是通过土壤或堆肥中发生的氧化聚合过程形成HS的重要前体物质。 Tan等[7]利用美拉德反应还解释了在多糖、 还原糖和氨基酸参与下, 缺失多酚的环境中形成HS的情况。 由此可知, 酚类并不是HS形成的必需前体物质。 甘氨酸是氨基酸系列中结构最简单的一类物质, 其添加可增加细胞代谢产物分子的复杂程度, 而邻苯二酚的参与和单一葡萄糖的添加起到了给微生物供能的作用, 增强了细胞代谢产物的降解。
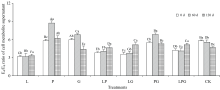 | 图1 添加不同Maillard反应前体物质对木质素微生物转化形成细胞代谢产物E4/E6的影响Fig.1 Effects of adding different Maillard reaction precursors on E4/E6 ratio of cell metabolite formed from microbial transformation of lignin |
由图2所示, 随着培养时间延长, 各处理的细胞代谢产物TOC含量均表现为先大幅度下降再有所提升的规律。 与0 d相比, 培养结束时(120 d), L、 P、 G、 LP、 LG、 PG、 LPG及CK处理的细胞代谢产物TOC含量分别下降了38.8%、 37.7%、 17.8%、 42.0%、 39.6%、 24.0%、 35.1%和6.7%。 可见, 与CK相比, 外源添加的Maillard反应前体物质可在一定程度上充当微生物的能量物质[12], 促进细胞代谢产物的矿化、 使其TOC含量下降, 其中, LP处理优势最大, 其次为LG。 尽管如此, 培养结束时, 添加不同Maillard反应前体物质的细胞代谢产物TOC含量仍显著高于CK, 这与外源加入Maillard反应前体物质本身的含碳量有关, 邻苯二酚的含碳量是65.4%, 远高于葡萄糖40.0%和甘氨酸32.0%的含碳量, 因此在整个培养期间, 单一添加邻苯二酚的细胞代谢产物TOC含量始终高于其他处理, 而CK则一直处于最低水平。
由图3可见, 随着培养时间的延长, 不同处理的菌体残留物回收率呈现不同的规律。 LP处理的菌体残留物回收率先升高后下降, CK的逐渐降低, 而L、 P、 G、 LG、 PG和LPG处理则表现为渐趋增高的规律。 与0 d相比, 培养结束时(120 d), 除了CK的菌体残留物回收率由3.3%降至2.1%, L、 P、 G、 LP、 LG、 PG和LPG处理菌体残留物回收率分别增加了123.3%、 43.7%、 48.1%、 20.2%、 87.6%、 97.7%和15.1%。 可见, 添加Maillard反应前体物质可显著提升木质素微生物转化形成菌体残留物的回收率。 Zhang等[8]研究指出, 添加更多的前体物质能够促进堆肥腐熟并提高HS形成的数量。 相比较而言, 单一添加邻苯二酚的优势最明显, 邻苯二酚、 葡萄糖和甘氨酸三者组合溶液对菌体残留物回收率的提升幅度最小, 葡萄糖和甘氨酸的组合溶液使菌体残留物回收率在整个培养期间始终处于最高水平, 这是因为葡萄糖给微生物供能, 木质素和甘氨酸可以结合形成木质素-蛋白质复合物, 这也是HS形成的核心[13]。
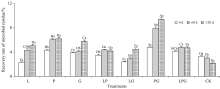 | 图3 添加不同Maillard反应前体物质对木质素微生物转化形成菌体残留物回收率的影响Fig.3 Effects of adding different Maillard reaction precursors on the recovery rate of microbial residue formed from microbial transformation of lignin |
由图4可知, 随着培养进行, 各处理的菌体残留物TOC含量有着不同的变化规律。 其中, L、 LG、 PG和CK的菌体残留物TOC含量逐渐增加, P、 LP和LPG处理的菌体残留物TOC含量先大幅度增高再有所下降, 而G处理先有所降低再大幅度增加。 培养结束时(120 d), L、 P、 G、 LP、 LG、 PG、 LPG和CK的菌体残留物TOC含量分别是培养0 d结果的11.6倍、 3.3倍、 3.5倍、 8.1倍、 8.7倍、 4.2倍、 7.7倍和13.3倍。 可见, 由于0 d培养下CK的菌体残留物TOC含量最低, 因此添加Maillard反应前体物质处理的菌体残留物TOC含量的增加幅度均小于CK, 但横向比较培养结束时(120 d)的结果可知, 邻苯二酚参与的4个处理(L、 LP、 LG和LPG)及PG处理的菌体残留物TOC含量均显著高于CK。 其中, 单独添加邻苯二酚处理的菌体残留物TOC含量为最高(666.7 g· kg-1), 其次为邻苯二酚和甘氨酸的组合溶液(641.5 g· kg-1)。 单一添加葡萄糖和甘氨酸下的菌体残留物TOC含量最小, 分别为237.6和231.9 g· kg-1, 上述单独添加邻苯二酚、 葡萄糖和甘氨酸墩菌体残留物TOC含量的影响差异均是由本身含碳量决定的。 HS形成和微生物活动之间的底物竞争不可避免地影响HS形成的效率[14]。 Maillard反应前体物质既可作为底物给微生物供能, 同时还能参与微生物周转最终形成菌体残留物。
为了明确不同Maillard反应前体物质对木质素微生物转化形成菌体残留物FTIR的影响, 对比培养0和120 d的结果, 如图5所示。 图5(a)为未加反应前体物的参考物的光谱, 图5(b)为加葡萄糖(P)的光谱; 图5(c)为加邻苯二酚(L)的光谱, 图5(d)为加入甘酸氨(G)的光谱, 图5(e)为同时加入葡萄糖和甘氨酸(PG)的光谱, 图5(f)为同时加入邻苯二酚和甘氨酸(LG)的光谱, 图5(g)为同时加入邻苯二酚和葡萄糖(LP)的光谱, 图5(h)为同时加入邻苯二酚、 葡萄糖和甘氨酸(LPG)的光谱。 各特征峰峰位归属见表1[15, 16], 结合图5和表1可知, 微生物利用木质素形成菌体残留物的含氧官能团主要是羟基O—H、 不对称脂族—CH3、 对称脂族—CH2—、 芳香碳C=C及多糖类物质。 可见, 菌体残留物与土壤胡敏酸有着极为相似的FTIR特征, 但缺失了代表羧基C=O伸缩振动、 1 720 cm-1处的弱峰以及在1 395 cm-1处代表酚类O—H变形和C—O伸缩振动产生的小峰[17]。 Hardie等[18]报道指出, 在δ -MnO2催化下, 葡萄糖能够促进邻苯二酚的腐殖化过程, 此外, 增加葡萄糖与邻苯二酚、 甘氨酸间的摩尔比还能够促进类似于天然HS结构的低分子量、 含有羧基的物质产生。 由此推测, 缺失δ -MnO2等矿物的参与, 菌体残留物的分子缩合度尚无法达到土壤胡敏酸的复杂程度。
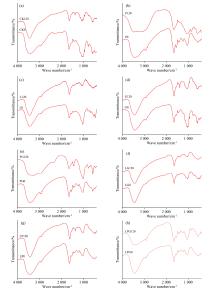 | 图5 添加不同Maillard反应前体物质对木质素微生物转化菌体残留物FTIR光谱的影响Fig.5 Effects of adding different Maillard reaction precursors on FTIR spectra of microbial residue formed from microbial transformation of lignin |
| 表1 峰位及归属情况 Table 1 Peak position and corresponding assignment |
各特征峰相对强度的半定量分析结果见表2。 由表2可知, 经过120 d的液体摇瓶培养, 各处理下菌体残留物中的羟基含量均有着不同程度提高, 多糖类物质含量有所下降, 上述规律表明: 随液体摇瓶培养的进行, 微生物以木质素降解产生的多糖类物质为能源物质, 伴随微生物对木质素的进一步氧化降解, 木质素降解产物也成为了HS形成的重要前体物质[19], 死亡微生物以菌体形式与木质素降解产物间以氢键形式相互缔结[20], 最终形成菌体残留物, 在此过程羟基振动加强、 多糖比例下降[21]。 为了明确菌体残留物中脂族碳和芳香碳的比例变化, 结合表1中的峰位归属情况, 用(a+b)/(c+d)比值表征两者间的相对含量变化, 根据该比值变化规律可知, G、 PG和CK的(a+b)/(c+d)比值在完成培养时均有所增加, 表明在木质素培养液中单独添加甘氨酸, 葡萄糖和甘氨酸的组合溶液以及CK下的无菌去离子水, 经培养所收集的菌体残留物脂族化程度更高了, 而L、 P、 LP、 LG和LPG处理的(a+b)/(c+d)比值历经培养后有着不同程度下降, 表明菌体残留物在单独添加邻苯二酚、 葡萄糖、 邻苯二酚和葡萄糖的组合溶液、 邻苯二酚和甘氨酸的组合溶液以及三者共存溶液影响下芳构化程度提高了, 其中, 邻苯二酚参与的4个处理及单独添加葡萄糖均有利于菌体残留物稳定型碳比例的提高。 以邻苯二酚为代表的多酚在非生物腐殖化过程中是一种比还原糖和氨基酸更不稳定且反应性更强的前体物质[22], 可显著促进HS的芳香性, 使HS分子结构更加稳定[23]。 Zhang等[24]添加不同浓度的邻苯二酚, 探讨了MnO2对葡萄糖和甘氨酸非生物缩合的影响, 结果表明, 提高邻苯二酚浓度可促进富里酸(FA)和胡敏酸(HA)的形成, 更有助于提高HA分子的不饱和度。 有研究表明, 木质素等结构复杂的多酚聚合物, 在堆肥过程中也会降解, 产生简单的酚类, 然后代谢或参与聚合反应, 在HS的形成中发挥着关键作用[7, 25]。 葡萄糖作为重要的能量和碳源, 可以直接参与HS的形成[8], 促进FA向HA转化, 使分子结构进一步复杂化。
| 表2 菌体残留物FTIR主要吸收峰相对强度的变化 Table 2 Changes of relative intensity of FTIR main absorption peaks of microbial residue |
(1)在木质素培养液中添加甘氨酸, 历经液体摇瓶培养更有利于细胞代谢产物有机分子的缩合, 使其结构更加就复杂, 而邻苯二酚参与的处理及单独添加葡萄糖更易促进细胞代谢产物的降解, 使其分子结构更加简单。 与CK相比, 外源添加Maillard反应前体物质更能促进细胞代谢产物TOC含量的损失, 仅添加邻苯二酚会使细胞代谢产物TOC含量始终高于其他处理;
(2)添加Maillard反应前体物质可显著提升木质素微生物转化形成菌体残留物的回收率, 单独添加邻苯二酚对菌体残留物回收率的提升幅度最大, 而邻苯二酚、 葡萄糖和甘氨酸三者组合溶液对菌体残留物回收率的提升幅度最小, 葡萄糖和甘氨酸的组合溶液使菌体残留物回收率在整个培养期间始终处于最高水平。 添加Maillard反应前体物质使菌体残留物TOC含量的增加幅度小于CK, 尽管如此, 培养结束时, 邻苯二酚参与的4个处理、 葡萄糖和甘氨酸组合溶液的添加使菌体残留物TOC含量显著高于CK;
(3)木质素经微生物转化形成的菌体残留物与土壤胡敏酸有着相似的FTIR特征, 但其分子缩合度尚无法达到土壤胡敏酸的复杂程度。 各处理在完成培养后, 菌体残留物中的羟基含量有着不同程度增加, 而多糖含量有所下降, 单独甘氨酸以及葡萄糖和甘氨酸组合溶液的添加使菌体残留物的脂族化程度提高, 而邻苯二酚参与的4个处理及单一添加葡萄糖可使菌体残留物的芳构化程度进一步提高。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|




