作者简介: 翟好英, 女, 1973年生, 内江师范学院化学化工学院教授 e-mail: hszhy@163.com
基于3,3’,5,5’(四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine, TMB)和吖啶橙(AO)之间荧光共振能量转移(FRET), 建立了一种快速、 低背景干扰、 高灵敏度测定盐酸左氧氟沙星(LVF)的新型比率型荧光探针。 在pH 5.0 NaAc-HCl缓冲溶液中, 在310 nm的光激发下, TMB在350~500 nm处的荧光光谱和AO的吸收光谱重叠。 以TMB作为能量供体, AO作为能量受体, 构建了FRET体系。 根据能量转移理论, 该体系的荧光共振能量转移效率为62.5%, 供体-受体间距离为2.17 nm, 进一步说明TMB和AO之间发生了FRET。 当在体系中加入LVF后, TMB将荧光能量转移给LVF, LVF又作为供体将能量转移给AO。 LVF在TMB和AO之间起到桥梁作用, LVF将吸收的TMB荧光能量转移给AO, 使得TMB荧光强度明显降低, AO的荧光强度则显著增加, 从而提高了体系的FRET效率。 在最优实验条件下, F546 nm与 F402 nm之比与LVF浓度(2~80 μmol·L-1)之间存在良好的线性关系, 线性回归方程为 F546 nm/ F402 nm=87.916 c+3.108, 线性相关系数为0.999 3, 检出限(LOD)为15.7 nmol·L-1。 一些常见的阳离子(K+, Mg2+, Ca2+, Cu2+, Mn2+, Zn2+, Co2+, Ni2+, Cr3+等)、 阴离子(F-, Br-, N
A novel ratiometric fluorescence probe for the determination of levofloxacin hydrochloride (LVF) was established based on fluorescence resonance energy transfer (FRET) between 3, 3’, 5, 5’-tetramethylbenzidine (TMB) and acridine orange (AO). Under 310 nm excitation, the fluorescence spectra of TMB at 350~500 nm overlap with the absorption spectra of AO in the pH 5.0 NaAc-HCl buffer solution. Accordingly, the FRET system is constructed with TMB as the energy donor and AO as the energy receptor. According to the energy transfer theory, the FRET efficiency of the system is 62.5%, and the distance between the donor and receptors is 2.17 nm, further indicating that FRET occurs between TMB and AO. When LVF is added, TMB transfers the fluorescence energy to LVF, which transfers the energy to AO as a donor. LVF acts as a bridge between TMB and AO. LVF transfers the absorbed fluorescence energy of TMB to AO, resulting in a significant decrease in the fluorescence intensity of TMB and a significant increase in the fluorescence intensity of AO, thus improving the FRET efficiency of the system. Under the optimal experimental conditions, there is a good linear relationship between the ratio of F546 nm to F402 nm and LVF concentration in the 2~80 μmol·L-1 range. The linear regression equation is F546 nm/ F402 nm=87.916 c+3.108, the linear correlation coefficient is 0. 9993, and the detection limit (LOD) is 15.7 nmol·L-1. Some common cations (K+, Mg2+, Ca2+, Cu2+, Mn2+, Zn2+, Co2+, Ni2+, Cr3+, etc), anions (F-, Br-, N
左氧氟沙星(LVF, 结构式如示意图1)是一种第三代氟喹诺酮类药物, 通过抑制细菌DNA复制、 转录、 修复和重组所需的拓扑异构酶IV和DNA旋回酶发挥作用, 对革兰氏阳性菌和革兰氏阴性菌均具有广谱杀菌活性, 广泛应用于治疗人类和动物体内各种细菌感染、 细菌性肺炎和免疫缺陷病毒[1, 2, 3]。 用药过量会产生头晕、 嗜睡、 说话含糊不清、 恶心、 呕吐、 肌腱问题、 严重的情绪或行为改变或低血糖等副作用。 在极少数情况下, LVF甚至可引起主动脉损伤, 引发出血或死亡的风险[4]。 因此, 开发一种灵敏可靠的LVF检测方法对于确保用药量合理、 维护人体健康具有重要意义。
目前, 已报道的检测LVF的方法主要有: 高效液相色谱法[1, 5]、 电化学法[4, 6]、 荧光法[7, 8, 9]、 高效液相色谱-荧光法[10, 11]、 分光光度法[12]、 化学发光法[13]等。 这些方法中, 多数存在仪器昂贵、 分析时间长、 灵敏度低、 样品预处理复杂等缺点。 荧光法具有成本低、 操作简单、 灵敏度高、 选择性好等特点[14], 但其发射强度可能受到许多因素的影响, 如光电系统(灯和探测器)的漂移、 探针浓度、 自身荧光等, 在定量检测中容易受到干扰。 比率型荧光传感器通过测量不同波长的两种发射强度之比值, 可以避免上述问题, 得到更高的准确度和灵敏度。 荧光共振能量转移(FRET)是荧光比率探针设计中常用的一种传感机制, 其中有两个荧光团, 一个充当供体, 另一个充当受体, 激发态的供体可通过光子的非辐射跃迁将能量转移到受体而不发生任何光子发射, 能量转移导致供体荧光强度降低而受体荧光强度增加, 通过计算受、 供体两个发射波长的强度比来检测待测物, 不仅为环境影响提供内置校正, 还可以增加荧光测量的动态范围[14, 15]。 尤其是FRET具有在固定激发波长下显著的发射位移优点, 可以降低背景干扰, 提高生物分析的灵敏度。
FRET能量传递的效率取决于供体发射光谱和受体吸收光谱重叠的程度、 供体的量子产率、 供体和受体之间的距离(一般小于7 nm[16])等[17, 18]。 选择合适的供体和受体对于FRET体系的构建极为重要。 3, 3’ , 5, 5’ (四甲基联苯胺(TMB)是一种常见的芳香胺(结构式如示意图1), 由于其检测灵敏度和准确度高、 稳定性好, 且相对于其他底物(如联苯胺和邻苯二胺)无致癌性和诱变性等弊端, 被广泛应用于分析检测领域[19, 20, 21]。 吖啶橙(AO, 结构式如示意图1)是一种应用广泛的芳香荧光染料[22, 23], 其吸收光谱与TMB在310 nm波长激发下的发射光谱有明显重叠, 其在545 nm处的荧光峰可以和400 nm处TMB的荧光峰完全分开, 在理论上为FRET体系的构建提供了可能。 随着TMB浓度的增大, TMB和AO的荧光强度均依次增强; 随着AO浓度的增大, AO荧光强度依次增强, 而TMB荧光强度依次减弱, 证明确实可用TMB和AO分别作为能量供体和能量受体建立FRET体系。 进一步研究发现, 当体系中存在LVF时, TMB荧光强度减弱, AO荧光强度增强, FRET能量转移效率明显增强, 并且在一定范围内, 546 nm处的荧光强度与402 nm处的荧光强度之比(F546 nm/F402 nm)与LVF浓度之间存在良好的线性关系。 在此基础上, 提出了一种简单、 灵敏、 选择性好的LVF检测方法, 并用于盐酸左氧氟沙星滴眼液、 盐酸左氧氟沙星胶囊、 盐酸左氧氟沙星片3种药物制剂中LVF含量的分析测定, 结果较满意。
5.0 mmol· L-1TMB储备液: 准确称取0.060 0 g TMB于50 mL容量瓶中, 溶于25 mL无水乙醇, 用超纯水定容。 0.10 mmol· L-1TMB工作液: 准确移取1.0 mL TMB储备液至50 mL容量瓶中, 先加入25 mL无水乙醇, 再用超纯水定容。 pH 5.0 NaAc-HCl缓冲液: 0.20 mol· L-1 NaAc和0.10 mol· L-1 HCl在pH计上配制而成。 LVF工作液: 0.20 mmol· L-1。 AO(分子式: C17H20ClN3· 1/2ZnCl2)储备液: 1.0 mmol· L-1。 AO工作液: 0.50 mmol· L-1。 除LVF为标准品外, 实验所用试剂均为分析纯(AR), 实验用水均为超纯(UP)水(18.25 MΩ cm 25 ℃)。 盐酸左氧氟沙星胶囊、 盐酸左氧氟沙星片、 盐酸左氧氟沙星滴眼液均购自内江某药店。
用F-4600型的荧光分光光度计(日本日立)扫描并记录样品的荧光光谱, 测定参数: 激发狭缝为2.5 nm, 发射狭缝为5 nm, 光电倍增管(PMT)电压为700 V。 采用U-3010型的紫外可见分光光度计(日本日立)扫描并记录样品的紫外吸收光谱。 用pHS-3E的pH计(上海仪电科学仪器股份有限公司)调节溶液的pH值。
1.2.1 FRET体系的构建
分别移取不同体积的TMB工作液(0~1.5 mL)于10 mL比色管中, 依次加入1.0 mL pH 5.0NaAc-HCl缓冲液和0.80 mL AO工作液, 定容至5 mL, 摇匀, 在室温下静置7 min。 待体系反应完全后, 以310 nm为激发波长, 在荧光分光光度计上扫描并记录330~630 nm范围内的荧光光谱。
依次移取1.0 mL TMB工作液和1.0 mL pH 5.0 NaAc-HCl缓冲液于10 mL比色管中, 分别加入不同体积(0~0.80 mL)的AO工作液, 定容至5 mL, 摇匀, 在室温下静置7 min。 在相同激发波长下, 用荧光分光光度计扫描并记录相同波长范围内的荧光光谱。
1.2.2 LVF的比率荧光传感器的构建
依次准确移取1.0 mL TMB工作液、 1.0 mL pH 5.0 NaAc-HCl缓冲液于10 mL比色管中, 向其中加入不同体积的LVF工作液, 随后加入0.80 mL AO工作液, 定容至5 mL, 摇匀, 室温下静置反应9 min。 在310 nm激发波长下, 在荧光分光光度计上扫描并记录其330~630 nm范围内的荧光光谱。 计算402和546 nm处的荧光强度比值F546 nm/F402 nm, 以F546 nm/F402 nm为纵坐标, LVF浓度为横坐标, 绘制工作曲线。
1.2.3 样品的处理与分析
盐酸左氧氟沙星滴眼液: 5 mL· 支-1, 含LVF(以C18H20FN3O4计)15 mg, 即3 mg· mL-1。 使用时移取1.2 mL, 用超纯水定容至50 mL, 稀释至与LVF工作液相当的浓度。
盐酸左氧氟沙星胶囊: 20粒· 盒-1, 0.1 g· 粒-1(以C18H20FN3O4计)。 参照参考文献[24, 25], 随机取5粒胶囊, 用研钵将其中的粉末研细。 称取适量粉末, 约含LVF 0.1 g, 用适量0.1 mol· L-1 HCl溶解, 定容100 mL。 用0.22 μm的针头过滤器过滤, 用超纯水稀释至与LVF工作液相当的浓度。
盐酸左氧氟沙星片剂: 10片· 盒-1, 0.2 g· 片-1(以C18H20FN3O4计)。 处理方法与盐酸左氧氟沙星胶囊相同。
准确移取各样品溶液0.70 mL, 按1.2.2的方法测定LVF含量, 并做加标回收实验。
TMB的荧光光谱和AO的吸收光谱有相当程度的重叠, 且TMB的荧光峰和AO的荧光峰可以明显分开[图1(a)], 说明TMB和AO之间理论上可以发生FRET。 进一步研究发现, 在pH 5.0 NaAc-HCl缓冲溶液中, 保持TMB浓度不变, 以310 nm的波长激发, 增加AO浓度, AO荧光强度依次增加, TMB荧光强度则依次降低[图1(b)]。 在相同实验条件下, 保持AO浓度不变, 增加TMB浓度, TMB和AO的荧光强度均依次增大[图1(c)]。 这充分证明了能量供体TMB和能量受体AO之间可以建立FRET体系。 为了得到较强的FRET效率, 选择80 μmol· L-1 AO和20 μmol· L-1 TMB构建FRET体系。
以溶解在0.1 mol· L-1 NaOH中的荧光素(荧光量子产率为0.91)[26]为标准物质, 用origin做图求斜率[图2(a)], 再根据式(1)进行计算, 得TMB的荧光量子产率23.6%。
式(1)中, φ 为TMB的荧光量子产率; φ s为荧光素的荧光量子产率; As为荧光素在激发波长490 nm下的荧光积分面积, 积分范围为470~650 nm; Ax为TMB在激发波长310 nm下的荧光积分面积, 积分范围为330~530 nm; Ix为TMB在310 nm波长处的吸光强度; Is为荧光素在490 nm波长下的吸光强度; n为溶剂折射率, 在水中nx=
根据能量转移理论, 通过如式(2)— 式(5)计算供体-受体之间距离
式中, F(λ )为供体在λ 处的荧光强度, ε (λ )为受体在处的摩尔吸收系数, J即表示供体荧光光谱和受体吸收光谱之间重叠部分的积分面积; K2为偶极空间取向因子, 因为能量供体和受体的空间分布可以被认为是随机且均等的, 故取2/3; N取水和有机溶剂平均折射率1.37; φ 为供体的荧光量子产率; R0表示E=50%时, 供体和受体之间的距离; r是供体和受体之间的能量转移距离; F表示加入受体后供体的荧光强度, F0表示不加入受体时供体的荧光强度, E表示能量转移效率[28, 29]。 计算结果为: J=4.48× 10-15 cm3· L· mol-1, R0=2.37 nm, E=62.5%, r=2.17 nm。 R0和r均小于7 nm, 进一步表明TMB和AO之间确实能发生FRET。
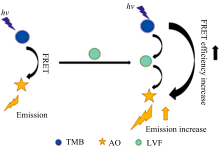
当体系中加入适量LVF后, TMB荧光强度降低, AO荧光强度增加, 体系的FRET效率明显增大[图2(b)], 且AO在546 nm处的荧光强度和TMB在402 nm处的荧光强度之比F546 nm/F402 nm与LVF浓度之间存在线性关系。 由此可以建立一种测定LVF含量的新型比率型荧光传感器。
在酸性介质中, TMB中氨基质子化而带正电荷, 且AO和LVF均以阳离子形式存在, 故三者之间不易发生静电作用, 且各有机分子也不易发生化学反应。 LVF的吸收光谱和TMB的荧光光谱在350~400 nm之间有相当程度重叠[图1(a)], 固定TMB的浓度, 增加LVF的浓度, TMB的荧光依次减弱, LVF的荧光依次增强[图3(a)]; 固定LVF的浓度, 增加TMB的浓度, TMB和LVF的荧光皆依次增强[图3(b)], 说明供体TMB和受体LVF之间发生了FRET。 此外, AO的吸收光谱和LVF的荧光光谱在450~550 nm之间有相当程度重叠[图1(a)], 固定AO的浓度, 增加LVF的浓度, LVF和AO的荧光均依次增加[图3(c)]; 固定LVF的浓度, 增加AO的浓度, LVF的荧光依次减弱, AO的荧光则依次增强[图3(d)], 说明LVF作为供体将荧光能量转移给受体AO。 由此说明, LVF在TMB和AO间起桥梁作用, 其将吸收的TMB的荧光能量转移给AO, 从而提高了体系的FRET效率, 故可根据TMB和AO荧光强度比值建立测定LVF含量的比率型荧光传感器。 体系的荧光共振能量转移的机理如示意图2。
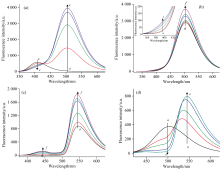 | 图3 LVF浓度(a); TMB浓度(b); LVF浓度(c)和AO浓度(d)对FRET体系的影响Fig.3 (a) Effect of LVF concentration; (b) TMB concentration; (c) AO concentration; (d) FRET system |
2.6.1 缓冲介质及酸度的选择
pH对TMB的荧光强度影响较大, 在酸性条件下TMB荧光较强, 碱性条件下荧光减弱甚至趋于0, 故考察了不同缓冲介质及酸度对FRET体系的影响。 分别比较了5种不同的缓冲溶液(PBS、 Tris-HCl、 B-R、 NaAc-HCl、 NaAc-HAc)对LVF比率荧光传感器的灵敏度和线性关系的影响, 结果表明, 在NaAc-HCl缓冲溶液中, 传感器的线性范围最宽、 灵敏度和线性关系最好, 故选择NaAc-HCl缓冲溶液作为介质。 研究了不同pH值对体系灵敏度的影响, 结果表明, 在NaAc-HCl缓冲溶液中, 当pH 5.0或5.5时, 体系的灵敏度都比较好, 如图4(a)所示。 而pH 5.0时, 体系的线性关系更好、 线性范围更宽[图4(b), (c)], 故选择pH 5.0的缓冲溶液。 研究了缓冲溶液不同用量对体系灵敏度的影响, 缓冲溶液的用量对体系影响不大, 综合考虑体系灵敏度和样品溶液体积, 选择1.0 mL缓冲溶液最适宜。 故选择1.0 mL pH 5.0的NaAc-HCl缓冲溶液作为反应介质。
 | 图4 (a) pH值及pH 5.0 (b)和pH 5.5(c)的缓冲介质对FRET体系的影响Fig.4 (a) Effect of pH value on FRET systems (b) pH 5.5 (c) on FRET systems |
2.6.2 稳定性
在最优实验条件下, 探究了反应时间对荧光共振能量转移体系的影响。 结果表明, 当反应时间达到7 min时, 体系基本反应完全, 连续扫描1 h, 体系的荧光强度基本不变, 说明该体系较稳定[图5(a)]。 为使反应充分进行, 选择反应时间为9 min。
在优化实验条件下, 以LVF浓度(mmol· L-1)为横坐标, F546 nm/F402 nm为纵坐标绘制工作曲线。 如图5(b), 当LVF浓度在2~80 μmol· L-1范围内, 体系的F546 nm/F402 nm与LVF浓度之间存在良好的线性关系。 其线性回归方程为F546 nm/F402 nm=87.92c+3.108, 相关系数R为0.999 3, 检出限为15.7 nmol· L-1(3s/k, s为11次空白平行样的标准偏差, k为线性回归方程的斜率)。 与文献已报道的分析方法相比(表1), 本研究设计的比率型荧光探针具有灵敏度高、 选择性好等特点。
| 表1 不同方法检测LVF的性能比较 Table 1 Comparison of different methods for detection of LVF |
在最优条件下, 考察了该比率型荧光传感器对测定40μmol· L-1 LVF的选择性。 如图6所示, 1.0 mmol· L-1
按照1.2.3方法分别对盐酸左氧氟沙星胶囊、 盐酸左氧氟沙星片、 盐酸左氧氟沙星滴眼液3种商业LVF药物制剂进行处理, 得到3种不同的样品溶液。 准确移取一定量的不同样品溶液, 按照1.2.2对其中的LVF含量分析测定, 并进行加标回收实验。 结果表明, 3种样品的回收率均在93%~97%之间, RSD%均小于5%, 且3种样品中LVF含量的测定值与实际药品的标示值基本吻合, 说明基于TMB和AO间FRET体系的比率型荧光探针用于实际药品中LVF含量的测定, 方法可靠。 分析结果如表2所示。
| 表2 样品分析结果(n=5) Table 2 Sample analysis results (n=5) |
基于能量供体TMB和能量受体AO之间FRET效应, 设计开发了一种新型的高灵敏检测LVF的比率型荧光探针。 该比率型荧光探针具有单波长激发的双发射带, 可以消除环境影响, 提高分析结果的准确性和方法的选择性。 在最优条件下, 对LVF的线性检测范围为2~80 μmol· L-1, 检出限为15.7 nmol· L-1。 该方法操作简单、 快速、 选择性好、 灵敏度高, 分析结果可靠, 直接用于商用药物制剂中LVF含量的检测, 为新型比率型荧光传感器的设计与应用提供了研究参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|