作者简介: 杨 平, 1998年生, 南昌大学食品学院硕士研究生 e-mail: 1585451609@qq.com
糖基化反应能诱导食品中蛋白质的结构发生改变; Ara h2是花生中的主要蛋白组分之一, 可以作为一种模式蛋白研究花生蛋白糖基化产物的结构变化。 不同还原糖对Ara h2糖基化反应的影响目前未见相关报道。 以花生蛋白Ara h2为研究对象, 通过SDS-PAGE、 内源荧光、 同步荧光、 紫外、 圆二色谱、 红外等光谱技术研究Ara h2糖基化前后分子量、 二级、 三级结构以及官能团的变化, 分析六种还原糖(核糖、 木糖、 半乳糖、 葡萄糖、 果糖、 乳糖)对花生蛋白Ara h2糖基化产物结构的影响, 阐明经不同还原糖修饰后花生蛋白Ara h2的结构变化。 SDS-PAGE电泳表明木糖和核糖修饰的花生蛋白Ara h2电泳条带明显上移, 糖基化程度最大; 紫外光谱分析表明糖基化反应会改变花生蛋白Ara h2的吸收峰强度。 五碳糖修饰的花生蛋白Ara h2具有最强的吸收强度, 其中五碳糖中木糖的吸收峰强度最大; 内源荧光、 同步荧光和三维光谱实验结果表明, 糖基化修饰会使花生蛋白Ara h2的荧光强度降低, 且五碳糖修饰的Ara h2荧光强度最低。 分析认为由于糖基化修饰使花生蛋白Ara h2的结构展开, 导致芳香族氨基酸暴露在水环境中, 从而引起荧光猝灭; 圆二色谱分析表明不同还原糖修饰的Ara h2糖基化产物α-螺旋含量都增加, 其中木糖修饰的α-螺旋含量最大(15.6%); 红外光谱分析表明木糖和核糖修饰的花生蛋白Ara h2的吸收峰分别从3 327.41 cm-1红移至3 318.43和3 321.09 cm-1, 1 700~1 600 cm-1处木糖和核糖修饰的花生蛋白Ara h2吸收峰强度略高于其他还原糖修饰的该蛋白。 不同还原糖对Ara h2糖基化反应后的糖基化产物结构的影响不同, 还原糖的碳链越短、 空间位阻越小, 糖基化反应程度越高, 对Ara h2的结构影响越大。
Glycation reaction can induce the structural change of protein in food stuff; Ara h2 is one of the main proteins in peanuts, and it can be used as a model protein to study the structural change of the glycation products of peanut protein. However, the effects of different reducing sugars on Ara h2 glycation have not been reported. Therefore, this article took Ara h2 as the research object to study the changes in the molecular weight, the secondary and tertiary structure and the functional groups of Ara h2 before and after glycation by SDS-PAGE, endogenous fluorescence, synchronous fluorescence, ultraviolet spectrum, circular dichroism, Fourier transform infrared spectroscopy and other spectroscopic techniques. The effects of six reducing sugars (ribose, xylose, galactose, glucose, fructose and lactose) on Ara h2 were analyzed to clarify the structural change of different Ara h2 glycation products. The results of SDS-PAGE showed that these electrophoretic bands of Ara h2 modified by xylose and ribose moved up significantly, and their glycation degree was the largest, compared with other reducing sugars. Ultraviolet spectrum analysis showed that glycation reaction would change the absorption peak intensity of Ara h2, and modification with pentoses had the strongest absorption intensity (absorption peak intensity of xylose was the largest). The results of endogenous fluorescence, synchronous fluorescence and three-dimensional spectral scanning showed that glycation reduced the fluorescence intensity of Ara h2 and pentose modified Ara h2 had the lowest fluorescence intensity. It might be due to the structural unfolding of Ara h2 caused by glycation, which exposes aromatic amino acids to the water environment and leads to fluorescence quenching. Circular dichroism analysis showed that the content of α-helix increased after Ara h2 was modified by different reducing sugars, among which modified by xylose showed the highest helix content (15.6%). Fourier transform infrared spectroscopy showed that the absorption peaks of Ara h2 (modified by xylose and ribose) shifted from 3 327.41 to 3 318.43 and 3 321.09 cm-1, respectively; At 1 700~1 600 cm-1, the absorption peak intensity of Ara h2 modified by xylose and ribose was slightly higher than that modified by other reducing sugars. Therefore, different reducing sugars have different effects on the structure of Ara h2 glycation products; The shorter carbon chain and the less steric hindrance of reducing sugars led to a higher glycation degree and a greater impact on the structure of Ara h2.
糖基化反应也称美拉德反应, 是通过蛋白质中的氨基与还原糖的羰基缩合反应引起的非酶促褐变, 通常可分为三个阶段: 早期阶段、 中期阶段、 末期阶段。 糖基化反应在人类健康和食品安全方面存在两面性, 一方面, 糖基化反应会产生羟甲基糠醛、 羧甲基赖氨酸(CML)、 类黑精等有害物质, 可能会引起糖尿病、 老年痴呆症等症状[1]; 另一方面, 糖基化反应会产生芳香性物质和具有抗氧化等活性的中间产物, 在食品品质提升和保存方面具有一定作用。 因此糖基化反应是医学、 食品、 营养、 材料等领域关注的焦点和热点[2, 3]。 还原糖的种类是影响蛋白质糖基化反应的主要因素之一, 有研究通过荧光光谱和紫外光谱等方法研究了半乳糖、 葡萄糖及果糖对卵清蛋白糖基化产物理化和构象性质的影响, 发现结构变化在卵清蛋白的致敏性变化中起着主要作用[4]; Yuan等[5]采用圆二光谱和荧光光谱分析了转谷酰胺酶催化原肌球蛋白(TM)糖基化后二级结构和三级结构的变化。 可以通过紫外、 圆二、 内源荧光等光谱技术来研究蛋白质在糖基化反应过程中的结构变化。
花生含有蛋白质、 维生素、 碳水化合物、 脂肪酸、 硫胺素等丰富营养素以及白藜芦醇、 酚酸、 类黄酮等化合物[6, 7], 食用花生可以降低肥胖、 高血压、 癌症和炎症的发病率[8]。 具有持水性、 乳化性等功能性质的花生蛋白是食品加工中主要食品原料之一。 在加工过程中, 花生蛋白易与还原糖发生糖基化反应产生芳香性物质, 且促进花生蛋白的糖基化修饰, 可以显著降低花生蛋白在加工过程中的致敏性[9]。 研究显示, 每天食用花生、 花生酱、 花生油等食品可以为人体补充营养和降低心脏病发生的风险[10]。 花生蛋白因具有独特的风味、 色泽和营养价值在食品工业中被广泛应用[11]。 国外通常将花生加工成烘焙类的食品, 糖基化反应又能诱导这类食品中蛋白质颜色、 风味、 功能性、 营养价值等的改变[12], 使其深受欢迎。 然而不同还原糖对花生蛋白Ara h2糖基化反应的结构影响目前未见相关报道。 Ara h2是花生中的主要蛋白组分, 占总蛋白的6%~9%, 相对分子质量在17~20 kDa之间, 含有5个α -螺旋和4个二硫键[13], 其可以作为一种模式蛋白研究花生蛋白糖基化产物的结构变化与糖基化程度之间的关系。
糖基化产物结构的变化可以通过分子量、 荧光强度等来评估[14], 本研究基于红外、 内源荧光、 圆二色谱等光谱技术对Ara h2糖基化产物进行结构分析, 来探索不同还原糖修饰后Ara h2的结构变化情况, 为研究Ara h2糖基化产物结构变化及其理化性质奠定理论基础。
Ara h2(实验室自提), D-木糖、 D-核糖、 D-半乳糖、 D-葡萄糖、 D-果糖、 D-乳糖均购自Sigma化学试剂公司; 其他试剂均为国产分析纯。
U-2910紫外分光光度计, 日本HITACHI公司; F-7000荧光光谱仪, 日本HITACHI公司; Bio-Logic MOS 450 圆二色谱仪, 法国Bio-Logic公司; Nicolet5700傅里叶红外光谱仪, 美国Thermo Nicolet公司; MTB Module电泳仪, 美国伯乐公司。
1.2.1 样品制备
(1)参照田阳等[15]的方法, 并稍作修改。 将脱脂花生粉与50 mmol· L-1的Tris-HCl浸提液(pH 7.2)以体积1∶ 5混合, 磁力搅拌150 min; 设置离心机参数为8 000 r· min-1, 4 ℃离心25 min, 离心结束后弃上清液; 该沉淀部分再用Tris-HCl浸提液(pH 7.2)以1∶ 5的比例混合磁力搅拌2 h; 离心机参数设置为10 000 r· min-1, 4 ℃离心15 min, 收集上清液; 在上清液中加入(NH4)2SO4至饱和度为40%; 静置45 min后10 000 r· min-1离心15 min, 收集上清液; 用0.45 μ m过滤膜过滤并将pH调到5.2; 透析完再用0.45 μ m膜过滤, 冷冻干燥后即得到花生蛋白Ara h2。
(2)将自提的Ara h2(浓度1 mg· mL-1)与六种还原糖(木糖、 核糖、 半乳糖、 葡萄糖、 果糖、 乳糖)各按1∶ 1的质量比混合并用超纯水溶解, 分别记作Ara h2-Xyl, Ara h2-Rib, Ara h2-Gal, Ara h2-Glu, Ara h2-Fru, Ara h2-Lac。 将未添加还原糖但在相同条件下加热的Ara h2, 记为Ara h2-H; 天然Ara h2蛋白作为对照样品。 所有样品分别置于10 mL离心管中, 再冷冻干燥。
(3)将冷冻干燥后的样品置于80 ℃含有饱和NaCl溶液的干燥皿内(相对湿度65%)反应1 h, 冰浴终止反应。 对不同还原糖修饰后的花生蛋白Ara h2进行红外、 圆二、 荧光、 紫外等光谱学分析。
1.2.2 SDS-PAGE电泳
采用12%分离胶和5%浓缩胶制胶, 样品质量浓度为1 mg· mL-1, 上样量为10 μ L, 电压采用110 V, 考马斯亮蓝R250染色15 min, 脱色至背景清晰后拍照保存。
1.2.3 紫外光谱分析
将样品溶解并稀释至1 mg· mL-1, 用紫外光谱仪扫描。 波长范围为230~400 nm, 扫描速度为200 nm· min-1, 狭缝宽度为2 nm。
1.2.4 荧光光谱分析
将样品溶解并稀释至1 mg· mL-1, 采用荧光光谱仪分别进行内源、 同步和三维荧光分析。 内源荧光分析的参数为Ex: 289 nm; Em: 200~400 nm; 扫描速率为1 200 nm· min-1; 狭缝宽度为5 nm。 同步荧光分析的参数为Ex: 289 nm; Em: 200~400 nm; 扫描速率为1 200 nm· min-1; 狭缝宽度为5 nm。 三维荧光分析的参数为Ex: 200~800 nm; Em: 200~800 nm; 扫描速率为12 000 nm· min-1; 狭缝宽度为5 nm。
1.2.5 圆二色谱分析
参照Divsalar等[16]的方法, 将样品溶解并稀释至0.5 mg· mL-1, 样品池的光径为0.1 cm, 波长扫描范围为190~250 nm。
1.2.6 红外光谱分析
分别称取1 mg的样品冻干粉和100 mg的溴化钾放入研钵中, 在日光灯下研磨混合均匀后将样品粉末压制成片, 压好后的样品薄片置于傅里叶红外光谱仪检测台, 进行全波段扫描, 扫描次数为32次。
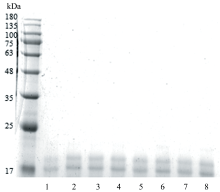
蛋白质中氨基与还原糖的羰基通过缩合使还原糖分子通过共价键结合到蛋白质分子上, 从而使蛋白质分子量增大。 采用SDS-PAGE电泳分析不同还原糖对花生蛋白Ara h2分子量的影响。 结果如图1所示, 样品Ara h2-H的条带与对照样品Ara h2相同, 基本未发生变化, 分析认为由于Ara h2的热稳定性较高, 未发生降解或聚集[17]。 相比于Ara h2和Ara h2-H, 糖基化后的样品电泳条带发生上移, 表明Ara h2发生了糖基化介导的共价键反应使其分子量增大, 其中Ara h2-Xyl、 Ara h2-Rib上移的程度最大, 说明木糖和核糖与Ara h2糖基化反应的程度最大。 分析认为与糖类的分子结构有关, 五碳糖较六碳糖和二糖具有较大张力的环状和链状结构[18]; 空间位阻也起着关键作用, 碳链越短的还原糖, 空间位阻越少, 与Ara h2反应的程度越强烈。
蛋白质在近紫外区的吸收强度主要受酪氨酸、 色氨酸和苯丙氨酸这些芳香族氨基酸残基的影响[19], 且色氨酸的紫外吸收峰位于280 nm左右。 一般可通过紫外光谱分析样品的含量、 物质组成和构象结构的变化情况。 Ara h2与不同还原糖反应后的糖基化产物的紫外光谱如图2所示, 其中Ara h2-Xyl, Ara h2-Rib和Ara h2-Gal的紫外吸收强度比对照样品Ara h2高, 分析认为它们的糖基化反应程度较高, 产生了新物质; 另一个原因可能是糖基化会诱导Ara h2分子结构发生“ 去折叠” , 使芳香族氨基酸等残基暴露。 然而有趣的是, Ara h2与果糖、 葡萄糖、 乳糖反应后, 紫外吸收峰降低, 这可能是由于这三种还原糖仅仅与Ara h2外部氨基酸发生反应, 其次大量的发色基团被还原糖包裹, 发色基团被屏蔽导致吸收峰强度降低[20]。 从紫外吸收光谱图可以看出: 五碳糖具有最强的吸收强度, 其中五碳糖中木糖的吸光值最大, 说明糖基化反应会改变花生蛋白Ara h2的结构。
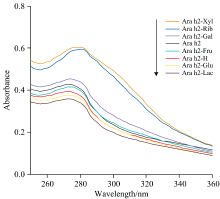 | 图2 不同还原糖修饰的花生蛋白Ara h2的紫外扫描光谱Fig.2 Ultraviolet scanning spectra of peanut protein Ara h2 modified with different reducing sugars |
2.3.1 内源荧光光谱
Ara h2的内源荧光主要与芳香族残基、 色氨酸(Trp)、 酪氨酸(Tyr)、 苯丙氨酸(phe)等周围分子微环境及其特定的相互作用密切相关[21], 且色氨酸(Trp)在287 nm附近的荧光强度较大。 色氨酸的荧光强度可用来表征蛋白质结构的变化情况。 如图3所示, 当激发波长为289 nm时, Ara h2的最大荧光峰波长在294 nm处。 与Ara h2相比, Ara h2-Xyl, Ara h2-Rib, Ara h2-Glu, Ara h2-Gal, Ara h2-Fru, Ara h2-Lac和Ara h2-H的荧光强度均降低, 最大荧光发射强度从1 466(Ara h2)降低到1 426(Ara h2-Glu), 1 390(Ara h2-Lac), 1 386(Ara h2-H), 797.4(Ara h2-Fru), 796.4(Ara h2-Gal), 513.5(Ara h2-Rib)和473(Ara h2-Xyl), 同时经过不同还原糖修饰后的Ara h2荧光波长未发生改变。 结果表明糖基化反应可能导致色氨酸暴露在亲水的环境中, 使花生蛋白Ara h2色氨酸残基周围的微环境发生改变; 也有可能是由于色氨酸残基被糖分子包裹的空间位阻效应引起[22]。 另外, Ara h2-Xyl和Ara h2-Rib的荧光强度明显降低, 表明五碳糖与Ara h2结合时, 对蛋白质构象变化的影响更大, 且与核糖相比, 木糖和Ara h2的糖基化反应使荧光强度降低的程度更大。 与Ara h2-Glu和Ara h2-Fru相比, Ara h2-Gal的荧光强度最低, 表明半乳糖的共价结合对Ara h2的结构影响更大。 整体分析, 乳糖与Ara h2糖基化反应后, 对Ara h2结构的影响程度小于五碳糖(木糖和核糖)和六碳糖(半乳糖和果糖)。
 | 图3 不同还原糖修饰的花生蛋白Ara h2的内源荧光光谱Fig.3 Fluorescence spectra of peanut protein Ara h2 modified with different reducing sugars |
2.3.2 同步荧光光谱分析
同步荧光光谱是分析蛋白质残基周围微环境变化的光谱学技术, 可以准确区分Ara h2中的Tyr和Trp残基的荧光光谱。 通过固定15和60 nm的发射和激发波长差值来表示Ara h2中Tyr和Trp残基的变化。 如图4所示, 与Ara h2相比, Ara h2-H, Ara h2-Rib, Ara h2-Xyl, Ara h2-Glu, Ara h2-Gal, Ara h2-Fru和Ara h2-Lac的荧光强度均有所降低, 这与内源荧光强度下降的趋势几乎一致。 Ara h2-Rib的Trp出现了轻微的蓝移(287~286 nm), 可能与色氨酸残基周围的极性有关。 与核糖相比, 其他还原糖修饰的糖基化产物最大发射峰没有蓝移或红移, 分析认为Ara h2结构在逐渐展开过程中, Ara h2基质被溶剂渗透并与Trp相互作用。 随着不同还原糖的接入, Ara h2的荧光强度也有不同程度的降低。 实验现象表明糖基化反应改变了Ara h2分子中Tyr和Trp在微环境中的构象, 导致Tyr和Trp残基的荧光猝灭, 从而使其荧光强度降低; 同时也表明还原糖的类型对荧光强度有很大的影响。 同步荧光光谱分析表明与六碳糖和二糖相比, 五碳糖修饰的Ara h2的构象和发色基团微环境发生相对剧烈的波动。
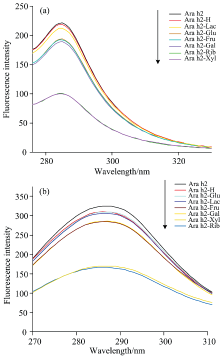 | 图4 不同还原糖修饰花生蛋白Ara h2的同步荧光光谱 (a): Δ λ =15 nm; (b): Δ λ =60 nmFig.4 Synchronous fluorescence spectra of peanut protein Ara h2 modified by different reducing sugars (a): Δ λ =15 nm; (b): Δ λ =60 nm |
2.3.3 三维荧光光谱分析
三维荧光是用不同的激发波长去激发荧光物质, 其激发波长、 发射波长和荧光强度与蛋白质微环境的改变具有很强的相关性, 可用于研究蛋白质的三维结构变化。 采用三维荧光探究花生蛋白Ara h2糖基化产物的结构变化, 等高线分别显示了Ara h2样品的激发波长、 发射波长和荧光强度, 同时荧光峰主要揭示的是Ara h2中Tyr和Trp残基的光谱特性。 如图5和表1所示, 三维荧光均具有一个典型的荧光峰。 Ara h2在激发波长为280 nm时, 随着不同还原糖的加入, Ara h2的荧光峰强度出现了不同程度的降低, 其中, Ara h2-Xyl和Ara h2-Rib下降的最明显且Ara h2-Xyl降低的程度最大, 荧光峰强度从266.6分别下降到126.1和126.2。 分析认为还原糖的共价结合使得Ara h2分子内部微环境变化, 亲水性增加, 猝灭了荧光。 木糖和核糖作为五碳糖, 相较于六碳糖和二糖碳链较短, 糖基化反应程度较高, 对Ara h2的结构影响最大。 这与内源、 同步荧光的结果一致。
 | 图5 不同还原糖修饰花生蛋白Ara h2的三维荧光光谱图Fig.5 3D fluorescence spectra of peanut protein Ara h2 modified by different reducing sugars |
| 表1 典型的三维荧光峰 Table 1 Main three-dimensional fluorescence peaks |
Ara h2各样品的圆二光谱如图6和表2所示, 未经任何处理的Ara h2是由10.7%的α -螺旋、 36.0%的β -折叠、 21.0%的β -转角、 32.2%的无规则卷曲组成。 Ara h2-H与Ara h2的圆二色谱结果基本一致, 在干燥状态下短时间内加热对Ara h2二级结构的影响不大, 分析认为水分活度低的情况下蛋白质的流动性有限导致。 α -螺旋的特有峰主要由190 nm处的正峰和208和222 nm处的两个负峰组成, Ara h2经糖基化后, Ara h2-Xyl, Ara h2-Rib, Ara h2-Gal, Ara h2-Glu, Ara h2-Fru, Ara h2-Lac的α -螺旋含量都增加, 其中Ara h2-Xyl中α -螺旋含量最大(15.6%), 然而Ara h2-Xyl和Ara h2-Rib之间并无显著性差异(p> 0.05)。 除Ara h2-Rib外, 其他Ara h2糖基化产物的β -折叠含量从36.0%(Ara h2)减少到32.5%(Ara h2-Xyl), 32.3%(Ara h2-Gal), 34.5%(Ara h2-Glu), 33.5%(Ara h2-Fru)和32.2%(Ara h2-Lac)。 值得注意的是Ara h2-Rib的无规则卷曲含量从32.2%(Ara h2)减少到29.5%, 与之前的研究结果相一致[23], 即糖基化反应程度越高, Ara h2的结构越稳定。 这就是Ara h2经不同还原糖糖基化修饰后其α -螺旋含量增加, β -折叠或无规则卷曲含量减少的原因。
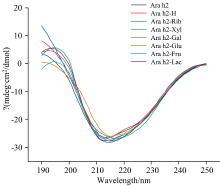 | 图6 不同还原糖修饰的花生蛋白Ara h2的圆二色谱图Fig.6 The circular dichroism of peanut protein Ara h2 modified by different reducing sugars |
| 表2 不同还原糖对花生蛋白Ara h2二级结构各组分含量的影响 Table 2 The influence of different reducing sugars on the content of each component of the secondary structure of peanut protein Ara h2 |
傅里叶红外光谱可用来研究蛋白质在加工过程中构象变化的情况。 酰胺Ⅰ 带、 酰胺Ⅱ 带、 酰胺Ⅲ 带对应的官能团, 如C=O和O— H等[24], 主要被用于分析蛋白质的构象变化。 蛋白质的主要谱带有酰胺A带(3 400~3 300 cm-1), 包含N— H伸缩振动峰; 酰胺Ⅰ 带(1 700~1 600 cm-1), 包含C=O的伸缩振动带; 酰胺Ⅱ 带(1 600~1 500 cm-1)和酰胺Ⅲ 带(1 600~1 500 cm-1), 包括C— N伸缩和N— H弯曲振动。 其中酰胺Ⅰ 带主要反映蛋白质的二级结构变化。 有研究表明1 100 nm处由于O— H和C— C键的伸缩振动会增大峰的波数, 这说明蛋白质和还原糖进行了糖基化反应。
天然的Ara h2及其糖基化样品的傅里叶红外光谱图如图7所示, Ara h2在3 400~3 300 cm-1的峰形较宽, 这与氢键的伸展和O— H基团的振动有关; 由表3可以看出, 该处Ara h2-Xyl和Ara h2-Rib的吸收峰从3 327.41 cm-1红移至3 318.43和3 321.09 cm-1(Ara h2-Xyl最低)。然而有趣的是, Ara h2-H、 六碳糖和二糖糖基化后的Ara h2, 其吸收峰出现了不同程度的蓝移, 分析认为Ara h2内生成了新的N— H键, 导致酰胺A带转向高波数段。 2 959 cm-1附近是C— H键的反对称伸缩振动峰, 加热和糖基化样品在该峰处有轻微的红移, 说明— CH2的振动受到糖基化影响较小。 1 700~1 600 cm-1为蛋白质C=O键的伸缩振动区域, 糖基化后的样品除了Ara h2-Glu均出现了轻微蓝移, 表明C=O附近电子云密度较高, 无规则卷曲中的氢键减少, 并且Ara h2-Xyl和Ara h2-Rib的吸收峰强度略高于Ara h2-Gal, Ara h2-Glu, Ara h2-Fru, Ara h2-Lac(Ara h2-Xyl峰强度最高), 分析认为五碳糖引起的糖基化程度尤其是木糖高于六碳糖和二糖, 导致引入了更多的羟基, 使氢键作用加强。
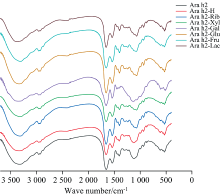 | 图7 不同还原糖修饰花生蛋白Ara h2的傅里叶变换红外光谱Fig.7 Infrared scanning spectra of peanut protein Ara h2 modified by different reducing sugars |
| 表3 不同还原糖修饰花生蛋白Ara h2主要的红外吸收峰 Table 3 The main infrared absorption peaks of peanut protein Ara h2 modified by different reducing sugars |
采用光谱技术研究不同还原糖(核糖、 木糖、 半乳糖、 葡萄糖、 果糖、 乳糖)修饰后Ara h2的结构改变, 得出以下结论:
(1) 通过SDS-PAGE可以看出, 还原糖的种类影响糖基化反应程度, 其中, 木糖和核糖修饰的Ara h2糖基化程度最显著。
(2) 通过紫外光谱分析, 木糖、 核糖、 半乳糖修饰的Ara h2产生了较多的糖基化产物, 导致紫外吸收增强, 其中Ara h2与木糖反应后的紫外吸光度提高程度最大。
(3) 通过内源荧光和同步荧光分析发现, 六种还原糖的加入会使Ara h2分子发生糖基化反应, 导致其糖基化产物荧光强度降低, 其中Ara h2与五碳糖反应后的荧光强度降低程度最大。
(4) 通过圆二色谱分析发现, Ara h2经不同还原糖糖基化修饰后, α -螺旋含量都增加; 除核糖外, 其他还原糖修饰的Ara h2其β -折叠含量均降低; 核糖修饰的Ara h2其无规则卷曲含量减少。
(5) 通过红外光谱分析, 木糖和核糖与Ara h2反应后, 吸收峰从3 327.41 cm-1分别红移至3 318.43和3 321.09 cm-1, 木糖与Ara h2反应后红外吸收波数最低。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|