作者简介: 阚玉娜, 女, 1996年生, 南京林业大学材料科学与工程学院博士研究生 e-mail: 1461390279@qq.com
木质纤维原料富含羟基, 可通过液化处理转化为具有较高反应活性的液态产物, 实现其高值化利用。 纤维原料的液化过程中存在降解和缩聚反应的竞争反应, 直接影响液化产物的特性。 为了研究枫香果实的液化反应过程, 以聚乙二醇和丙三醇(4∶1 V/V)为液化试剂, 对枫香果实进行不同时间(30, 60, 90, 120和150 min)的液化处理。 利用傅里叶红外光谱(FTIR)结合主成分分析(PCA)、 X射线衍射(XRD)分别对液化残渣和液化产物进行表征。 结果表明枫香果实的液化率随反应时间延长逐渐提升, 最高为88.79%。 基于液化率和羟值确定枫香果实的最佳液化时间为120 min, 此时液化率为87.91%, 液化产物的羟值为280 mg KOH·g-1。 FTIR和XRD分析表明液化反应初期以木质素和半纤维素的降解反应为主; 液化后期, 结晶纤维素开始降解, 同时伴随着缩聚反应的发生。 主成分分析发现, 不同液化时间得到的液化残渣的官能团分布相对独立, 可以作为判断枫香果实在液化过程中各组分降解的依据。 液化时间90 min为液化过程的转折点, 此时主导反应逐渐由降解转为缩聚反应。 此外, 为了探究枫香果实液化产物在聚氨酯泡沫应用上的可行性, 添加不同含量(10%, 20%和50%)的枫香果实液化产物成功制备得到了聚氨酯泡沫。 FTIR分析表明, 枫香果实的液化产物可代替多元醇制备聚氨酯泡沫, 且液化产物的添加并未改变聚氨酯泡沫的化学结构。 研究结果为进一步探究木质纤维资源的液化过程和枫香果实的液化利用提供了理论依据。
The conversion of lignocellulosic biomass with high content of hydroxyl groups to liquid substances with high reactivity through liquefaction was considered a promising route for realizing their high-value utilization. The competitive reaction of degradation and polycondensation in lignocellulosic biomass’s liquefaction process directly affects the liquefaction product’s characteristics. The liquefaction of Chinese Sweet Gum’s ( Liquidambar formosana) fruit was carried out at various times (30, 60, 90, 120, and 150 min) using polyethylene glycol and glycerin (4∶1 V/V) as liquefaction reagents to investigate the degradation and polycondensation reaction process in liquefaction. Fourier infrared spectroscopy (FTIR) combined with principal component analysis (PCA) and X-ray diffraction (XRD) were used to characterize the liquefied residues and liquefied products. The results showed that the liquefaction efficiency gradually increased with the extension of the reaction time, and the highest liquefaction efficiency was 88.79%. The optimal liquefaction time was 120 min when the liquefaction efficiency was 87.91%, and the hydroxyl value of the liquefied product was 280 mg KOH·g-1. FTIR and XRD analysis showed that lignin and hemicellulose were priority degraded at the initial stage of the liquefaction reaction. The crystalline cellulose began degrading at a later stage, accompanied by a polycondensation reaction. Principal component analysis results suggested that the distribution of functional groups of the liquefied residues obtained at different liquefaction times was relatively independent, which could be used as the basis for judging the degradation time of each component in the liquefaction process. Moreover, the polycondensation reaction gradually became dominant after 90 min of liquefaction. In addition, to explore the feasibility of liquefaction products as biomass polyols in the polyurethane foam field, polyurethane foams were successfully prepared by adding different contents of liquefaction products (10%, 20%, and 50%). FTIR showed that liquefaction products could replace polyols in the preparation of polyurethane foam, and the addition of liquefaction products did not change the chemical structure of polyurethane foam. The study would provide a theoretical basis for further exploring the liquefaction reaction of lignocellulosic resources and the liquefaction utilization of L. formosana fruit.
近年来, 随着能源短缺以及环境问题的日益加剧, 可再生、 可持续的生物质资源的转化和高效利用得到了广泛关注。 木质纤维原料是一种复杂的天然聚合物, 主要由纤维素(30%~35%)、 半纤维素(15%~35%)以及木质素(20%~35%)组成[1]。 这些组分含有大量羟基, 被认为是制备生物质基多元醇的潜在原料。 但木质纤维原料主要以固体形式存在, 受解剖构造复杂性和化学组分不均一性的影响, 具有较差的化学活性和溶解度, 难以直接利用[2]。 通过液化处理, 木质纤维原料可在高温高压或溶剂作用下转化为具有更多活性基团的小分子量液态产物, 可用于制备聚氨酯泡沫、 胶粘剂、 塑料等高分子材料[3]。
在液化反应中, 木质纤维原料的官能团与液化试剂间发生一系列复杂的羟基烷基化反应和溶解反应[4]。 研究认为, 纤维原料中各组分的降解、 酯化和缩聚是液化过程中发生的主要反应[5], 其中降解与缩聚间存在竞争反应。 当缩聚反应占主导时, 不溶性残渣比例增加, 导致原料液化效率降低。 左志越等[2]认为缩聚反应可能发生在纤维素降解产物和木质素的小分子降解产物之间, 抑或是在降解产物与自由酚离子间发生了亲核取代反应。 目前, 木质纤维原料的液化机理尚未理清, 主要通过优化液化反应的参数(如液化剂、 液化温度和时间等)来减轻或避免缩聚反应的影响, 其中液化时间被认为是影响液化产物性质的重要参数。 此外, 原料的化学组成和结构的复杂性也会影响液化反应过程, 从而影响液化产物的特性。 因此, 深入研究液化反应过程对于实现木质纤维原料的高效利用具有重要意义。
枫香(Liquidambar formosana Hance)是中国重要的乡土树种, 也是我国资源储量较大的速生树种, 蓄积量高达12.97亿m3。 枫香果实, 又称“ 路路通” , 是我国传统的中草药, 富含活性物质。 由于枫香的高蓄积量, 枫香果实的产量十分可观, 但未得到合理应用。 本研究选取聚乙二醇和丙三醇为液化试剂, 以反应时间为变量, 对枫香果实进行液化处理。 利用红外光谱、 X射线衍射、 主成分分析等方法分析枫香果实液化残渣和液化产物的特性, 探究枫香果实的液化反应过程。 此外, 利用枫香果实的液化产物制备聚氨酯泡沫, 以期为拓展枫香果实液化产物的高值化利用提供理论依据。
实验样品为枫香果实, 采集自南京林业大学校园。 通过机械粉碎后筛选粒径40~60目(0.25~0.45 mm)的果实粉末为实验原料, 并于60 ℃烘箱烘干备用。 液化处理所用试剂包括聚乙二醇(PEG400)、 丙三醇, 硫酸, 1, 4-二氧六环, 邻苯二甲酸酐, 吡啶, 咪唑等, 上述试剂皆为化学纯。 制备聚氨酯泡沫的主要原料为PEG400, 枫香果实的液化产物和聚异氰酸酯(PAPI, NCO=30%), 所用催化剂为三乙胺和二丁基二月硅酸锡, 皆为化学纯。 硅油和蒸馏水分别为表面活性剂和发泡剂。
1.2.1 枫香果实化学成分分析
根据国标GB/T 35816— 2018, 采用苯醇溶液(苯∶ 乙醇=2∶ 1 V/V)和蒸馏水对枫香果实样品分别进行苯醇抽提和热水抽提, 并对两种抽提物含量进行测定。
根据美国可再生新能源实验室(NREL)的方法, 对无抽提物的枫香果实进行酸解, 分析主要化学成分的相对含量。 木质素分为酸溶木质素和酸不溶木质素, 利用紫外-分光光度计(UV-1800)在205 nm波长测试酸解液的吸光度, 计算酸溶木质素含量。 酸不溶木质素的含量由酸解后的固体残渣质量计算得到。 原料中纤维素和半纤维素含量由酸解液中的单糖含量计算得到, 如式(1)和式(2)所示。 其中单糖含量通过高效液相色谱(HPLC, Agilent 1260 series, USA)测试得到。
$纤维素含量\%=\frac{{{c}_{\text{glu}}}\ \ \times 0.9\times V}{W}\times 100\%$(1)
$半纤维素含量\%=\frac{\left(\ \ \ \ {{c}_{\text{xyl}}}\ \ \ \ +\ \ \ \ {{c}_{\text{ara}}}\ \ \ \ \right)\times 0.88\times V}{W}\times 100\%$(2)
式(1)和式(2)中, cglu, cxyl和cara分别为酸解液中的葡聚糖、 木糖、 阿拉伯糖浓度, g· L-1; V为酸解液体积, L; W为原料质量, g。
1.2.2 液化处理
枫香果实液化处理在具有机械搅拌和回流冷凝装置的三颈烧瓶中进行, 反应过程如图1所示。 首先将液化试剂(PEG400∶ 丙三醇=4∶ 1 V/V)和催化剂(3 Wt%H2SO4)加入到烧瓶中。 在油浴锅中对反应体系进行加热, 当温度达到150 ℃时, 以1∶ 10的固液比加入枫香果实粉末进行反应。 液化反应的时间分别为30, 60, 90, 120和150 min, 反应结束后立即置于冷水浴中以终止反应。 采用80 Vt%的1, 4-二氧六环溶液溶解稀释反应产物, 并通过真空过滤得到液化残渣, 利用1, 4-二氧六环溶液将其洗涤至滤液呈无色。 将过滤得到的液化残渣放入105 ℃烘箱中烘干至恒重, 按式(3)和式(4)计算残渣率(R)和液化率(Y)。 之后, 将滤液转移到旋转蒸发器中, 通过旋蒸去除滤液中的溶剂, 获得液化产物。
式(3)和式(4)中: W为液化残渣的质量(g); W0为枫香果实原料的初始质量(g)。
1.2.3 液化残渣分析
利用Frontier FTIR衰减全反射红外光谱(PerkinElmer公司)对枫香果实和液化残渣的化学组成及官能团进行分析, 采用ATR模式。 测试条件: 扫描范围为4 000~450 cm-1, 分辨率为4 cm-1, 扫描次数为32次, 同一样品测试5次。 采用PerkinElmer Spectrum软件对红外光谱数据进行处理。
基于红外光谱数据, 采用R软件对枫香果实和液化残渣进行主成分分析(PCA)。 由主成分的累计贡献率, 绘制第一主成分(PC1)和第二主成分(PC2)得分图和载荷图, 构建PCA模型。 分析不同液化时间处理下液化残渣的聚类情况, 探究枫香果实的液化过程。
利用Ultima Ⅳ 组合型多功能水平X射线衍射仪对枫香样品和液化残渣的结晶度进行分析。 测试条件为: 扫描步长0.02° , 扫描范围5° ~40° , 管压40 kV, 管流30 mA。 采用Segal法计算相对结晶度。
$\text{CrI}(\%)=\frac{\ \ \ {{I}_{200}}\ \ \ -\ \ \ {{I}_{\text{am}}}\ \ \ }{{{I}_{200}}}\times 100\%$(5)
式(5)中: I200为200晶格峰的衍射强度, Iam为非结晶背景衍射的散射强度。
1.2.4 液化产物羟值分析
按照GB/T 12008.3— 2009测定液化产物的羟值。 取1 g液化产物于锥形瓶中, 加入25 mL邻苯二甲酸酐酰化试剂, 置于(115± 2) ℃油浴里回流30 min。 反应结束后, 将溶液定量转移到烧杯中, 采用0.5 mol· L-1 NaOH标准溶液滴定至终点, 按照式(6)计算羟值(OH), 单位为mgKOH· g-1。
式(6)中: V1为滴定液化产物消耗的NaOH体积, mL; V2为空白试验消耗的NaOH体积, mL; 56.1为KOH的摩尔质量, g· mol-1; m为液化产物的质量, g。
1.2.5 聚氨酯泡沫制备
以90 min的液化产物为原料, 在PEG400中添加不同含量(10%, 20%, 50%)的液化产物得到不同多元醇体系。 在多元醇体系中加入三乙胺、 二丁基二月硅酸锡、 硅油和蒸馏水。 混合均匀后, 按照式(7)计算在反应体系中加入异氰酸酯(PAPI)的质量(W), 使NCO/OH=1.2。 使用电动搅拌器对混合体系进行快速搅拌, 使其自由发泡, 于室温下熟化24 h得到泡沫材料。 根据液化产物添加量, 将泡沫材料分别命名为L1, L2, L3, 而不添加液化产物制备的对照聚氨酯泡沫为L0。
式(7)中, Wpeg, WL和
不同木质纤维素原料的化学组成和微观结构存在较大差异, 这些差异将进一步影响其液化行为[6]。 表1为枫香果实、 枫香木材及水稻秸秆的化学成分含量。 枫香果实的纤维素含量为30.50%, 低于枫香木材(46.58%)和水稻稻草(39.94%)等原料, 而木质素(28.01%)含量显著高于水稻稻草(14.89%)。 在液化反应中, 木质纤维原料各组分的降解速度: 半纤维素> 木质素> 纤维素[1]。 纤维素也被认为是液化过程中的限速因素。 因此, 较高的木质素含量和较低的纤维素含量, 使得枫香果实可能具有更高的液化速率。 此外, 原料中的纤维素和半纤维素结构上含有大量的羟基, 直接影响液化产物的羟值。 除了三大主要成分外, 原料中的抽提物和灰分含量对多元醇液化存在一定抑制作用[7]。 枫香球果的抽提物含量介于枫香木材和水稻稻草之间, 同时其灰分含量显著低于水稻稻草, 对液化反应的抑制作用较小。
| 表1 枫香果实的化学组分含量 Table 1 The chemical composition of the L. formosana fruit |
理想的液化反应需要平衡纤维原料化学组分的降解以及降解产物间的缩聚反应, 最大化实现纤维原料的液化。 以反应时间为变量, 通过液化率、 羟基等参数综合分析了枫香果实的液化过程。 液化率是直观判断木质纤维原料液化效果的重要指标[5]。 如图2所示, 反应初期, 随着反应时间的增加, 枫香果实的液化率显著提高。 在30 min液化后枫香果实的液化率便达到70.93%。 但随着液化时间的延长, 液化率的增长趋势逐渐缓慢, 当反应时间由120 min增加到150 min, 其液化率仅提高了0.88%。 随着反应时间的延长, 原料中的组分发生显著降解, 同时液化试剂与原料的接触更为充分, 进一步提高了液化率。 但反应后期, 当反应体系中降解的活性小分子浓度达到一定浓度, 缩聚反应增强并逐渐占据主导地位, 不利于液化率的提高。
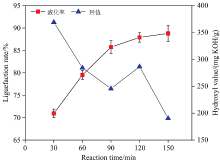 | 图2 不同液化反应时间枫香果实的液化率和羟值Fig.2 Liquefaction rate and hydroxyl value of L. formosana fruit at different reaction times |
羟值是衡量多元醇液化产物中羟基官能团含量的指标, 也是影响液化产物后续利用的重要参数[7]。 枫香果实液化产物的羟值随着反应时间的延长呈现下降的趋势, 如图2所示。 除液化120 min外, 液化产物的羟值与液化率存在一定的负相关关系。 在液化过程中, 降解产物上的羟基可能会发生氧化或者酯化、 醚化反应, 造成羟值的下降。 120 min液化得到的产物中羟值的提高, 可能是富含羟基的纤维素发生显著降解导致。 但随着时间的持续增加, 液化反应中的缩聚反应逐渐占据主导地位, 使得羟值大幅度下降。 综合考虑, 枫香果实的最佳液化时间为120 min, 此时液化产物的羟值为280 mg KOH· g-1, 符合制备硬质聚氨酯材料的羟基要求(200~550 mg KOH· g-1)[9]。
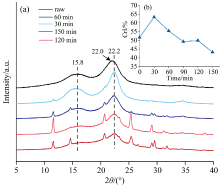
由液化残渣结晶度的变化对液化过程进行分析, 如图3所示。 枫香果实原料存在主峰(22.0° )和次峰(15.8° ), 与纤维Ⅰ 型的结晶结构相对应, 液化后残渣的主峰由22.0° 转移到22.2° 。 随着液化时间的延长, 液化残渣中主峰和次峰的峰强度逐渐下降, 反应150 min后残渣中的次峰几乎消失。 次峰的消失说明原料的晶体结构消散, 产生了无定形物质[10]。 此外, 在液化残渣的谱图中出现了新的衍射峰, 如11.58° , 20.68° 和25.38° 等, 说明残渣中有其他高分子化合物产生, 出现新的晶面[10]。 图3(b)为液化残渣在不同反应时间的结晶度变化。 液化反应30 min后, 液化残渣的结晶度由51.69%显著提高到63.32%。 因此, 在反应初期主要是半纤维素和木质素等无定形成分的降解。 随着液化时间的增加, 液化残渣的结晶度下降, 这表明在液化后期发生了结晶纤维素的降解以及小分子液化产物之间的缩聚, 进一步降低了残渣的结晶度。
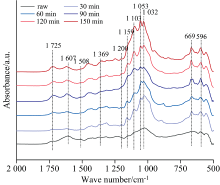
液化产物的化学成分在很大程度上依赖于液化条件, 特别是液化时间[2]。 通过红外光谱对液化残渣的化学结构进行表征, 间接探究枫香果实的液化反应过程, 如图4所示。 1 742~1 725 cm-1的吸收峰归属为乙酰基上的C=O伸缩振动, 该峰源于原料中的半纤维素组分[11]。 经过30 min的液化后, 该峰在液化残渣中的强度显著下降, 表明半纤维素在液化初期发生了显著降解。 在90~150 min的液化残渣中该峰左移至1 725 cm-1, 且吸收峰的强度逐渐增加。 1 725 cm-1处的吸收峰可能来源于与苯环相连的醛、 酮或酯基。 即在液化过程中, 半纤维素降解生成了更多的酯基或醛基化合物, 或是生成的醛基与木质素苯环形成了较为稳定的结构重新附着在液化残渣上[10]。 1 607和1 508 cm-1处的吸收峰归属于木质素的苯环骨架振动[11], 这两处吸收峰的强度随着液化时间的增加呈现先下降后增加的趋势。 与半纤维素一样, 木质素在反应初期即发生快速降解。 但随着液化的进行, 降解的小分子产物浓度的增加导致木质素等组分重新缩聚在残渣表面。 1 032和1 053 cm-1附近的吸收峰对应为纤维素的C6— OH伸缩、 C3— OH伸缩振动[10]。 由于液化试剂中具有C— O结构, 对液化残渣的红外光谱有一定影响。 在液化30~60 min时段, 该吸收峰的强度变化不明显, 在液化90 min时吸收峰强度发生明显下降。 在液化过程中, 半纤维素和木质素最先降解, 纤维素组分较为稳定。
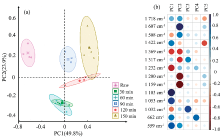
主成分分析是一种常用的数据降维方法, 可将多个原始变量综合为少数几个变量, 提高数据分析速率。 为了进一步分析枫香果实的液化反应与反应时间的关系, 基于红外光谱数据(2 000~1 000 cm-1)对枫香果实原料和液化残渣进行主成分分析。 图5为主成分得分图[图5(a)]和载荷图[图5(b)], PC1和PC2的累计贡献率为73.7%, 可代表原始数据中大部分的信息。 其中PC1的贡献率为49.8%, 对该模型的贡献率最高。 在主成分得分图中, 枫香果实原料主要聚集在PC1轴原点的负侧, 而液化残渣主要分布在PC1轴原点及正侧。 根据载荷图[图5(b)]中, 1 232和1 369 cm-1对PC1的负向贡献最大, 主要对应为半纤维素的特征峰, 而酯类、 醚类(1 103 cm-1)和纤维素的特征峰(1 053 cm-1)对PC1的正向贡献最大。 在液化过程中, 枫香果实中半纤维素组分降解较显著, 而纤维素组分最为稳定。 根据主成分得分图中各液化残渣的聚类情况, 可将液化过程分为三个时期。 (1)反应初期为液化30~60min, 此时样品主要分布在PC2轴原点的负轴上; (2)反应中期为液化90 min, 此时液化残渣分布在PC2轴原点的正轴上; (3)反应后期为液化120~150 min, 此时液化残渣主要分布在PC1轴原点的正侧。 在载荷图中, 1 718和1 607 cm-1对PC2的正轴贡献最大, 分别对应为醛、 酮或酯基以及苯环骨架振动的特征峰; 1 200和1 159 cm-1对PC2轴的负轴贡献最大, 对应为纤维素。 这说明液化反应前期残渣中纤维素含量较高, 而反应中后期纤维素含量显著下降, 在液化中期液化残渣中出现了醛、 酮或酯基和苯环结构。 因此, 在反应中期, 枫香果实中的纤维素降解加剧, 同时降解后的纤维素和木质素之间发生缩聚反应重新聚集在液化残渣上。 此外, 随着液化时间的延长, 反应后期的液化残渣逐渐向PC1正轴的右侧分布。 这可能是因为在反应后期液化残渣中的醛、 酯基和芳香化结构的含量提高, 缩聚反应逐渐占据液化反应中的主导地位。 通过PCA分析可以快速判断枫香果实等生物质原料在液化过程中各组分的降解时间。 本研究发现枫香果实在液化90 min后开始发生缩聚反应, 同时随着反应时间的延长, 缩聚反应逐渐占据主导地位。 传统方法主要通过液化率来判断液化反应中降解反应向缩聚反应进行的分界点[12]。 PCA分析表明在到达液化率的转折点前, 反应中的缩聚反应已占据主导地位。 通过对液化残渣的主成分分析可提高对液化过程的了解, 为改善液化反应条件提供一定理论依据。
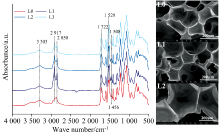
聚氨酯泡沫是由异氰酸酯和多元醇通过缩聚反应制备的高分子化合物[13]。 添加不同含量枫香果实液化产物制备聚氨酯泡沫, 对其化学结构和形貌进行分析以探究枫香果实液化产物的应用, 如图6所示。 聚氨酯基(— NH— COO— )是聚氨酯泡沫的特征基团, 主要包括三个特征峰: N— H(3 200~3 400 cm-1)、 酰胺Ⅱ 键(N— H变形振动)(1 530 cm-1)和酰胺Ⅰ 键(C=O)(1 720 cm-1)。 在液化产物制备的泡沫(L1, L2, L3)和对照样(L0)的谱图中, 三种特征峰的强度相近, 说明液化产物与异氰酸酯反应成功生成了聚氨酯。 2 917和2 850 cm-1对应为聚氨酯泡沫中的饱和C— H的伸缩振动峰, 随着枫香果实液化产物的增加, 这两处的吸收峰强度下降。 PEG结构中含有较多的CH2结构单元, 液化产物含量的增加导致反应体系中PEG含量的下降。 此外, 在L1中1 456 cm-1处的吸收峰强度增加, 这可能是因为液化产物中存在未反应完全的PEG和甘油。 1 508 cm-1对应为木质素的苯环振动峰, 随着液化产物添加量的增加, 聚氨酯泡沫中此峰的强度增加[14]。 扫描电镜图发现, 液化产物添加量的增加, 使得泡沫平均孔径增大, 尺寸变得不均一。 液化产物的添加对于聚氨酯泡沫化学结构影响较小, 利用枫香果实液化产物制备聚氨酯泡沫是可行的, 但过高的添加量对其形貌结构影响较大。
以时间为变量, 研究了枫香果实在PEG400和丙三醇液化体系中的液化行为和液化产物性能。 研究结果表明枫香果实的液化效率和羟值与液化时间密切相关, 最佳液化时间为120 min, 此时液化产物得率高达87.91%, 液化产物羟值为280 mg KOH· g-1。 通过红外光谱分析发现液化初期主要为半纤维素和木质素的降解, 后期纤维素发生降解, 并伴随着小分子产物之间的缩聚。 基于红外光谱数据的主成分分析表明, 枫香果实液化反应90min后开始发生缩聚反应。 结合红外光谱和主成分分析可实现对木质纤维原料液化过程分段反应的基本判断, 这为研究木质纤维原料的液化机理及对液化产物的分类利用提供一定的理论基础。
为了探究液化产物作为多元醇的应用潜力, 添加枫香果实的液化产物代替多元醇成功制备了聚氨酯泡沫, 红外分析表明液化产物的添加未改变聚氨酯泡沫的结构。 由于液化产物与传统多元醇有一定的性质差异, 需要进一步探索适合液化产物的配方。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|