作者简介: 蓝蔚青, 1977年生, 上海海洋大学高级工程师 e-mail: wqlan@shou.edu.cn
为深入研究卡拉胶寡糖对反复冻融南美白对虾样品品质与蛋白变化影响, 采用傅里叶变换中红外(Fourier transform infrared, FTIR)互补结合激光显微拉曼(micro Raman)光谱技术, 以不同预处理方式(无菌蒸馏水、 三聚磷酸盐溶液与卡拉胶寡糖溶液)下反复冻融南美白对虾肌原纤维蛋白为研究对象, 深入研究了卡拉胶寡糖预处理对不同冻融阶段南美白对虾肌肉品质和蛋白的影响机制。 分别对三种预处理方式下经0, 2, 4和6次冻融循环后的南美白对虾肌原纤维蛋白进行FTIR和拉曼光谱分析。 FTIR和拉曼一阶谱图中各特征峰强度变化谱图可得出, 随冻融次数增加, 南美白对虾肌肉的蛋白损失和结构破坏明显加剧。 样品肌肉蛋白二级结构的主链构象主要由酰胺Ⅰ带(1 6001 700 cm-1)表征, FTIR分析显示新鲜虾肉蛋白二级结构以β-转角为主, 其次为β-折叠, 其弥补了拉曼光谱对β-折叠和β-转角的不敏感。 FTIR与拉曼光谱酰胺Ⅰ带高斯拟合后谱图可定性定量显示冻融过程中样品的蛋白二级结构变化主要是α-螺旋结构的减少与无规卷曲结构的增加, 而卡拉胶寡糖预处理能明显抑制冻融过程中α-螺旋结构的损失。 FTIR对蛋白表面氨基酸变化不敏感, 拉曼光谱则可互补显示样品蛋白侧链的构象变化。 其表征酪氨酸残基的谱带出现在850和830 cm-1, 峰强比表征了样品中酪氨酸的暴露程度在冻融期间呈增长趋势; 脂肪族侧链氨基酸残基的C—H弯曲与伸缩振动分别在1 4401 465和2 8003 100 cm-1区间, 1 448和2 935 cm-1处峰强变化表征了样品侧链氨基酸的疏水相互作用在冻融过程中逐渐增强。 拉曼光谱中蛋白侧链的特征谱带变化表明冻融过程使虾肉蛋白中分子内、 分子间氢键断裂和侧链酪氨酸、 脂肪族氨基酸残基暴露, 而卡拉胶寡糖处理后明显延缓了该变化。 因此, 卡拉胶寡糖可延缓反复冻融虾肉蛋白中氢键断裂、 侧链疏水基暴露, 进一步稳定蛋白二级结构, 维持其蛋白功能特性, 从而起到对反复冻融南美白对虾肌肉品质的保护作用。 同时, 本研究将FTIR与拉曼光谱技术结合应用在卡拉胶寡糖对冻融南美白对虾肌肉品质保护机制研究上, 发现FTIR在南美白对虾蛋白二级结构的表征上更敏感, 拉曼光谱则能为样品蛋白侧链构象变化提供参考, 二者结合可通过提供互补信息, 更好表征样品经处理后蛋白的结构变化。
In order to study the influencing mechanism of carrageenan oligosaccharide on the muscle quality and protein in Litopenaeus vannamei during F-T cycles, the myofibrillar protein of samples during F-T cycles with different pretreatment methods (sterile distilled water, tripolyphosphate and carrageenan oligosaccharide) were measured respectively by Fourier Transform Infrared (FT-IR) and Micro-Raman (M-Raman). The data of FT-IR and M-Raman for myofibrillar protein in Litopenaeus vannamei with different pretreatments after 0, 2, 4, 6 F-T cycles were collected respectively. The results showed that the destructive effect of F-T cycles on the protein structure in Litopenaeus vannamei could be demonstrated by first-order spectrogram, and the structural changes of protein under different pretreatments could be qualitatively and quantitatively analyzed by second order derivation and gaussian curve fitting. The intensity changes of each characteristic peak at first-order spectrogram in FT-IR and M-Raman were indicated that F-T cycles could aggravate the loss and structural damage of muscle protein in shrimp. The primary chain conformation of secondary structure in the shrimp muscle protein was mainly characterized by amide band Ⅰ (1 600~1 700 cm-1). The results of FT-IR showed that the secondary structure of fresh shrimp protein was mainly β-turn, followed by β-sheet. It could compensate for the insensitivity of β-turn and β-sheet by M-Raman. The amide band Ⅰ of FT-IR and M-Raman spectrum after gaussian fitting qualitatively and quantitatively showed the secondary structure changes of protein during F-T cycles mainly made the decrease of α-helix and the increase of random coil, and carrageenan oligosaccharide pretreatment could significantly inhibit the loss of α-helix in shrimp protein during F-T cycles. FT-IR was not sensitive to the changes in the compositions of amino acid exposed to protein surface, while M-Raman spectra could compensate it to show the changes in protein conformation on side chain. The bands represented that tyrosine residues appeared at 850 and 830 cm-1, and the peak intensity ratio indicated the exposure of tyrosine, which showed an increasing trend during F-T cycles. The C—H bending and stretching vibration of aliphatic side chain amino acid residues were in 1 440~1 465 and 1 465~2 800 cm-1 respectively, and the peak strength changes of 1 448 and 2 935 cm-1 were on behalf of hydrophobic interaction strength of amino acid on side chain, which increased during F-T cycles. The changes in characteristic spectral bands of protein on side chains by M-Raman showed that F-T cycles made the hydrogen bond rupture of protein intramolecular or intermolecular, the exposure of tyrosine or amino acid residues on aliphatic side chain, and carrageenan oligosaccharides pretreatment could slow down the change significantly. Therefore, carrageenan oligosaccharides could delay the rupture of hydrogen bond and exposure of side chain hydrophobic group in muscle protein during F-T cycles, the secondary structure of protein could be further stabilized, the function of protein could be maintained and the quality of shrimp could be improved under F-T cycles. In addition, the innovative combination of FT-IR and M-Raman spectra was applied to the research on the mechanism of carrageenan oligosaccharide for improving the muscle quality under F-T cycles. It was found that FT-IR was more sensitive to the characterization of secondary structure in muscle protein, while M-Raman spectra could provide the theoretical references for the conformation changes of protein on side chains. The combination of them could provide the compatible and complementary information to better analyze the structural changes of protein in samples after different pretreatments.
振动光谱是研究蛋白质、 碳水化合物、 核酸、 细胞膜、 细胞组织等化学组成与分子结构变化的主要方法。 然而, 单一光谱通常会导致谱带重叠严重。 因此, 将几种振动光谱技术相结合开展分析研究逐渐引起人们的关注[1]。 傅里叶变换红外吸收光谱(Fourier transform infrared absorption spectroscopy, FTIR)与拉曼光谱(Raman spectroscopy)可作为互补分析技术用于大分子物质结构变化研究[2, 3]。 分子振动过程中由于分子偶极矩变化而具有红外活性, 分子极化性变化而产生拉曼活性[4]。 傅里叶变换红外光谱目前常用于食品、 药材检测和辨伪[5], 如Hu等[6]通过红外光谱结合主成分分析技术成功鉴别了白姑鱼、 带鱼与金线鱼的鱼糜制品; 拉曼光谱目前多用于药物与残留物检测, 其在评价水产品蛋白变性的研究较少。 其中, 高瑞昌等[7]基于拉曼光谱研究了冷藏过程中凡纳滨对虾肌动球蛋白的构象变化。 少数研究表明, 两种光谱技术同时使用, 可增加结果分析的准确性[2]。 其中, Yuka等[4]在研究不同研磨条件对罗非鱼鱼糜和分离蛋白结构影响时, 通过两种光谱的互补作用进行分析。
南美白对虾(Litopenaeus vannamei)又名凡纳滨对虾, 为对虾科对虾属甲壳类水产品, 其凭借营养价值高、 肉质鲜美等特点深受消费者欢迎。 冷冻贮藏是南美白对虾保鲜中常用的方法之一, 据调查, 我国仅有20%的水产品通过规范的冷链系统流通。 一旦冷链措施不完善, 其在贮运、 零售或消费过程中会产生较大的温度波动, 导致原料历经多次冷冻-解冻(Freeze-Thaw, F-T)过程, 易造成细胞机械损伤、 蛋白氧化变性等, 影响其口感和营养价值[8]。 高蛋白类海产品在贮运过程中的冻融循环会破坏用来稳定蛋白构象和维持其功能的蛋白间相互作用, 造成肌原纤维蛋白功能丧失, 保水性、 溶解度与必需营养素等损失[9]。 为减少贮运过程中冻融造成的蛋白氧化变性、 营养损失, 具抗氧化作用的抗冻保水剂被广泛应用。
三聚磷酸钠通常作为抗冻保水剂、 品质改良剂等被广泛应用于肉类食品中。 其通常用于对虾冷冻前处理, 可明显改变其解冻后的化学组成和理化性质, 改善其肌肉持水性和品质[9]。 然而, 近年来, 三聚磷酸盐导致钙磷缺乏, 诱发皮肤过敏等问题层出不穷, 使消费者对其有所避讳。 而作为卡拉胶的降解产物, 卡拉胶寡糖的甜度更低、 热量更小, 在抗氧化、 防辐射与抗肿瘤等方面表现出良好的生理活性[8, 10, 11]。 此外, 其溶解性、 安全性与稳定性均有所改善, 在生物医药领域也有较好的应用前景[12]。 目前, 卡拉胶寡糖已被部分学者应用于冷冻虾仁研究。 如Zhang等[12]用卡拉胶寡糖处理南美白对虾虾仁后进行冻藏处理, 发现其对虾仁蛋白质氧化保护作用显著, 能维持肌肉保水性与综合品质。 而将卡拉胶寡糖用于南美白对虾反复冻融过程, 研究其对原料蛋白结构影响还未见报道。
本文以南美白对虾为研究对象, 分别使用三聚磷酸钠与卡拉胶寡糖溶液处理南美白对虾, 以无菌蒸馏水处理的样品为对照组, 通过傅里叶变换中红外与拉曼光谱技术相结合, 分析三种方式处理后的南美白对虾, 经不同次数的反复冻融后, 其对虾肉肌原纤维蛋白二级结构及构象变化的影响, 并对卡拉胶寡糖的蛋白保护机制予以推测, 以期为今后水产品中卡拉胶寡糖和光谱检测技术的应用提供理论参考。
卡拉胶寡糖(500~1 000 Da, 食品级)、 三聚磷酸钠(食品级) 购自青岛博智汇力生物科技有限公司; 磷酸氢二钠、 磷酸二氢钠、 氯化钠、 溴化钾等购自国药集团化学试剂有限公司, 均为国产分析纯。
Nicolet iS-5型傅里叶变换红外光谱仪(美国Thermo Fisher Scientific公司); Nicolet Almega XR型激光共聚焦显微拉曼光谱仪(美国Thermo Fisher Scientific公司); Alpha 2-4 LD plus型冷冻干燥机(德国Christ公司等)。
南美白对虾购自上海市浦东新区临港农工商超市, 选取体重(27± 1) g、 体长(17± 1) cm的鲜活样品, 冰水猝死, 将其迅速分为三组, 处理方式如表1所示。
| 表1 南美白对虾的处理方式 Table 1 Litopenaeus Vannamei with different treatments |
将各组处理后的样品分装至PE保鲜袋中, 置于-20 ℃冰箱中冻藏12 h, 取出后将样品平铺在碎冰上置于4 ℃冷藏解冻12 h, 视为一次冻融循环, 重复此操作, 分别在第2, 4和6次冻融循环结束后分别作傅里叶变换中红外与拉曼光谱分析。
样品经去头、 去尾、 去壳后, 参考Ma等[8]法进行南美白对虾肌原纤维蛋白的提取, 稍作修改。 提取液采用20 mmol· L-1 pH 7.5的磷酸盐缓冲溶液, 漂洗液采用0.1 mol· L-1 NaCl。 虾糜用4倍体积冰提取液匀浆, 6 700 r· min-1冷冻离心15 min, 去上清液液重复2次; 沉淀加入4倍体积冰洗液匀浆, 6 700 r· min-1冷冻离心15 min, 去上清液重复1次; 沉淀加入冰洗液, 匀浆后4层纱布过滤, 滤液6 700 r· min-1冷冻离心15 min, 沉淀为肌原纤维蛋白。 将肌原纤维蛋白于-80 ℃冷冻24 h后取出, 置于冻干机中干燥72 h, 于密闭瓶中-20 ℃保存备用。
在(20± 2) ℃室温条件下, 取适量已冷冻干燥的南美白对虾肌原纤维蛋白与KBr混合、 研磨与压片。 参数设置参考相关文献, 使用傅里叶变换红外光谱仪在400~4 000 cm-1波长范围进行扫描。
使用激光共聚焦显微拉曼光谱仪在1003 000 cm-1波长范围进行扫描, 参考高瑞昌等[7]法进行测试参数设置。
样品的傅里叶变换红外光谱图通过OMNIC 9.2. 106光谱处理软件自动修饰校正。 用PeakFit v4.12软件对样品的红外图谱和拉曼图谱进行基线校正、 二阶导处理和高斯拟合, 以利于区分重叠子峰, 得到图谱的各特征峰峰强和峰面积, 用Origin 7.5软件作图。
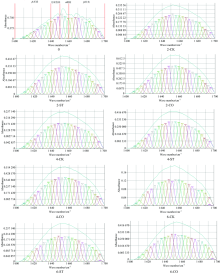
除蛋白侧链构象与肽链空间排列外, 蛋白二级结构很大程度上决定了蛋白质的功能特性[13]。 其主要有α -螺旋、 β -折叠、 β -转角和无规卷曲等形式[14]。 蛋白质在红外和拉曼区有若干特征吸收带, 如图1与图2所示。 在一阶谱图上, 重叠峰较明显, 但可根据峰信号强弱判断各基团含量变化。
2.1.1 傅里叶变换红外一阶谱图分析
由图1可以看出, 红外特征峰的变化主要包括1 5001 600 cm-1的酰胺Ⅱ 带、 1 6001 700 cm-1的酰胺Ⅰ 带、 2 929 cm-1处— CH的特征吸收峰和3 296 cm-1处的单强峰, 分别是由C— N伸缩和N— H弯曲振动、 羰基C═O和双键伸缩振动、 C— H伸缩振动、 O— H伸缩振动引起。 位于1 6001 700 cm -1的酰胺I带可反映蛋白质二级结构的变化, 其吸收最强[15]。 对比新鲜南美白对虾肌肉蛋白的红外谱图, 随冻融次数的增加, 经不同预处理(CK, ST, CO)的虾肉蛋白, 其红外光谱中特征峰峰强明显减弱, 表明反复冻融造成肌肉肌原纤维蛋白结构破坏和二级结构的转化和改变。
2.1.2 拉曼光谱一阶谱图分析
利用蛋白质分子中C— N键和C═O键伸缩振动的拉曼活性可得到其拉曼波谱(图2)。
由图2可知, 不同预处理下的南美白对虾经不同次数冻融后, 其拉曼图谱中发生的变化主要包括C═O伸缩结合部分C— N伸缩和N— H弯曲振动引起的1 6451 685 cm-1酰胺Ⅰ 带、 C— N、 C— C伸缩振动和N— H弯曲振动的1 2201 350 cm-1酰胺Ⅲ 带、 C— H弯曲振动产生的1 4401 465 cm-1谱带及C— H伸缩振动产生的2 940 cm-1附近的谱带。 蛋白质主链构象的各种二级结构变化可由该拉曼图谱中酰胺Ⅰ 带和Ⅲ 带的谱峰强度变化来表征, 说明冻融循环和不同预处理使虾肉肌原纤维蛋白结构发生了不同程度变化[16]。
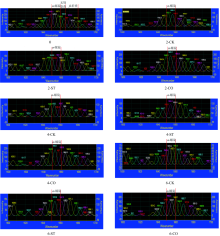
通常, 红外和拉曼光谱一阶图谱中极易出现重叠峰, 通过二阶导数和各种曲线拟合可放大一些细小峰变化, 得到单个谱带的信息[7, 17]。 本研究特对各组样品红外和拉曼图谱的酰胺Ⅰ 带作高斯曲线(Gauss formula)拟合, 得到各子峰[18]。
2.2.1 傅里叶变换红外酰胺Ⅰ 带高斯拟合图谱分析
图3显示了不同预处理条件下, 南美白对虾肌肉蛋白经反复冻融后红外光谱中酰胺Ⅰ 带高斯拟合结果, 各特征峰峰顶点横坐标为该峰的位置, 纵坐标为该峰的峰强。 图中1 600~1 640, 1 640~1 650, 1 650~1 660及1 660~1 700 cm-1波数处谱峰分别表征β -折叠、 无规卷曲、 α -螺旋和β -转角结构[14]。
图3中根据各特征峰的纵坐标峰强度变化可明显看出, 随冻融次数增加, 不同预处理的虾肉蛋白酰胺Ⅰ 带的谱峰强度出现不同程度减弱。 三聚磷酸钠处理虽在一定程度延缓了其峰强减弱进程, 但其在冻融后期与CK组样品差异不显著, 而CO组样品峰强在整个冻融过程中明显高于其余两组。 表明样品经冻融处理, 其蛋白二级结构已遭到破坏, 蛋白氧化变性加剧。 卡拉胶寡糖处理对样品蛋白二级结构的保护作用比三聚磷酸钠处理更持久、 更明显, 能较好延缓样品中的蛋白损失。
2.2.2 拉曼酰胺Ⅰ 带高斯拟合图谱分析
图4显示了南美白对虾经3种方式处理后, 其肌原纤维蛋白酰胺Ⅰ 带的高斯拟合拉曼图谱。 研究发现, 若酰胺I带中谱峰集中于1 650~1 660 cm-1处, 表明该样品蛋白中含有大量的α -螺旋结构; 若集中于1 665~1 680 cm-1, 表明含大量β -折叠结构; 若集中于1 660~1 665 cm-1, 则表明含大量无规卷曲或无序结构[18]。 同FTIR结果一致, 对比新鲜虾肉肌原纤维蛋白酰胺Ⅰ 带谱峰强度, 三组蛋白酰胺Ⅰ 带各谱峰强度随冻融次数增加呈不同程度减弱, 表明蛋白发生氧化变性, 二级结构受到不同程度破坏; 且对比1 660~1 665与1 665~1 680 cm-1, 1 650~1 660 cm-1处谱峰强度减弱更明显, 表明在冻融过程中可能发生了α -螺旋向β -折叠或无规卷曲转化。 CO组样品的谱峰强度直到第6次冻融时才出现明显减弱, 表明卡拉胶寡糖处理能延缓样品蛋白结构的解螺旋与再折叠, 该结果进一步证实了红外光谱的分析结论。
依据红外和拉曼酰胺Ⅰ 带高斯曲线拟合后各特征峰的峰面积, 可得到南美白对虾肌肉蛋白对应二级结构的百分比变化, 结果由表2所示。
| 表2 不同处理下反复冻融南美白对虾肌原纤维蛋白二级结构含量比例变化(%) Table 2 Changes in secondary structure of myofibrillar protein in shrimp with different F-T cycles under different treatments (%) |
表2中拉曼光谱谱带并不能明显区分β -折叠和β -转角, 而由红外数据可知, 南美白对虾肌原纤维蛋白二级结构主要是β -转角, 其次为β -折叠, α -螺旋和无规卷曲结构的含量相对较少。 该结果与王萌等研究结果一致, 体现了FTIR对拉曼的补充作用。 表2红外数据显示, 新鲜虾肉蛋白中各二级结构的含量分别为43.22%, 19.32%, 17.24%与19.90%, 结合拉曼光谱数据分析得出, 随着冻融次数的增加, 南美白对虾肌肉蛋白的无卷曲结构含量有所增加, α -螺旋结构含量减少, 总无规卷曲和总α -螺旋比值随之增加, 表明反复冻融破坏了南美白对虾肌肉蛋白二级结构的稳定性, 可能造成蛋白结构中α -螺旋向β -折叠或无规卷曲转化。 此外, 对于总无规卷曲与总α -螺旋的比值, CO组和ST组均低于CK组, 且CO组在中后期最低。 表明ST和CO对蛋白二级结构及维持其结构稳定性的氢键均具有保护作用, CO对蛋白结构的稳定作用更明显。 由于蛋白结构稳定性的破坏与二级结构间和内部氢键的断裂有关, 也是蛋白质变性的根本原因[6]。 因此, 结果表明卡拉胶寡糖对南美白对虾肌肉品质和口感的保护可能延缓了反复冻融过程中虾肉蛋白间氢键及二级结构的破坏, 维持蛋白在冻融过程中的功能特性, 从而延缓其品质劣变。
蛋白质分子的氨基酸组成特别是暴露于蛋白质分子表面的氨基酸组成很大程度上影响蛋白质分子二、 三级结构[19], 导致功能性质如蛋白质分子疏水性变化。
2.4.1 酪氨酸残基相关谱带分析
酪氨酸等疏水芳香族氨基酸侧链参与氢键形成, 在拉曼谱图中的特征峰变化可用于检测极性微环境或氢键的活动[7]。 拉曼谱图中谱带850和830 cm-1来自于酪氨酸残基的对位取代苯振动, 其峰强比可反映酪氨酸在蛋白质中所处的微环境。 当其强度比为0.71.0时, 酪氨酸残基完全“ 埋藏” 在疏水环境即未裸露; 当强度比为1.01.25时, 酪氨酸残基开始暴露; 当强度比高于1.25时, 酪氨酸残基已逐渐暴露于蛋白分子表面[7]。
由图5可知, 对于新鲜虾肉蛋白, 其峰强度比值为1.101, 表明样品蛋白分子内及分子间氢键发生少数断裂, 酪氨酸大部分“ 埋藏” 在疏水环境中。 在三组中, 该比值均随冻融次数增加, 总体呈增加趋势。 在CK, ST及CO组冻融6次后, 该比值升至2.160, 1.689和1.483, 表明随冻融次数增加, 肌肉蛋白中酪氨酸残基逐渐暴露, 且CO对其保护作用明显高于ST, 即对蛋白结构具有稳定作用, 延缓其蛋白变性。
 | 图5 不同处理下反复冻融南美白对虾蛋白在850和830 cm-1波数处拉曼强度比Fig.5 The ratio of Raman intensity at 850 and 830 cm-1 of shrimp with different treatments during F-T cycles |
2.4.2 脂肪族残基相关谱带分析
大部分拉曼谱带与多种氨基酸有关, 而红外光谱则对此并不敏感。 南美白对虾肌原纤维蛋白中C— H键弯曲和伸缩振动在谱图上反映的拉曼谱峰位于1 4351 470与2 8003 100 cm-1, 分别用于监测脂肪族残基间的疏水相互作用和脂肪族疏水侧链的暴露[20]。 通过计算得到不同处理、 冻融次数下2 935和1 448 cm-1处相对强度, 结果见表3。
| 表3 不同处理下反复冻融南美白对虾蛋白在1 448和2 935 cm-1处相对拉曼强度变化 Table 3 The changes of |
由表3可知, 样品经6次冻融后, CO组C— H键1 448和2 935 cm-1处的相对强度分别由新鲜的2.625, 1.341升至5.947, 2.347, ST组样品则升至8.395, 3.634, 空白组样品升至11.687, 5.091。 对虾肌肉蛋白同时受处理方式和冻融循环影响, 主要表现在两处谱带不同程度增强。 反复冻融过程中蛋白质溶解性下降和疏水性增强主要由于该过程可能造成样品中蛋白质主链变化和侧链疏水氨基酸残基暴露, 使蛋白分子间疏水相互作用增强。 由此可知, 卡拉胶寡糖处理可明显延缓疏水侧链的暴露, 保护反复冻融过程中虾肉蛋白结构变化, 维持肌肉蛋白良好的功能特性, 改善其综合品质。
傅里叶变换红外和拉曼光谱提供了兼容互补的信息, 可更好地分析样品经处理后蛋白的结构变化。 一阶谱图表明反复冻融次数的增加加速了蛋白含量损失和蛋白结构破坏, 而酰胺Ⅰ 带(1 6001 700 cm-1)的二阶导高斯曲线拟合可反映在冻融过程中虾肉肌原纤维蛋白二级结构中α -螺旋的减少和无规卷曲结构的增加, 卡拉胶寡糖和三聚磷酸钠组显示出对样品蛋白二级结构, 特别是对α -螺旋的保护作用, 其中以卡拉胶寡糖的作用效果更明显, 且红外在反映蛋白二级结构时比拉曼更敏感。 由拉曼谱带可看出, 样品在冻融过程中, 由于冰晶的反复形成, 使氢键受到破坏, 酪氨酸与疏水基残基暴露, 蛋白疏水性增加, 而卡拉胶寡糖可明显延缓其变化。 综上可知, 卡拉胶寡糖可通过对南美白对虾虾肉蛋白二级结构和分子间、 分子内氢键的保护、 使侧链酪氨酸残基和脂肪族疏水基暴露进程延缓, 保护样品在冻融过程中蛋白功能特性劣变, 延缓其综合品质下降。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|