作者简介: 饶震红, 1968年生, 中国农业大学理学院高级实验师 e-mail: ndrzh@sina.com
通过荧光光谱、 紫外光谱、 圆二色谱、 红外光谱、 核磁共振光谱研究肉桂醛与玉米醇溶蛋白间的作用机理, 为改善玉米醇溶蛋白膜的机械性能及抗菌性和抗氧化性提供研究依据。 通过三维荧光光谱检测, 发现肉桂醛对玉米醇溶蛋白有明显的荧光猝灭作用, 而且溶剂乙醇对猝灭现象有影响。 用紫外差谱观察到玉米醇溶蛋白在紫外区278 nm的吸收强度随肉桂醛浓度增大而加大, 但增加的幅度与浓度改变不成比例, 氨基酸残基的特征吸收峰的位置没有变化。 加入肉桂醛前后, 圆二色谱显示的两条曲线近乎重合。 利用全反射ATR附件测定傅里叶变换红外光谱, 发现加入肉桂醛之后, 1 650和1 538 cm-1的吸收峰峰位没有发生明显的变化, 但1 625 cm-1处出现了明显的肩峰, 体现了肉桂醛碳碳双键的吸收, 指纹区879.44 cm-1处的峰消失, 973.46 cm-1处出现新峰, 显示出肉桂醛反式双键的吸收, 说明玉米醇溶蛋白与肉桂醛发生了非键合作用。 对酰胺Ⅰ带进行自去卷积计算, 发现玉米醇溶蛋白的二级结构中α螺旋结构变化甚微, β转角发生显著改变。 通过核磁共振氢谱, 分析4个位置的质子H的化学位移, 仅改变了0.01, 而且加入肉桂醛1和4 h之后, 化学位移改变量相等, 证明肉桂醛与玉米醇溶蛋白的结合反应发生在蛋白表面。 对体系的热力学参数进行计算, 可知肉桂醛与玉米醇溶蛋白之间发生的是结合比为1∶1的自发结合反应; 在肉桂醛低浓度时, 猝灭常数随温度的升高而降低, 但变化不显著; 结合常数很大, 数量级达到105, 且随温度的升高而降低。 在有无肉桂醛的条件下, 对玉米醇溶蛋白荧光寿命的测定, 进一步确认二者之间发生的是静态猝灭。 综合多种光谱分析结果, 说明肉桂醛与玉米醇溶蛋白主要在芳香区的外部发生π—π堆积, 以静电力结合, 是静态猝灭机制, 与作用时间的长短无关。 结果表明玉米醇溶蛋白中加入肉桂醛, 对其二级结构不会造成明显的影响。
The aim of this study was to investigate the mechanism of interaction between cinnamaldehyde and zein by fluorescence spectroscopy, UV spectroscopy, circular dichroism spectroscopy, infrared spectroscopy, and nuclear magnetic resonance spectroscopy, so as to provide research basis for improving the mechanical properties, antibacterial properties, and antioxidant properties of zein films. Through three-dimensional fluorescence spectroscopy, it was found that cinnamaldehyde has obvious fluorescence quenching effect on zein, and solvent ethanol has an effect on quenching. When UV-spectroscopy was used to explore the mechanism, it was observed that the absorption intensity of zein in the UV region at 278 nm increased with the increasing concentration of cinnamaldehyde, but the increasing range was not proportional, and the characteristic absorption peak positions of the amino acid residues was not changed. Before and after addition of cinnamaldehyde, the two curves exhibited by circular dichroism were nearly coincident. Using the attenuated total reflection ATR appendage for Fourier transform infrared spectroscopy, we found that after the addition of cinnamaldehyde, the absorption peak at 1 650 cm-1 indicates C═O stretching vibration, and 1 538 cm-1 indicates the NH bending vibration in plane. The peak positions at these two sites did not change significantly, but there were obvious acromion peaks at 1 625 cm-1, reflecting the absorption of cinnamaldehyde carbon-carbon double bonds. The peak at 879.44 cm-1 of the fingerprint area disappeared, and a new peak appeared at 973.46 cm-1, reflecting the absorption of the cinnamaldehyde trans double bond, indicating that a non-bonding of zein with cinnamaldehyde. The self-deconvolution calculation of the amide Ⅰ band revealed that the α-helix structure of the zein secondary structure changed little and the β-turn changed significantly. By means of NMR, the chemical shift of proton H in 4 positions changed only 0.01, and after 1 hour and 4 hours of cinnamaldehyde addition, the change of chemical displacement was equal, indicating that the binding reaction of cinnamaldehyde to zein occurred on the surface of the protein and did not cause changes in the secondary structure of zein. The thermodynamic parameters of the system were calculated. It was found that the spontaneous binding reaction occurred between cinnamaldehyde and zein, and the binding ratio of them was 1∶1. When the concentration of cinnamaldehyde was low, the quenching constant decreases with the increase of temperature, but the change was not significant; when the binding constant was very large, the order of magnitude reached 105, and decrease with the increase of temperature. The determination of the fluorescence lifetime of zein in the presence or absence of cinnamaldehyde further confirmed that static quenching occurred between cinnamaldehyde and zein. Comprehensive analysis of various spectra showed that cinnamaldehyde and zein was mainly π—π stacked on the outside of the aromatic region, and it was a combination of electrostatic forces, was static quenching mechanism, and was independent of the action time. The results showed that the combination of cinnamaldehyde and zein do not significantly affect the secondary structure of zein.
当今越来越多的人们研究用安全、 无毒、 可降解的“ 绿色包装” 代替对环境造成严重危害的塑料包装。 Carrizo研究了含有绿茶提取物的多层抗氧化包装[1], Moudache将橄榄叶提取物应用于多层聚乙烯膜用于鲜肉的保存[2]。 以可食性材料为基质的包装膜— — 可食用膜, 不仅可以控制物品的水分、 气体和微生物与外界之间的渗透, 而且很好地解决了包装使用安全性及环境污染问题, 国内外关于可食用膜的开发利用研究逐年深入[3, 4], 其中, 玉米醇溶蛋白由于本身良好的抗氧化性, 凝胶化性和成膜性的特点, 成为当今可食用膜的研究重点[5, 6]。
玉米醇溶蛋白(Zein)是玉米中含量最高的储藏蛋白, 超过50%是疏水性氨基酸残基, 不同类型和浓度的乙醇溶液影响着Zein的疏水性和溶解性[7], Zein具有良好的成膜性, 结构中有许多含硫氨基酸, 可以形成很强的分子二硫键, 是Zein成膜的分子基础[8], 在醇的水溶液中, Zein还能够自组装形成纳米结构[9], 与其他食用膜相比较, 玉米蛋白膜的强疏水性, 使得Zein本身不需要交联剂即可成膜[10]。 但是, 纯Zein制成的膜机械强度不高, 脆性大。 通常需要在Zein基质中加入功能性分子制成复合膜, 改善玉米醇溶蛋白膜的综合特性[11]。 肉桂醛(3-苯基丙烯醛, Cinnamaldehyde, 简写CA)是天然的芳香α , β -不饱和醛, 主要从桂皮中提取, 存在于植物精油中。 使用肉桂醛作为蛋白质膜的交联剂可以改善膜的物理性质[12], 而且肉桂醛的抗菌性和抗氧化性可以扩大玉米醇溶蛋白膜的应用范围。 对于玉米醇溶蛋白的研究多集中于膜的制备工艺与性能改善, 有关肉桂醛在室温下直接与玉米醇溶蛋白相互作用的机理报道少见。 本研究利用荧光光谱、 紫外光谱、 圆二色谱、 ATR-FTIR红外光谱和核磁共振氢谱多种分析技术, 从光谱学的角度, 探讨稀溶液状态下, 肉桂醛对玉米醇溶蛋白二级结构的影响, 为更好地改善玉米醇溶蛋白膜的机械性能及扩大用途提供基础研究依据。
LS55型荧光光度计、 Lambda 650紫外-可见分光光度计(PerkinElmer公司); Chirascan圆二色谱(英国应用光物理公司); Delta flex时间分辨荧光光谱仪(Horiba英国); IS10傅里叶红外光谱仪(Thermo公司); Avance DPX 300核磁共振波谱仪(Bruker公司); AB104-N分析天平(Mettler公司)。
玉米醇溶蛋白Zein (北京百灵威科技有限公司, 含量98%), 用85%的乙醇超声溶解15 min, 配成5.3× 10-2 g· mL-1的储备液; 反式-肉桂醛CA(北京百灵威科技有限公司, 含量99%), 用85%乙醇配成2.9× 10-3 g· mL-1的储备液, 于冰箱冷藏保存, 用时逐级稀释到所需浓度。 实验用水为纯净水。
1.2.1 荧光及紫外光谱分析
取1.00 mL Zein储备液和0.50 mL 2.9× 10-5 g· mL-1 CA的储备液于10 mL比色管中, 以85%乙醇定容, 混合均匀后室温放置1 h。 然后取适量溶液于1 cm石英比色皿, 设置激发波长范围200~300 nm, 发射波长范围260~380 nm, 狭缝宽度5/5 nm, 激发波长每递增5 nm扫描一次, 得到Zein和CA-Zein三维荧光光谱。
根据三维荧光光谱数值, 在若干只10 mL比色管中, 均加入1.00 mL Zein溶液, 不同浓度的CA溶液, 混合均匀后, 于不同温度下放置1 h, 固定激发波长λ ex=280 nm, 狭缝宽度5/5 nm, 发射波长在260~400 nm范围, 扫描CA-Zein荧光光谱。
在室温下, 以85%乙醇为参比溶液, 用1 cm石英比色皿, 在200~300 nm范围内扫描不同浓度的CA与固定浓度的Zein结合前后的紫外光谱。
1.2.2 荧光寿命测定
取0.80 mL Zein储备液和0.60 mL 2.9× 10-5 g· mL-1 CA的储备液于10 mL比色管中, 以85%乙醇定容, 混合均匀后室温放置2 h。 采用Delta flex时间分辨荧光光谱仪, 分别检测5.3× 10-4 g· mL-1的Zein和上述Zein与CA混合溶液的荧光寿命光谱图, 以仪器自带的软件拟合出对应的荧光寿命。
1.2.3 圆二色光谱扫描(CD)
配制一定浓度的Zein溶液和一定浓度的CA与Zein的混合溶液, 用0.1 cm比色皿测定190~250 nm范围内的CD谱。
1.2.4 ATR-FTIR红外分析及自去卷积计算
利用衰减全反射ATR附件测定傅里叶变换红外光谱, 将一定浓度的Zein溶液与CA溶液混合, 置于ATR附件上面, 使用OMNIC 9软件进行红外光谱扫描。 扫描范围4 000~400 cm-1, 扫描次数64, 分辨率4 cm-1。 对谱线进行基线校准, 并经Savitsk Golay函数做平滑处理。 选取酰胺Ⅰ 带区域, 用Peakfi V4软件得到傅里叶自去卷积曲线, 在二阶导数谱图基础上用高斯曲线进行多次拟合, 使其残差最小, 得到完全可分辨的各子峰图谱。
1.2.5 核磁共振氢谱分析
配制一定浓度的CA溶液和一定浓度的CA与Zein的混合溶液, 分别放于核磁管中检测氢谱, 共振频率为300 MHz, 谱宽7 183 Hz, 脉冲宽度(P1)10.70 μ s, zg30脉冲序列。
图1是Zein加入CA 前后变化的三维等高线图。 相应的特征参数见表1。 图1显示在测定的波长范围内, 等高线图谱中有2个峰(Peak A和Peak B), 由Peak A峰的位置λ ex/λ em=280/305 nm可知, Peak A是蛋白质典型的荧光峰, 表现出酪氨酸残基的特征。 Peak B则表现了蛋白质肽链的结构特征[13]。
| 表1 三维荧光特征参数 Table 1 Three-dimensional fluorescence spectral characteristic parameters |
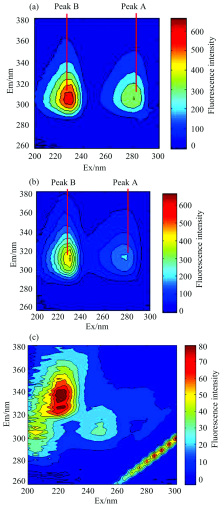 | 图1 三维荧光光谱等高线图 (a): 玉米醇溶蛋白; (b): 肉桂醛与玉米醇溶蛋白混合液; (c): 乙醇溶液(85%)Fig.1 Three-dimensional fluorescence spectrum contour map (a): Zein; (b): Cinnamaldehyde-Zein; (c): Ethanol(85%) |
比较图1(a)和(b), Peak A和Peak B的荧光强度值随着CA加入明显降低, 在相同的实验条件下, 峰A降低了51%, 峰B降低了32%。 从表1数据也可知, 加入CA, Zein的Peak A斯托克斯位移减小, Peak B斯托克斯位移增大; 说明CA和Zein可能发生了相互作用, 对Zein氨基酸残基的微环境产生了影响, 有可能会引起构象变化。 由于位移改变的数值较小, CA和Zein是否发生了作用, 可以借助其他光谱分析方法进一步证明。
图1(c)是85%乙醇溶液的等高线图, 图中清晰的显示出溶剂乙醇在220 nm附近有一个峰, 虽然强度相对不是很大, 但此峰对CA-Zein的荧光光谱有一定程度的影响, 不同浓度的乙醇可以使CA-Zein谱带略微蓝移并且强度减弱, 这是因为乙醇和水分子在液态状态下发生团簇形成新的能发射荧光的分子结构[14], 可以由于溶剂效应, 使蛋白质伸展, 芳香基更多暴露出来, 因而实验中乙醇的浓度必须固定, 以消除溶剂对荧光光谱的影响。
2.2.1 紫外吸收差谱分析
由于CA在紫外区有吸收, 用紫外吸收差谱考量CA与Zein的结合。 如图2所示, 在本实验条件下, Zein在202和278 nm有2个特征吸收峰, 202 nm处的吸收峰, 表现出极强的吸收, 主要是蛋白肽键上C═O的n— π * 跃迁引起, 这是芳环的特征吸收, 与Zein中的α -螺旋含量有关。 CA的加入使Zein在202 nm处的峰位略有红移, 但随着肉桂醛浓度增加未呈现有规律的变化。 说明它对玉米蛋白的二级结构有扰动, 但对α -螺旋结构的影响不大。 278 nm处的吸收峰主要由玉米蛋白分子中酪氨酸和色氨酸残基上芳杂环的π — π * 跃迁引起。 从吸收差谱上看出, 随着CA浓度的增加, Zein在278 nm处的吸收峰值逐渐增加, 呈现增色效应, 最大吸收波长没有变化。 说明CA与Zein发生了作用, 由于CA含有苯环和共轭双键, 推测CA与Zein在芳香区的外部发生π — π 堆积作用, 吸附在Zein的表面。
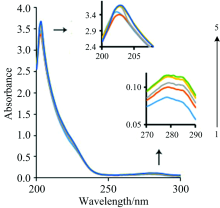 | 图2 肉桂醛对玉米醇溶蛋白紫外光谱的影响Fig.2 Effect of cinnamaldehyde on the UV spectra of zein Zein concentration: 0.104 7 mg· mL-1, Cinnamaldehyde concentration(mg· mL-1): 0; 0.085; 0.11; 0.14; 0.17 |
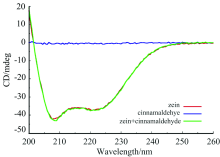
2.2.2 圆二色光谱分析
图3是CA与Zein结合的圆二色谱。 由图可知, Zein在208和220 nm有两个负峰, 表示为负Cotton效应, 这是Zein的α 螺旋结构的特征峰。 当加入CA后, 加入前后两条曲线近乎重合, 说明CA对Zein的二级结构没有明显影响, 这与紫外差谱观察到的现象一致。 由于圆二色谱是在稀溶液中进行, 而且仅对α 螺旋结构较多的蛋白比较准确, 因此借助于ATR-FTIR光谱进一步探讨CA与Zein的结合现象。
2.2.3 ATR-FTIR光谱分析
从红外光谱图可以获得分子中含有的化学键和官能团信息。 当分子的结构发生变化时, 可以通过极性化学键振动频率的变化反映出来。 从图4 Zein和CA-Zein的红外谱图可知, 1 650 cm-1的吸收峰表明C═O伸缩振动, 属于酰胺Ⅰ 带; 1 538 cm-1表明N— H平面内弯曲振动和C— N振动, 属于酰胺Ⅱ 带; 此两处的峰位均没有发生明显的变化, 但在图4(b)中, 1 625 cm-1处出现了明显的肩峰, 表现出CA环芳基的吸收, 图4(a)指纹区879.44 cm-1处的峰消失, 图4(b)指纹区973.46 cm-1处出现新峰, 显示出肉桂醛反式双键的吸收, 说明Zein与CA发生了非键合作用。
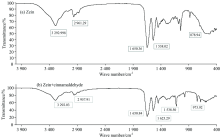 | 图4 玉米醇溶蛋白(a)及肉桂醛与玉米醇溶蛋白结合后(b)的ART-FTIR谱图Fig.4 ART-FTIR spectra of zein (a) and cinnamaldehyde binding to zein (b) |
红外谱图中的酰胺Ⅰ 带(1 700~1 600 cm-1)是研究蛋白质二级结构最有价值的区域。 这一区域多种谱峰重叠, 形成一个宽的强吸收峰。 借鉴前人研究蛋白质二级结构的经验[15, 16], 对这一区域进行傅里叶自去卷积计算, 使重叠在一起的不同峰分开, 根据分开峰的位置, 确定子峰的归属, 每一种子峰对应着蛋白质中一种二级结构, 通过计算子峰的积分面积, 求出各种二级结构的相对百分含量, 结果如图5(a, b)所示。 对Zein, CA-Zein结合后的各个子峰进行指认归属, 面积百分比见表2。
| 表2 酰胺Ⅰ 带子峰的位置、 相对面积和归属 Table 2 Positions, relative areas and assignments of amide Ⅰ band peaks |
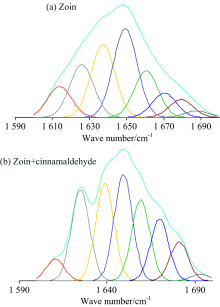 | 图5 酰胺Ⅰ 带傅里叶自去卷积曲线(a)与二阶导数曲线的拟合(b)Fig.5 Fitting of self-deconvolution curves (a) and second derivative curves (b) of amide Ⅰ |
从表2可知, Zein与CA结合后α 螺旋结构从13.7%增加为15.7%, 增加了14.5%; β -折叠, 从46.2%减小为42%, 降低了9%; 无规卷曲从25.8%减小为21.6%, 减少了6.2%; β -转角从14.23%增加为21.3%, 升高了49%。 主要体现蛋白质肽链结构及有序性的α 螺旋结构含量相对变化小, β -转角含量变化却很大, β -转角是简单的非重复性结构, 通常出现在蛋白质的表面, 含有极性和带电荷的氨基酸残基, 说明CA与Zein主要在蛋白质表面相互作用, 对蛋白质内部结构影响相对较小, 与紫外光谱和圆二色谱观察到的结果一致。
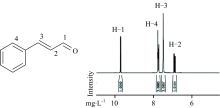
2.2.4 核磁共振氢谱分析
图6是CA的结构式及其核磁共振氢谱1H NMR, 可以观测到原子水平上结构信息的变化。 以二甲基亚砜为溶剂, 4个质子峰从与Zein结合前的δ 9.68, 7.73, 7.45和6.86, 1 h后测定, 相应的变为δ 9.67, 7.74, 7.46和6.87, 化学位移仅变0.01, 4 h后再测定, 化学位移依然未变。 说明CA与Zein结合没有作用在蛋白功能区, 只是作用在蛋白的表面, 对肉桂醛的电子云分布没有明显影响。
多种光谱分析结果表明, CA与Zein存在相互作用, 但是只是在蛋白表面的非功能区。
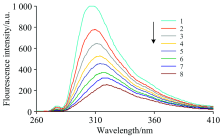
实验发现CA对Zein有荧光猝灭作用, 如图7所示。 随着CA浓度的增加, Zein的荧光强度逐渐降低, 波长出现红移。
通过Stern-Volmer方程定量描述荧光猝灭作用的机制, F0/F=1+KSV[Q]=1+Kqτ 0[Q], 其中F0和F分别为有无猝灭剂和有猝灭剂时Zein的荧光强度, [Q]为CA的浓度, KSV为动态猝灭常数, kq为双分子猝灭过程速率常数, τ 0是无猝灭剂时大分子的平均荧光寿命, 数值为10-8 s。 通过实验可知, CA在高浓度时表现出内滤效应, 在拟合方程时控制CA在低浓度, 可以得到直线方程, 求得猝灭常数KSV和速率常数kq, 结果见表3。 由表中的数据可知, CA与Zein结合的KSV随温度的升高而减小, 变化不显著; kq均大于2.0× 1010 L· (mol· s)-1, 且随着温度的升高而降低, 体现为静态猝灭。
| 表3 玉米蛋白与肉桂醛结合的线性方程与猝灭常数 Table 3 Zein binding to cinnamaldehyde linear equation and quenching constant |
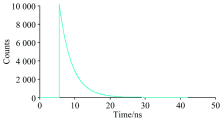
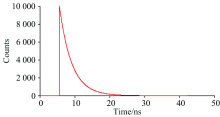
荧光寿命的测量可以区分静态猝灭与动态猝灭, 同时可以验证Stern-Volmer方程。 当发生静态猝灭时, 猝灭剂的存在没有改变荧光分子激发态的荧光寿命, τ 0/τ 1=1, 当发生动态猝灭时, 猝灭剂的存在使荧光分子的寿命缩短。 以λ em=280 nm为激发, 检测了305 nm波长处Zein以及CA与Zein混合后溶液的荧光寿命, 如图8和图9所示, τ 0=3.54ns, 残差x2=1.40; τ 1=3.51 ns, 残差x2=1.38; τ 0/τ 1≈ 1, 即CA与Zein结合体现了静态猝灭。
CA与Zein的结合常数和结合位点数可以通过lg[(F0-F)/F]=nlg[Q]+lgKa进行计算, 结果见表4。 不同温度下CA与Zein的结合位点数约为1.0, CA的结合常数随温度的升高而降低, 进一步证实CA与Zein的猝灭机制是静态猝灭, 且Ka值的数量级达到105, 表明肉桂醛与玉米蛋白存在较强的亲和力。
| 表4 不同温度下, 肉桂醛与玉米蛋白的结合常数Ka和结合位点数n Table 4 Cinnamaldehyde and zein binding constants and binding sites at different temperature |
CA与Zein的结合力可以通过Van’ t Hoff 公式计算反应的焓变Δ H和熵变Δ S[17], 计算结果列入表5。 在三个不同温度下, CA与Zein结合, 反应的Δ G均小于0, 表明CA与Zein之间是自发反应, 而Δ H< 0, Δ S> 0, 说明CA与Zein之间主要以静电力结合。
| 表5 肉桂醛与玉米醇溶蛋白结合的热力学参数 Table 5 Thermodynamic parameters for the binding of cinnamaldehyde to zein |
玉米醇溶蛋白膜具有可食用性、 可降解性的特点, 添加活性物质可以改善其机械性能。 通过荧光光谱、 紫外光谱、 圆二色谱、 红外光谱及核磁共振氢谱对肉桂醛与玉米醇溶蛋白的结合特点进行探讨, 为玉米醇溶蛋白中添加肉桂醛提供研究依据。 结果表明, 肉桂醛与玉米醇溶蛋白主要以静电力自发结合, 而且与作用时间的长短无关; 在非极性的环境中, 肉桂醛与玉米醇溶蛋白的氨基酸残基在芳香区的外部发生π — π 相互堆积作用, 作用在玉米蛋白的表面, 结合后, 玉米蛋白α 螺旋结构改变很微弱, β 转角和无规卷曲改变大, 肉桂醛对玉米醇溶蛋白的二级结构影响小。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|