作者简介: 周学忠, 1966年生, 湖南工学院材料与化学工程学院高级实验师 e-mail: zxz106909@163.com
建立利用电感耦合等离子体串联质谱测定食品中钙和氯的分析方法。 针对Ca的高丰度同位素40Ca受到来自等离子气40Ar的干扰,35Cl受到来自16O18OH的严重干扰, 在MS/MS模式下, 利用碰撞/反应池技术, 以H2为反应气, 使40Ar+与H2发生反应, 而40Ca+不与H2发生反应, 利用H2原位质量法消除40Ar+对40Ca+的干扰; 而35Cl+则能与H2发生质量转移反应生成H235Cl+, 通过测定H235Cl+消除16O18OH+对35Cl+的干扰。 Ca和Cl在0.0~100.0 μg·L-1的浓度范围内线性关系良好, 线性相关系数( R2)≥0.999 9, Ca和Cl的检出限分别为0.061和2.32 μg·L-1。 采用系列国家标准物质验证了对方法的准确性和精密度, 其测定结果与标准参考物质的认定值基本一致, 表明方法的准确性好、 精密度高。 所建立的新方法可实现食品中钙和氯的准确测定。
An analytical method for the determination of Ca and Cl elements in food was established with inductively coupled plasma tandem mass spectrometry (ICP-MS/MS). The most abundant isotope40Ca of Ca is suffering from intense interferences from the40Ar among the argon plasma gas, and35Cl is subjected to interference from16O18OH. To avoid the interference, in the MS/MS mode, collision/reaction cell (CRC) was adopted using H2 as the reaction gas, so that H2 will reach with40Ar+ instead of40Ca+, A H2 on-mass method was used to eliminate the interference of40Ar+ on40Ca+. As mass shift reaction could take place between35Cl+ and H2 to generate H235Cl+, thus the interference of16O18OH+ on35Cl+ can be eliminated by determining H235Cl+. Ca and Cl showed good linearity in the concentration range of 0.0~100.0 μg·L-1 with linear correlation coefficient ( R2)≥0.999 9, and the detection limits of Ca and Cl were 0.061 and 2.32 μg·L-1, respectively. The accuracy and precision of this method were verified by series of national standard materials. The results of this method were basically consistent with the certified values of the reference materials, indicating that the method of good accuracy and high precision. The new method can be used to achieve the accurate determination of Ca and Cl in food.
Ca和Cl是人体必需的营养元素, 对于维持人体正常的新陈代谢、 调节人体内的酸碱平衡、 防控疾病的发生均具有极其重要的作用[1, 2, 3]。 人体中的Ca与蛋白质结合, 协同参与肌肉的收缩、 细胞的迁移、 突触传递、 血液凝固、 激素代谢和骨骼的形成等诸多生理过程[4]; Cl几乎与人体中所有的生理活动相关, 参与胃酸的形成、 激活唾液淀粉酶、 刺激肝脏促使代谢废物排出, 并能稳定神经细胞膜电位[5]。 Ca和Cl在人体内不能自身合成, 必须通过摄取食品来进行补充, 充分利用食品中Ca和Cl的含量来合理搭配炊食结构, 对于维持人体内Ca和Cl的浓度处于正常水平显得非常重要, 因此, 有必要针对食品中Ca和Cl的测定建立快速准确的分析方法。
食品中Ca和Cl的测定已有大量文献报道, 常用的分析方法包括离子色谱[6]、 原子吸收(AAS)法[7]、 电感耦合等离子体发射光谱(ICP-OES)法和电感耦合等离子体质谱(ICP-MS)法[8, 9, 10]。 我国国家标准《食品中钙的测定》和《食品中氯化物的测定》采用AAS法和电位滴定法, 难以满足大批量食品中Ca和Cl的快速测定要求, 受检出限的限制, 这两种分析方法无法实现食品中痕量Ca和Cl的测定。 采用ICP-OES法虽然能快速准确测定微量Ca和Cl, 但Cl的测定处于紫外区, 需要将ICP-OES的分光系统密封在充满氩气的光室中进行分析, 操作条件比较苛刻, 检出限仍然偏高, 不适合痕量Ca和Cl的测定。 采用ICP-MS法测定食品中的Ca和Cl所面临的严重质谱干扰虽然可以借助高分辨率(HR)ICP-MS或碰撞/反应池(CRC)技术避免或消除这些干扰[11], 但使用这两种方法均会降低待测元素在分析通道内的传输效率; 有研究表明采用冷等离子体技术通过抑制Ar+的产生来实现Ca的准确测定[12], 但仍然不能改善低基质样品分析时Ca的检出限或背景等效浓度(BEC), 且由于Cl具有很高的第一电离能, 低温冷等离子体抑制Cl的电离, 无法实现Cl的测定。 本文利用电感耦合等离子体串联质谱(ICP-MS/MS)同时测定食品中的Ca和Cl, 采用CRC的反应模式, 以H2为反应气, 通过精准设计Ca和Cl的原子化过程, 控制反应产物来消除基体和多原子离子干扰, 实现食品中Ca和Cl的准确测定。
1 000 μ g· mL-1的Ca, Cl单元素标准储备溶液(国家有色金属及电子材料分析测试中心); 1 mg· L-1的Sc内标溶液(国家有色金属及电子材料分析测试中心); 65%(w/w)优级纯硝酸(德国默克); 35%(w/w)优级纯双氧水(德国默克); 所有实验用水为Milli超纯水。 国家标准物质: GBW10018(鸡肉), GBW10047(胡萝卜), GBW10051(猪肝), GBW10052(绿茶), GBW10024(扇贝), GBW10048(芹菜), GBW10021(豆角)。
安捷伦8800型ICP-MS/MS仪(美国Agilent公司); Milli-Q超纯水机(美国Millipore公司); CEM Mars5微波消解仪(美国培安公司)。 ICP-MS/MS的调谐条件见表1。
| 表1 ICP-MS/MS的调谐条件 Table 1 Tuning conditions of ICP-MS/MS |
准确称取约0.25 g样品于微波反应罐中, 依次加入65%硝酸5 mL和37%双氧水2 mL, 拧紧螺帽, 将反应罐对称放置于微波消解系统腔体内, 采用温度爬升模式进行消解。 所有样品的消解均采用微波消解系统推荐的复杂样品通用程序(见表2)进行消解。 消解完成后冷却, 转移至100 mL容量瓶中, 定容后待测。 所有的样品溶液、 标准溶液和空白溶液均通过标准在线内标混合接头加入1 mg· L-1的Sc标准溶液。
| 表2 微波消解程序 Table 2 Program of microwave digestion |
采用超纯水配制含Ca和Cl的混合标准溶液系列, 在优化的实验条件下, 对空白溶液、 标准溶液系列以及样品溶液进行测定, 以各待测元素的信号强度与内标元素信号强度的比值对标准溶液中各元素对应的浓度进行线性回归, 仪器自动建立校准曲线, 根据校准曲线计算出被测样品中Ca和Cl的浓度。
Ca有6个同位素, 分别为40Ca, 42Ca, 43Ca, 44Ca, 46Ca和48Ca, Cl有35Cl和37Cl两个同位素, 各同位素的丰度和质谱干扰列于表3。 通过表3可以看出, 高丰度40Ca受到来自等离子气40Ar的严重干扰, 在常规模式下选择40Ca为同位素无法进行测定; 低丰度44Ca仍然受到来自C, N, O所形成的多原子离子干扰, 可以通过CRC的He碰撞模式进行消除干扰[13]; Ca的其余4个同位素的丰度均小于1%, 受到的质谱干扰均为多原子离子干扰, 与44Ca相似, 可以采用He碰撞模式进行消除, 但受碰撞模式动能歧视作用的影响以及低丰度的限制, 这些同位素的灵敏度很低。 显然, 采用高丰度40Ca为同位素能极大提升分析灵敏度, 所面临最大挑战是消除40Ar的干扰, 目前已有的微波等离子炬质谱(MPT-MS)和冷等离子体技术均为针对Ar产生的干扰而实施[12, 13, 14]。
| 表3 Ca和Cl的潜在质谱干扰 Table 3 Potential spectral interferences of Ca and Cl |
由于受电离方式的限制, MPT-MS仍处于不断完善阶段; 而冷等离子体技术则采用低温抑制了Ar+的产生, 但通过对10 μ g· L-1的Ca标准溶液质谱扫描发现, 在质荷比(m/z)为30处可以观察到NO+强峰, 该离子处于亚稳态, 能与等离子体工作气Ar发生电荷转移反应(14N16O++40Ar→ 40Ar++14N16O)形成40Ar+干扰40Ca+的测定[15], 该反应的发生导致了40Ca+的BEC成倍增大, 影响40Ca+的准确测定。 Cl的质谱干扰主要来自等离子气和水形成的多原子离子干扰, 由于Cl的离子化效率很低, 消除干扰对于Cl的测定显得尤为重要。
ICP-MS/MS是在带CRC的ICP-MS上附加一个四极杆过滤器, 一前一后分布于CRC两端, 位于CRC前端的四极杆过滤器为Q1, 后端的四极杆过滤器为Q2。 所有元素经等离子体(ICP)高温电离后形成的质量碎片在进入CRC前, 通过设置Q1允许通过离子的m/z进行一次筛选, 仅允许与待测离子具有相同m/z的离子通过而阻止其他干扰离子通过, 准确控制进入CRC中的离子与反应气发生质量转移反应的历程, 设置Q2允许通过离子的m/z进行二次筛选, 利用双质量四极杆过滤器来消除干扰, 实现待测元素的精准测定, 极大提高了待测元素的准确度和灵敏度, 能显著改善待测元素的检出限[16, 17, 18]。 本实验采用ICP-MS/MS的H2原位质量法和H2质量转移法来消除干扰, 实现40Ca和35Cl的测定(见图1)。
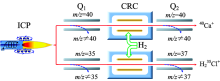 | 图1 MS/MS质量转移模式下采用H2作为反应气分别测定m/z=40和37处的Ca和ClFig.1 Mechanism of MS/MS mass-shift mode using H2 reaction gas for the measurement of Ca as 40Ca+ and Cl as H235Cl+ at m/z=40 and 37 respectively |
分别采用ICP-MS/MS的不同质谱工作模式研究Ca的测定。 在单四极杆模式(SQ, 仅开启Q2, Q1作为离子通道, 相当于带CRC的ICP-MS)下, 选择H2为反应气时, 干扰离子40Ar+和24Mg16O+均能与H2发生质量转移反应生成40ArH+, 40Ar
Cl的第一电离能高达12.97 eV, 在等离子体中的电离率低于其他任何通常测定的元素, 采用ICP-MS测定低浓度Cl, 其灵敏度极低, 35Cl和37Cl并受到来自16O18OH和36ArH的干扰。 提高等离子体温度有利于Cl的电离, 但形成的干扰离子的数量也会增多, 干扰更加严重。 在MS/MS模式下, Cl+与H2发生放热反应, 能自发生成HCl+(Cl++H2→ HCl++H, Δ Hr< 0), 然后HCl+进一步与H2发生放热反应, 通过二次质量转移生成H2Cl+(HCl++H2→ H2Cl++H, Δ Hr< 0), 而16O18OH+不与H2发生反应, 通过H2质量转移法消除16O18OH对35Cl的干扰; 而干扰离子36ArH+也能与H2发生反应形成36Ar
反应气流速大小决定CRC中形成产物离子的种类和数量, 影响消除质谱干扰的效果。 通过向样品溶液中加入10 μ g· L-1的Ca和Cl标准溶液, 考察不同H2流速对Ca和Cl测定结果的影响, 结果见图2。 随着H2的流速增大, Ca和Cl的相对信号强度(相对于10 μ g· L-1 Ca和Cl标准溶液的信号强度)逐渐变小, 表明在CRC中发生了质量转移反应使Ca和Cl所受的质谱干扰逐渐变弱, 当H2流速达到4.0 mL· min-1后, Ca和Cl的相对信号强度不再发生变化, 意味着Ca和Cl所受到的质谱干扰已完全消除, 此时Ca和Cl的相对信号强度接近1.0(测定结果接近10 μ g· L-1)。 由于本实验涉及多个二次质量转移反应, 为确保生成稳定的产物离子, 最终确定反应气H2流速为5.0 mL· min-1。
参照1.4配制浓度分别为0.0, 5.0, 10.0, 50.0和100.0 μ g· L-1的Ca和Cl系列混合标准溶液, 建立校准曲线。 Ca和Cl在0.0~100.0 μ g· L-1浓度范围内的线性相关系数分别为0.999 9和1.000 0, 具有良好的线性关系。 取空白样品的3倍标准偏差所对应的浓度计算仪器的检出限, 得到Ca的检出限为0.061 μ g· L-1, Cl的检出限为2.32 μ g· L-1, 能满足食品中痕量Ca和微量Cl的测定要求。
选取7个国家标准参考物质对所建立的方法进行评价, 验证方法的准确性和精密度, 每个参考物质经微波消解后重复测定11次(高含量样品进行稀释处理), 结果见表4。 采用t检验法验证7个标准物质的测定值与认定值之间的差异, 结果表明, 所有标准物质中的Ca和Cl无显著性差异, 证明方法的准确性好, Ca和Cl的相对标准偏差(RSD)在1.85%~5.66%之间, 表明了方法的精密度高。
| 表4 标准参考物质的分析结果(n=11) Table 4 Analytical results of standard reference materials (n=11) |
选取购置于大型生活超市的大米、 紫菜、 虾仁和白菜四种食品, 按实验方法和实验步骤进行操作, 并采用国标法进行对比分析, 每个样品重复测定11次, 结果见表5。 本法的测定值与国标法的测定值具有很好的一致性, 四种食品中, 白菜中Ca的含量最高, 紫菜中Cl的含量最高。
| 表5 实际样品的分析结果(mg· g-1, n=11) Table 5 Analytical results of the practical samples (mg· g-1, n=11) |
采用微波消解法处理食物样品, 应用ICP-MS/MS法测定食品中Ca和Cl的含量, 在MS/MS模式下, 选择H2为反应气, 利用原位质量法和质量转移法分别消除Ca和Cl测定过程中的质谱干扰。 Ca和Cl的检出限分别为0.061和2.32 μ g· L-1。 采用国家标准参考物质验证了方法具有良好的准确性和精密度, 通过与国标法对实际样品的分析结果进行比较, 两种方法基本一致, 进一步验证了方法的准确性。 方法适用于食品中Ca和Cl的快速准确检测。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|



