作者简介: 任梦佳, 女, 1991年生, 浙江大学生物系统工程与食品科学学院硕士研究生 e-mail: 21413003@zju.edu.cn
利用三维荧光光谱技术, 研究了冷鲜猪肉三维荧光光谱特征, 主要探讨了不同温度存储条件下冷鲜猪肉荧光峰的位置和荧光峰所处区域内荧光强度平均值随存储时间变化的规律, 并初步判断了荧光物质的种类, 为实现基于三维荧光光谱技术快速、 无损检测冷鲜猪肉新鲜度奠定了理论基础。 实验结果表明, 不同温度存储条件下样本的三维荧光光谱图中均含有2个明显的荧光峰(Peak A和Peak B), 它们所在位置的激发波长( λex)/发射波长( λem)范围分别为: λex/ λem约为250~310 nm/300~400 nm和约为300~450 nm/400~550 nm。 其中, Peak A为类蛋白荧光, Peak B为脂质氧化产物荧光。 此外, 实验还发现, 两个荧光峰在各自所处区域内荧光强度的平均值随存储时间变化的趋势不受存储温度影响, 均是Peak A在 λex/ λem=250~310 nm/300~400 nm区域内荧光强度的平均值(
Three-dimensional fluorescence spectroscopy was employed to investigate the fluorescence characteristic of chilled pork stored at different temperatures in this research. The locations of fluorescence peaks were identified and the changes in the average intensity values of two fluorescence peaks in their respective regions during storage were traced. Initially the fluorescent substances were determined as a basis for realizing rapid non-destructive detection of chilled pork freshness with three-dimensional fluorescence spectroscopy. The results showed that three-dimensional fluorescence spectra of chilled pork samples showedfluorescence peaks of two types (Peak A and Peak B) regardless of the storage temperature. The excitation wavelength ( λex)/emission wavelength ( λem) of Peak A was 250~310 nm/300~400 nm, whereas of Peak B was 300~450 nm/400~550 nm. Peak A and Peak B represented protein-like fluorescence and lipid oxidation products fluorescence, respectively. Moreover, the location of the maximum of Peak A was at λex/ λem=290 nm/335 nm during storage, while that of Peak B shifted from λex/ λem=320 nm/470 nm to λex/ λem=390 nm/470 nm. The results also indicated that the average intensity values of two fluorescence peaks in their respective regions had the same trend regardless of the storage temperature: the average intensity values of Peak A in the region of λex/ λem=250~310 nm/300~400 nm (
中国是世界猪肉生产和消费大国[1], 市场上实际销售的猪肉(除腊肉外)主要有热鲜猪肉、 冷鲜猪肉与冷冻猪肉三大类。 其中, 冷鲜猪肉又叫冷却排酸猪肉, 是指严格执行兽医检疫制度, 对屠宰后的猪胴体迅速进行冷却处理, 使胴体温度在24 h内降为0~4℃, 而后上市或后续加工的生鲜猪肉[2]。 冷鲜猪肉的营养损失少、 口感佳、 附加值高, 深受消费者的青睐。 目前发达国家的冷鲜肉已占生鲜肉消费的 90%左右, 而我国冷鲜猪肉消费占比仍很低, 发展潜力巨大。
猪肉在存储过程中由于自身因素及周围环境的影响, 肉的新鲜度会逐渐降低, 甚至腐败变质。 常规检测肉品新鲜度的方法大致分为感官检测、 物理检测以及化学检测[3, 4]。 随着科技的发展, 众多无损检测技术被用于肉品新鲜度的检测中, 主要包括超声波技术、 荧光分析技术、 高光谱图像技术、 可见/近红外光谱技术、 电子鼻技术等[5, 6, 7, 8, 9]。 三维荧光光谱技术是一种面向复杂体系解析的新兴荧光分析技术, 因其灵敏度高、 选择性好、 操作简便等优点受到国内外学者的关注[10]。
由于解析冷鲜肉衰变过程中三维荧光光谱特征是实现基于该技术准确检测肉品新鲜度的前提和基础, 因此本文利用三维荧光光谱技术, 以冷鲜猪肉为研究对象, 分析了样本在不同温度的存储条件下三维荧光光谱随时间变化的规律, 为实现基于三维荧光光谱技术快速、 无损检测冷鲜猪肉新鲜度奠定理论基础和提供数据支撑。
实验均在日本京都大学生物传感工程实验室完成。 利用JASCO FP-8300型三维荧光分光光度计测定样本的三维荧光光谱。 该仪器的光源为150 W氙灯, 激发波长的范围为200~500 nm, 发射波长的范围为210~750 nm, 扫描间隔均为5 nm。 扫描速度为5 000 nm· min-1, 响应时间为50 ms, 灵敏度为250 V。 利用JASCO Spectra Manager软件(ver. 2.0)进行三维荧光光谱的采集和分析。
本文研究对象为冷鲜猪肉, 所选用部位为背最长肌。 这是因为背最长肌组织均匀性较好, 且体量较大, 便于分割出初始条件相近的多块样本, 可以减少由于样本间的差异给实验结果带来的影响。 由于肥肉部分荧光物质产生的荧光强度值较大, 因此实验过程中测量的是背最长肌的肥肉部分。
实验样本是2016年5月24日早上购于日本京都市左京区北白川大国屋超市, 为当天上市的同品种猪的背最长肌, 该品种生猪产地为日本和歌山。 购买后, 样本立即运回实验室。 首先, 在无菌条件下, 将猪肉分割成长宽高约为80× 50× 5 mm3的长方体, 共106块。 接着, 用透气聚乙烯保鲜袋把每个样本单独密封包装。 然后, 将60个样本放在4 ℃的恒温箱中保存, 27个放入20 ℃的恒温箱中保存, 其余19个在5 min内按照1.3所述步骤开展初次实验(记为Day 0), 作为存储的起始点。
每次实验的具体操作步骤为: ①打开FP-8300型三维荧光分光光度计电源预热30 min(温度为25℃恒温环境中)并开启电脑的JASCO Spectra Manager系统软件; ②选择JASCO Spectra Manager软件中的三维扫描, 设置扫描范围、 波长间隔、 扫描速度、 响应时间和灵敏度等相关参数; ③从三维荧光分光光度计中取出固体支架, 用无水乙醇及去离子水清洗, 并用擦镜纸擦干; ④在无菌条件下随机从每个样本上切下一块肥肉; ⑤将切下的肥肉放置在固体支架上, 并将装有肥肉的固体支架附件放入指定扫描区, 开启自动扫描模式, 测量肥肉的三维荧光光谱, 并保存; ⑥重复步骤③— ⑤, 完成所有样本三维荧光光谱的测量。 每24 h按照上述步骤进行一次实验。 4 ℃保存的猪肉样本共做6次实验, 每次取样10个; 20 ℃保存的猪肉样本共做3次实验, 每次取样9个。
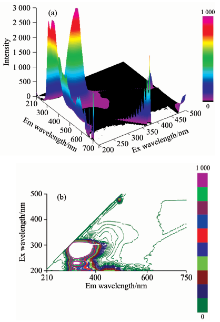
每个样本三维荧光光谱数据中包含61个激发波长、 109个发射波长下的荧光强度值。 所测得的三维荧光光谱数据有等角三维荧光投影图和等高线光谱两种形式, 如图1所示。 等高线图以便观察荧光峰的位置, 等角三维荧光投影图便于观察荧光峰的强度。
2.1.1 存储前荧光峰分布规律
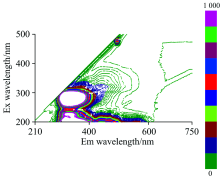
为了揭示不同温度存储条件下冷鲜猪肉三维荧光光谱的变化规律, 首先对未经存储的样本的三维荧光光谱进行分析。 在购样当天(Day 0), 采集了19个样本的三维荧光光谱。 通过分析发现, 所有样本的三维荧光光谱图中只有1个荧光峰Peak A(λ ex/λ em约为250~310 nm/300~400 nm), 最大值出现在λ ex/λ em=290 nm/335 nm处, 如图2所示。
2.1.2 20 ℃存储后荧光峰分布规律
由于猪肉在20 ℃保存时极容易腐败变质, 因此20 ℃存储条件下的实验周期为3 d, 共采集了27个样本的三维荧光光谱。 20 ℃存储条件下第1~3天样本的三维荧光光谱如图3所示。 由图可知, 存储1 d后, 样本的三维荧光光谱图中出现了第2个荧光峰Peak B(λ ex/λ em约为300~450 nm/400~550 nm), 最大值出现在λ ex/λ em=320 nm/470 nm处。 随着存储时间的增加, 最大值出现的位置发生了迁移, 到第3天时最大值出现在了λ ex/λ em=390 nm/470 nm处。
2.1.3 4 ℃存储后荧光峰分布规律
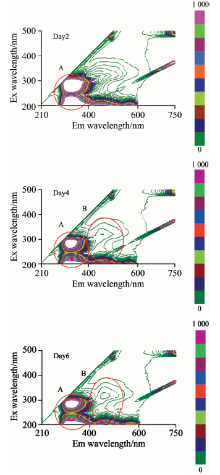
4 ℃保存时, 猪肉不易变质, 在此存储温度下的实验周期为6 d, 共采集了60个样本的三维荧光光谱。 4 ℃存储条件下第2, 4, 6天样本的三维荧光光谱如图4所示。 由图可知, 到第4天时样本的三维荧光光谱图中也出现了荧光峰Peak B, 所处的位置与20 ℃存储条件下样本一致, 最大值出现位置为λ ex/λ em=320 nm/470 nm。
由上述分析可知, 存储前和存储后猪肉的三维荧光光谱图中出现了荧光峰Peak A; 在存储过程中猪肉的三维荧光光谱图中出现了另一个荧光峰Peak B。 上述两个荧光峰所对应的主要荧光物质及其荧光强度的变化规律如下。
2.2.1 Peak A荧光强度平均值变化规律
根据荧光峰Peak A的位置, 并结合已有的文献报导可知, Peak A为类蛋白荧光, 对应的主要荧光物质为色氨酸[11]。 不同存储温度条件下, Peak A在λ ex/λ em=250~310 nm/300~400 nm区域内荧光强度的平均值(
此外, 从图中还可以看出, 存储温度不同,
2.2.2 Peak B荧光强度平均值变化规律
20和4 ℃存储温度条件下, Peak B在λ ex/λ em=300~450 nm/400~550 nm区域内荧光强度的平均值(
此外, 从图中还可以看出, 存储温度不同,
(1)不同温度存储条件下, 冷鲜猪肉肥肉三维荧光光谱图中均含有两个明显的荧光峰(Peak A和Peak B), 它们所在位置的激发波长(λ ex)和发射波长(λ em)范围分别为: λ ex/λ em约为250~310 nm/300~400 nm和λ ex/λ em约为300~450 nm/400~550 nm。 初步判断Peak A为类蛋白荧光, Peak B为脂质氧化产物荧光。
(2)不同存储温度条件下, 样本的荧光峰有着相同的变化趋势。 随存储时间的增加, Peak A在λ ex/λ em=250~310 nm/300~400 nm区域内荧光强度的平均值(
(3)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|