作者简介: 王阿美, 女, 1993年生, 南昌大学食品科学与技术国家重点实验室硕士研究生 e-mail: 13177787828@163.com
用干法制备糖基化产物。 人血清白蛋白(HSA)与葡萄糖质量比1:1, 溶解混和均匀, 经48 h冷冻干燥, 根据不同反应时间得到20个样本。 旨在联合多光谱学技术(紫外、 荧光、 近红外、 红外和圆二色光谱(CD光谱))分析人血清白蛋白糖基化前后二级三级结构和官能团的变化信息, 以及分析不同反应时间对HSA糖基化产物结构特性的影响。 实验结果表明: HSA与葡萄糖在干热条件下极易发生糖基化反应; 随反应时间延长, 蛋白质紫外吸收强度减弱, 内源荧光吸收强度增强, 糖基化反应增强, 美拉德反应程度提高, 蛋白质二级三级结构相应发生变化。 反应到140 min左右时, 美拉德反应前期糖基化反应完全, 生成Amadori产物, 进一步加热反应到220 min左右, 反应进入中后期, 开始生成醛酮类物质, 反应到280 min左右, 蛋白质氨基酸与羰基化合物发生脱羧、 脱氨反应。
In this study, human serum albumin (HSA) glycated products in dry processing, HSA and glucose were mixed into solution with mass proportion of 1:1, free-drying for 48 h, totally 20 samples were obtained according to different reaction times. This study mainly used multi-spectral technology (UV, fluorescence, near infrared spectroscopy, infrared spectroscopy, CD spectroscopy) to analyze the changes of protein secondary tertiary structure, functional groups after glycation of HSA, glycated product and progress of protein. The results show that, the glycation process is easy to occur when HSA was mixed with the glucose in hot and dry conditions, with the increase of reaction time, UV absorption intensity weakened, fluorescence absorption intensity increased and reveal the higher degree of glycation and Maillard reaction, the secondary tertiary structure of protein had small changes. The reaction took about 140 min, the glycation was complete, the Amadori product was formed, and then was further heated to about 240 min, the reaction entered the middle and late period, and the aldehydes and ketones were formed. The reaction took about 280 min, protein amino groups and carbonyl compounds occurred decarboxylation and deamination.
人血清白蛋白(human serum albumin, HSA), 是由 585个氨基酸组成的单链多肽, 相对分子质量为66 kDa, 含有67%的α -螺旋, 无β -折叠结构, 具有多个分子结合位点, 其中有58个赖氨酸是糖基化反应结合位点。 在人体肝脏中合成, 主要存在于血浆中, 占血浆蛋白含量的60%, 对于维持血浆渗透压, 调节人体代谢有重要作用[1]。
非酶糖基化反应是蛋白质美拉德反应的第一步, 是蛋白肽链中的亲核氨基与羰基化合物进行的非酶羰氨脱水缩合反应, 生成可逆的Amadori产物, 在一定条件下会进一步发生氧化、 脱水、 裂解, 最后经过一系列的反应生成糖基化终产物(advanced glycation end-products, AGEs)。 AGEs是生物体液中高血糖的前体反应物, 而高血糖血症正好是糖尿病的长期并发症, AGEs的反应进程间接的影响着糖尿病的并发情况与治疗手段[2]。 此过程发生在人体血液中, 能使蛋白质的构象发生变化, 进而影响蛋白的生理功能特性, 对人体内物质的新陈代谢和运转产生不同程度的影响[3]。 该反应进程受到很多因素的影响, 如糖浓度、 反应持续时间、 反应的阶段等。
因此, 采用简单有效的手段监测HSA糖基化进程成为研究的重点和热点, 此前很多科研人员采用不同的方法来监测糖基化反应过程, 如Jeanethe等发现高效亲和色谱是一种很好的监测糖基化反应进程的手段; 糖基化反应的进程会影响HSA和长链脂肪酸的结合位点[4]。 Paul等通过紫外光谱结合高效液相色谱研究发现, α -羰基醛是形成Amadori的重要前提物质, 并且在体外其浓度和Amadori的生成量呈正比关系[5]。 已报道的研究主要集中在色谱和光谱联合监测糖基化反应进程及其相互作用位点信息。 然而色谱仪器耗材贵, 提供的信息也相对有限, 单纯的光谱学监测HSA糖基化反应的研究较少。 蛋白质在紫外区域有特定的吸收峰; 其芳香族氨基酸残基在特定的波长下激发会有特定的发射波谱, 利用近红外光谱分析蛋白质糖基化产物化学键的强度、 化学组成、 电负性和含氢基团的信息, 可以得到光谱中微弱的化学成分的变化信息。 多光谱联用, 能简单、 高效、 快速的获取HSA在糖基化反应过程中的结构及其官能团变化, 监测HSA糖基化反应进程。
通过荧光、 紫外光谱分析蛋白质的三级结构, CD光谱监测蛋白质的二级结构变化特点, 近红外光谱分析人血清白蛋白含氢基团的变化信息, 联合红外光谱进一步分析HSA糖基化后的官能团变化信息, 根据官能团信息分析糖基化产物的生成情况, 并监测糖基化反应进程。 利用多光谱, 联合分析蛋白质糖基化修饰变化信息, 探讨HSA反应时间和反应进程之间的规律, 为HSA糖基化修饰研究提供重要的理论和技术支撑。
人血清白蛋白(HSA, 66 kDa)购于Sigma公司, D-葡萄糖(超级纯, 含量99.5%)购于阿拉丁试剂有限公司; 三羟甲基甲胺(Tris), 盐酸(HCl)等其他试剂均为国产分析纯。 U-2910紫外-分光光度计、 F-7000荧光光谱仪和U-4100可见-紫外-近红外精密级光谱仪, 日本HITACHI公司; Nicolet5700傅里叶红外光谱仪, 美国Thermo Nicolet 公司。 MOS-450圆二色光谱仪, 法国Bio-Logic公司。
1.2.1 样品制备
HSA与葡萄糖质量1:1混匀, 采用100 mL pH 7.4的0.1 mol· L-1 Tris-HCl缓冲溶液溶解, 蛋白浓度20 mg· mL-1。 分装20个离心管, 48 h真空冷冻干燥。 冻干样放置饱和KI溶液的密闭容器内(相对湿度70%), 50 ℃反应, 20 min取出样品, 透析。
1.2.2 紫外、 荧光光谱分析
紫外分光光度计扫描蛋白稀释样品, 波长范围230~400 nm, 扫描速度200 nm· min-1, 步幅5 nm。 内源荧光参数: 激发波长270 nm, 发射波长300~370 nm, 步幅5 nm。
1.2.3 CD光谱分析
蛋白浓度1 mg· mL-1, 扫描范围190~250 nm, 扫描速度30 nm· min-1, 数据间隔1 nm。
1.2.4 近红外光谱分析
取样20 mg左右, 压片, 光谱仪扫描。 扫描范围: 2 500~800 nm。
1.2.5 红外光谱分析
取样2 mg左右, 200 mg干燥的溴化钾粉, 研磨混合均匀。 研磨好的粉末压片, 光谱扫描范围4 000~400 cm-1, 扫描次数为32次, 分辨率4 cm-1。
图1(a)显示HSA的紫外吸收光谱在280 nm处有最大吸光值, 表明分子中含有吸收紫外波长的基团, 如芳香族氨基酸(酪氨酸、 色氨酸和苯丙氨酸)。 另外, 蛋白质糖基化产物羟甲基糠醛, 在280 nm附近也有紫外吸收[6]。 不同样品的峰形变化不明显, 但是随着反应时间的增大, 最大吸收峰强度降低。 说明在反应过程中, 蛋白质被糖基化修饰, 其蛋白质的三级结构发生了改变, 一方面疏水基团被隐藏, 另一方面修饰基团掩盖了酪氨酸、 色氨酸、 苯丙氨酸等发色氨基酸残基使得紫外吸收减弱。
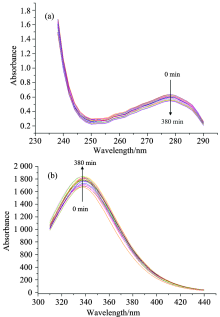 | 图1 不同时间对HSA糖基化产物紫外(a) 和荧光(b)光谱的影响Fig.1 The effects of time on the ultraviolet (a) and fluorescence (b) spectra of HSA glycation products |
蛋白质荧光主要来源于酪氨酸, 色氨酸和苯丙氨酸, 酪氨酸在280 nm左右有最强吸收峰, 色氨酸在340 nm左右有最强吸收峰[7]。 图1(b)显示随着反应时间的延长, HSA糖基化产物的内源荧光强度增加, 没有红移和蓝移现象发生。 随着时间的延长, 蛋白质发生进一步的糖基化、 氧化等反应导致色氨酸等发色基团掩埋到分子内部, 不容易暴露到溶液中, 而导致荧光强度增加, 同紫外光谱的结果一致。 因此样品荧光强度与糖基化程度没有直接的联系, 而是与蛋白质的聚合和糖的结合有关[8]。
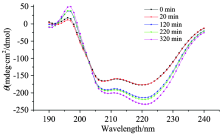
CD光谱是分析蛋白质二级结构变化的主要方法之一。 图2为不同反应时间得到的HSA糖基化产物二级结构。 在208 nm(肽键的π — π * 跃迁)和225 nm(肽键的n— π * 跃迁)处有两个明显低峰, 表明蛋白质中明显存在α -螺旋结构, 其α -螺旋的不稳定性和无规则卷曲的含量都会增加200~220 nm峰的强度[9]。 208和220 nm处峰的强度逐渐减弱, 峰形和峰位置并没有发生变化, 表明加热时间虽然对蛋白质有一定影响, 但是在380 min的反应时间内, α -螺旋结构仍然占主导, 蛋白质的二级结构没有发生较大的变化。 CD光谱中192 nm处的正值峰也是α -螺旋结构的一个典型的特征, 在197 nm处出现的最大负值说明蛋白质中存在一定量的β -折叠结构。 当反应时间达到120 min时, CD光谱的峰值明显增大, 表明此时β -折叠结构增加[9]。
随着糖基化时间的延长, α -螺旋结构含量前期变化幅度不大, 到达220 min时, 开始出现下降趋势, 300 min时又开始回升到最初含量, 同时β -折叠含量在220 min时增加。 β -转角和无规则卷曲变化不明显(图3所示)。 蛋白质的二级结构有小范围的变化, 但是α -螺旋结构仍然是其主要结构。 蛋白质的α -螺旋减少, 表明蛋白质在糖基化反应过程中, 反应产物导致分子间和分子内氢键破坏[10], α -螺旋结构在一定范围内舒展, 结构变得疏松, β -折叠相应增加。
近红外光谱主要是由含氢基团X— H (X=C, N, O, S)振动倍频和合频吸收产生, 不同基团的吸收强度不同, 随着样品成分含量的变化, 其光谱的特征峰也不同。 970, 1 450和1 940 nm附近主要是O— H键倍频吸收峰, 合频吸收主要在1 190和1 940 nm附近, 其中1 940 nm吸收很强, 在1 190 nm较弱。 N— H键的近红外吸收的伸缩振动一级倍频在1 500 nm附近、 伸缩振动与弯曲振动的组合频在2 000, 1 080, 1 600 nm附近。 芳族胺的N— H键的1 970 nm处有组合频谱带、 1 450 nm与1 490 nm附近为反对称伸缩和对称伸缩的一级倍频, 1 020 nm为对称伸缩振动二级倍频。 C— H二级和一级倍频的吸收峰在1 640和1 220 nm附近, 2 300 nm处是混合吸收。
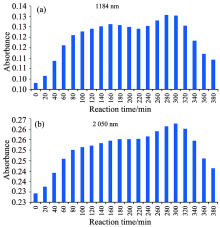
糖基化过程是蛋白质氨基和糖分子羰基缩合生成Amadori产物的过程, 即R— C=O与R— NH2脱水缩合生成R— C=NH— R 后经过分子重排生成Amadori产物, 即R— CH2— NH— R。 随后Amadori 产物进一步发生烯醇化反应, 生成醛酮类物质。 所以糖基化反应主要监测的近红外吸收为2 100~2 200 nm的R— NH2的吸收峰, 2 200 nm左右的— CHO的吸收峰, 1 184和1 940 nm处的O— H键的合频吸收峰, 以及1 510, 2 050和2 182 nm处的N— H的倍频吸收(图4所示)。
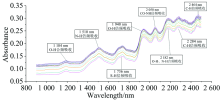 | 图4 不同反应时间得到的HSA糖基化产物近红外光谱Fig.4 Near infrared spectra of HSA glycation products at different reaction times |
随着反应时间的延长, 1 184, 1 510, 1 736和1 940 nm吸收峰强度增大; 当反应时间为160 min时第一次达到最大值, 在280 min左右峰值第二次达到最大, 随后呈下降趋势。 1 184 nm处吸光值变化趋势如图5(a)。 1 184和1 940 nm是水分子O— H的两个最大吸收峰值, 吸收值增大表明糖基化过程脱水生成席夫碱, 160 min吸收值最大, 此时糖基化反应程度最大。 在220 min处有一个最小峰值, 说明反应进入了美拉德反应中期, 席夫碱含量减少。 随后在280 min左右第二次出现最大峰值, 美拉德反应中期糖胺脱水生成糖醛, 有相应的水分子吸收。 280 min后糖基化反应到达中后期, 各种醛酮及杂环化合物生成, 水分子O— H吸收相应减小。 1 736 nm处S— H的变化表明HSA在糖基化反应过程中, 胱氨酸二硫键会和半胱氨酸巯基相互转化, 总体上二硫键受热断裂生成巯基数量居多, 使得巯基含量整体含量增多。
由O— H和N— H等含氢基团的吸收值, 得出HSA在50 ℃反应。 根据近红外光谱监测的信息得出, 在反应时间为160 min糖基化完全, 220 min左右进入美拉德反应中期, 280 min进入美拉德反应后期。
红外光谱中酰胺Ⅰ 区、 酰胺Ⅱ 区和酰胺Ⅲ 区是用于分析蛋白质的特殊结构区域, 其中酰胺Ⅰ 区的吸收峰最容易受蛋白质二级结构的影响, 与蛋白质的二级结构密切相关。 1 650 cm-1左右是酰胺Ⅰ 区的特征吸收峰, 主要是由α -螺旋中肽链的C=O伸缩振动引起; 1 550 cm-1左右是酰胺Ⅱ 区, 1 400~1 200 cm-1是酰胺Ⅲ 区, 由C— N的伸缩振动和N— H的弯曲振动产生[11]。 HSA的酰胺Ⅰ 区、 Ⅱ 区和Ⅲ 区的吸收峰分别出现在1 660, 1 540和1 400 cm-1左右, 如图6和表1所示。
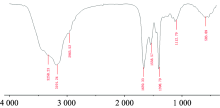 | 图6 20 min HSA糖基化产物红外扫描光谱Fig.6 Infrared spectra of HSA glycation products at different reaction times |
| 表1 红外主要特征吸收峰 Table 1 The main infrared absorption peaks (cm-1) |
1 100 nm处的峰是由于糖的O— H和C— C键的伸缩振动产生的, 表明蛋白质发生了糖基化修饰作用。 反应时间为100~140 min时, 585 cm-1左右的不饱和键振动峰发生蓝移, 移至613 cm-1左右(表1), 说明糖基化生成了新的不饱和键, 即产生Amadori 产物, 不饱和烯醇式糖胺, 为美拉德反应初期产物。 2 960~2 800 cm-1处是醛基的特征吸收峰, 表明反应到了美拉德中期, 形成醛类物质。 2 400~2 300 cm-1为监测过程中二氧化碳的吸收峰。
如图7, 随着加热时间的增强, 3 300~3 100 cm-1吸收峰增强, 范围扩宽, 表明O— H伸缩振动和游离N— H的伸缩振动加强, 这一变化是由于葡萄糖和蛋白质游离氨基酸胺基在糖基化反应条件下形成席夫碱有关。 所以反应到60 min时, 峰的强度和宽度明显增强。 然而席夫碱会随着反应的程度加强形成糖胺, 反应到140 min, 峰值最大最宽, 即糖基化反应完全, 进入美拉德反应中期, 此时N— H基团增多, 糖基化后的氨基酸的残基也会在蛋白质中检测到。 在随后的反应时间里峰值也有相应减弱, 说明美拉德反应进入中后期。
由图7可知, 随着糖基化反应时间的增强, 酰胺Ⅰ 区1 660 cm-1处峰强度先增强后减弱再增强, 表明周围的基团聚合数量会先增加后减少再增加, 表明了美拉德反应进程中基团的含量变化趋势。 说明随着反应时间的增强, 糖基化反应程度增强, 糖基化反应时期氨基与羟基发生脱水缩合, 经分子重排生成果糖胺, 酰胺吸收峰增强, 反应到140 min, 峰值最大, 糖基化程度最大, 糖胺含量多; 反应到220 min, 吸收峰值减小, 到达美拉德反应中期, 糖胺烯醇化生成了醛酮类物质; 反应到260 min, 酰胺吸收带峰值又开始有增强, 进入美拉德反应后期, 蛋白质氨基酸与羰基化合物发生脱羧、 脱氨反应。 此结果与近红外结果相符。
不同反应时间会使HSA分子之间发生进一步的折叠和聚合, 蛋白质二级结构三级结构发生微小变化, 使得蛋白质结构疏松, 紫外吸收减弱, 内源荧光吸收强度增强。 但是380 min的加热时间未在很大程度上改变蛋白质的结构和性质。 根据CD光谱、 近红外光谱和红外光谱结果分析得到, 随着反应时间的延长, HSA糖基化程度会逐渐增大, 反应时间增大到140 min左右, 糖基化程度最大, 生成Amadori产物; 反应时间达到220 min时, 到达美拉德反应中后期, 生成醛酮类物质, 反应到280 min左右, 蛋白质氨基酸与羰基化合物发生脱羧、 脱氨。 综合上述可以得出结论多光谱联合可以用来分析HSA糖基化修饰进程, 探讨反应时间和反应进程之间的规律, 为HSA糖基化反应后期修饰位点等研究提供重要的理论和技术支撑。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|