作者简介: 姜泽明, 1991年生, 北京林业大学材料学院硕士研究生 e-mail: jzm912@qq.com
为了评价现有的落叶松树皮原花青素中试生产过程, 了解生产过程中各工艺流程对产品组分含量的影响, 将各工艺处理后所得样品进行了一维红外光谱(fourier transform infrared spectroscopy, FTIR)、 二阶导数光谱(second derivative infrared spectroscopy, SD-IR)及二维相关光谱(two-dimensional correlation infrared spectroscopy, 2D-IR)三级鉴定研究。 实验结果表明, 一维红外光谱中各样品光谱峰形较为相似, 一些物质的特征峰消失或者偏移反映出样品组分含量的变化。 随着生产工艺的进行, 样品纯度、 结构越来越接近原花青素标准品, 但是仍含有少量其他物质。 通过二阶导数谱进行分析, 验证了一维光谱分析的结果, 而且随着进一步提高谱图分辨率, 将一维谱图中没有显现出来的差异直观的表现出来。 在波数为830~1 310 cm-1的二维相关光谱中, 各过程样品自动峰出现的位置、 个数以及强度有了更为显著的差异。 通过红外三级光谱鉴定可以得出: 随着生产过程的进行, 样品中所含原花青素纯度越来越高, 最终得到的样品结构与原花青素标准品极为相似, 但是产品中仍然含有少量杂质。
In order to evaluate existing producing process of larixgmelinii bark proanthocyanidins, understand the changes of the component content in each step, we used Tri-level infrared spectroscopic to identify, which employed the Fourier transform infrared spectroscopy(FTIR), the second derivative infrared spectroscopy(SD-IR) and two-dimensional correlation infrared spectroscopy. The results indicated that the FTIR spectrograms of the product of each process in shape was very similar. We found that some substances characteristic peak disappeared or offseted, reflecting the changes of component content of samples. With the improvement of production process, the purity and structure of samples have been more and more near to the standard sample, but still contained some other substance. The second derivative infrared spectroscopy not only tested and verified the analysis results of FTIR, but also improved the resolution ratio which was helpful to show differences that were not manifested in FTIR. Within the scope of the 830 to 1 310 cm-1,2D-IR has more significant differences in positions, strength and numbers of automatically peaks. Therefore, we could conclude from the Tri-level infrared spectroscopic identification that the purity in proanthocyanidins is higher and higher with the improvement of production process. And the structures of samples we get finally are similar to that of standard sample, but still contains a small number of impurities
落叶松, 属于松科, 在我国东北的大小兴安岭, 长白山, 天山东部, 云南的西北部等地区有大量分布[1]。 兴安落叶松(Larixgmelinii)是其中的一个品种, 而且占东北地区针叶树木总量的40%左右[2]。 其树干端直, 节少, 耐水耐寒, 适应性强, 易于存活; 材质坚韧, 抗压并耐腐烛, 具有较高的工艺价值, 可用作桥梁、 建筑、 家居等工业原料[3]。
落叶松树皮是我国重要的林业副产物, 其提取物中含有大量原花青素类物质, 并且包括没食子酸、 原儿茶酸、 阿魏酸、 香草酸等四十余种成分以及葡萄糖脂等其他对人体有益的化学与生物活性成分, 是一种复合型抗氧化剂, 具有强清除自由基、 抗衰老, 保护人体健康的作用, 在保健品、 食品、 化妆品及医药等领域具有广阔的应用前景。
傅里叶变换红外光谱法以整体特征性强, 极高的分辨率, 简单的采样技术以及优越的联机扩展性, 已被作为生产过程分析的重要手段之一[4]。 近年来, 二维红外相关光谱技术的发展, 极大地提高了红外光谱的分辨率, 增强了谱图的识别能力, 也拓广了红外光谱技术的应用[5]。 其中, 清华大学孙素琴等人建立了“ 红外光谱三级鉴别” 分析技术, 将传统红外光谱、 二阶导数光谱和二维相关红外光谱三者结合起来对未知混合物进行分析。 二阶导数光谱通过对吸光度值求导, 放大细微之处的差别; 二维相关红外光谱通过控制某一个变量(本实验为温度), 记录在变化条件下的吸收峰, 从而进一步放大差异。 通过此分辨率逐渐增强、 差异逐步明显的技术, 实现混合物样本的鉴别区分[6, 7, 8, 9, 10]。 本工作利用“ 红外光谱三级鉴定” 分析技术对内蒙古森工栲胶制品有限责任公司现有的落叶松树皮原花青素中试生产线进行生成过程分析。 预期目标为了解生产各步骤对树皮中组分含量变化的影响, 讨论每个生产环节的意义。
材料: 落叶松树皮、 树皮粉、 原花青素提取物粗品、 纯化后纯品等样品由内蒙古森工栲胶制品有限责任公司提供; 原花青素标准品, 天津市尖峰天然产物研究开发有限公司。 仪器设备: Spectrum GX型傅里叶变换红外光谱仪, 美国Perkin Elmer公司。
1.2.1 落叶松树皮及粉碎后树皮粉的红外分析
将落叶松树皮进行粉碎, 粉碎后的树皮粉经过20~100目筛。 (以上实验部分由内蒙古森工栲胶制品有限责任公司协助完成)。 随机选取少量树皮及树皮粉进行红外光谱扫描分析。
1.2.2 脱脂后树皮粉的红外分析
将粉碎后的树皮粉进行超临界CO2萃取脱脂, 具体步骤如下: 取1 200 g树皮粉投入三个24 L萃取釜中, 调节CO2流速至10 L· min-1、 萃取温度至35~50 ℃、 萃取压力至30~40 MPa; 通入CO2并保持出料阀关闭, 进行脱脂; 0.5 h后打开出料阀, 收集所脱出的脂类物质, 开始每隔5 min打开出料阀收集一次脂类; 至几乎没有脂类溶出时, 结束脱脂[11]。
随机选取脱脂后的树皮粉及萃取出的脂类物质进行红外光谱扫描分析。
1.2.3 浸提后树皮粉的红外分析
将脱脂后的树皮粉加入恒温提取罐中, 进行乙醇浸提。 具体步骤如下: 将65 kg体积分数为75%的乙醇溶液倒入提取罐中, 加盖, 打开三个加热器, 开始循环水加热; 待提取罐中的乙醇溶液温度达到50 ℃时, 将8 kg的脱脂树皮粉(含水率< 10%)投入乙醇溶液中, 投料同时搅拌使其均匀混合, 投料结束后, 保持水循环维持提取罐内温度于50 ℃, 定时搅拌混合液并监测提取罐内温度; 静态浸提2 h后, 打开出液阀门, 收集提取液。 待液体流尽后打开出料阀, 将含有残余液体的树皮粉收集, 置于挤压机中, 挤压收集提取液。
将经过提取之后的落叶松树皮粉晒干, 再随机抽取适量提取后树皮粉进行红外光谱扫描分析。
1.2.4 浓缩后原花青素产品的红外分析
将提取后乙醇溶液加入单效浓缩器中, 进行真空浓缩。 具体步骤如下: 设定恒温热水罐加热温度为50 ℃, 打开三个加热器, 开启循环水加热; 开启真空泵, 打开真空阀门, 利用真空将提取液通过进料阀注入蒸发器中(液面与视镜下方平齐即停止进料), 打开循环冷凝水; 通过控制加热器稳定换热器中的蒸汽温度在40 ℃, 同时, 通过水循环真空泵稳定真空度在-0.086 MPa; 待蒸发器中的液位低于锥形口时, 停止蒸发, 收集浓缩后提取液。
将收集到的浓缩提取液烘干, 烘干后产品即纯度在70%左右的原花青素粗品。 随机选取适量粗品进行红外光谱扫描分析。
1.2.5 喷雾干燥后原花青素产品的红外分析
将浓缩后提取液加入喷雾干燥器中, 进行喷雾干燥。
随机选取干燥后的原花青素产品进行红外光谱扫描分析。
1.2.6 大孔树脂纯化后原花青素产品的红外分析
将浓缩后提取液稀释到一定浓度; 在设定流速下进行上样2BV(1BV为吸附柱中大孔树脂的体积); 上样结束后用5BV蒸馏水清洗; 加入体积分数为70%的乙醇2BV以特定流速进行洗脱; 收集洗脱液烘干即为原花青素纯品。
随机选取适量原花青素纯品进行红外光谱扫描分析。
1.2.7 红外光谱检测
将用溴化钾压片法制得的待测样品装入温度控制器(北京朝阳自动化仪表厂CKW2-Ⅱ 温控仪), 按照2 ℃· min-1的升温速度对其进行加热。 从50~120 ℃, 每隔10 ℃测一次红外光谱, 获得待测样品在微扰下的一系列红外光谱, 光谱范围为4 000~400 cm-1, 分辨率4 cm-1, 扫描信号累加次数为16次, 扫描时实时扣除了水和二氧化碳的干扰。 通过Perkin Elmer公司Spectrum v3.2操作软件得到二阶导数谱, 以13点平滑处理获得; 应用清华大学自行设计的二维相关分析软件对动态光谱图分析处理得到相应的二维红外光谱图。
2.1.1 树皮粉碎过程红外光谱分析
在粉碎前的树皮谱图中1 035 cm-1处的C— O伸缩振动峰具有较高强度, 而粉碎后和原花青素标准品在此处的吸收峰值变为1 059 cm-1, 且峰强明显降低, 推断此处为纤维素、 半纤维素特征峰, 因为两者均为长链分子, 粉碎过程对其影响较大, 即树皮中纤维素、 半纤维素含量高, 吸收峰强, 但是在粉碎过程中纤维素与半纤维素长链结构被破坏导致峰位移动, 且含量有一定损失, 使得相对峰强变弱。 此外, 720~800 cm-1处的波峰信息反映C— C面内摇摆的情况, 碳链越长, 该处吸收峰越接近720 cm-1。 谱图中树皮粉碎前, 721 cm-1处有较为明显的吸收峰, 但是粉碎过后该峰消失, 780 cm-1处吸收峰增强, 由此可以判断该处的长链烷烃也被破坏。
2.1.2 树皮脱脂过程红外光谱分析
对比树皮粉脱脂前后的光谱图, 两者之间的区别在于1 734和1 740 cm-1处的吸收峰, 此处为羰基吸收峰。 脱脂前的树皮粉中此处的吸收峰为1 734 cm-1, 此时羰基主要存在于树脂、 黄酮类等多种物质中。 超临界脱脂后, 脂类物质基本可以完全脱除[12], 此时该处的吸收峰移到1 740 cm-1, 推测造成峰位移动的原因是树皮中大量的脂类被脱出后组分与羰基构成的变化。 此外, 张明等证明超临界脱脂树皮粉的意义在于破坏了树皮中脂类物质而对其他有效成分保护, 醇提脱脂后的树皮粉要比未经脱脂得到产品的得率与纯度方面都有更好的效果。
2.1.3 树皮醇提浓缩过程红外光谱分析
通过对比乙醇提取后的树皮粉和原花青素提取物。 观察可以发现, 2 924 cm-1处的亚甲基C— H反对称伸缩振动峰与2 853 cm-1处的亚甲基C— H对称伸缩振动峰, 从原始树皮原料到脱脂后树皮粉的红外谱图上一直都存在, 但是在乙醇浸提之后的原花青素提取液中却突然消失, 推断这两个峰是树皮中糖类物质的吸收峰, 在提取过程中因不溶于乙醇而留在残渣之中。 此外, 还可以看出, 脱脂树皮粉中1 740 cm-1 处的羰基吸收峰在醇提物中明显降低, 且又在1 784 cm-1形成一个新的较弱的吸收峰, 以此推断在脱脂树皮粉中的1 740 cm-1吸收峰也是多种物质的混合吸收峰。 而且在乙醇浸提的过程中, 树皮粉中的原花青素类物质被提取出之后, 和原花青素标准品中的一些特征峰相似的峰型也变得愈加明显。
2.1.4 树皮纯化过程红外光谱分析
在原花青素浓缩液经大孔树脂纯化后的红外光谱图中。 可以看出纯化后产品的光谱图中的1 784 cm-1吸收峰依然存在, 但是在标准品的光谱图中却没有此特征峰。 查阅资料可知, Foo在研究发现了一种以组胺醇(vitisinol)为代表的一系列聚多酚类化合物, 而落叶松的原花青素光谱图在1 784 cm-1处的特征峰与这类聚多酚类物质一致, 因此推断落叶松树皮中提取的原花青素可能较葡萄籽中提取的原花青素标准品中含有更多的vitisinol类聚多酚化合物。 此外, 崔晓霞等对落叶松树皮中提取的原花青素进行了二阶红外光谱分析, 以更高分辨率放大谱图差异, 发现在1 784 cm-1处的二阶谱图出现了更多的峰, 也证明了树皮提取物中有一些结构相近的酚类及vitisinol类聚多酚化合物[13, 4]。
2.1.5 树皮干燥过程红外光谱分析
通过对比烘箱烘干样品⑧和喷雾干燥样品⑨两种浓缩液的干燥方式的红外光谱图。 两种烘干方式所得到产品的红外光谱图吸收峰基本一致, 且两者都具有较好的相似性。
2.1.6 原花青素生产过程红外光谱分析总结
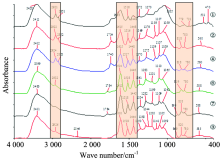
图1是对整套落叶松树皮提取原花青素的工艺包括: 粉碎、 脱脂、 提取浓缩、 纯化生产过程中的中间原料、 产品与原花青素标准品的红外光谱对比图, 分别为①, ②, ④, ⑥, ⑦, ③。 从图中首先可以看出2 922和2 852 cm-1处的变化为峰强逐渐减弱, 说明整个生产过程并不会提出树皮中的糖类物质。 其次, 分别观察1 615~1 400 cm-1之间的三处苯环的骨架振动吸收峰从树皮原料到原花青素标准品的具体变化趋势, 如表1。
| 表1 各中间产品的部分吸收峰值 Table 1 Some absorption peaks of the intermediate products |
从表1可以很明显可以看出, 随着整个生产过程的进行, 此三处吸收峰的峰值与标准品的峰值越来越接近, 产品纯度越来越高。 从图中890~720 cm-1低频指纹区的纵向趋势比较可以发现, 整个生产过程中间产品的该区域峰型与标准品的峰型越来越接近。 此外, 若以原花青素标准品谱图③为参考, 其相关系数为1.000 0, 其他各过程样品相对于③的相关系数见表2。
| 表2 各中间产品的相关系数值 Table 2 The correlation coefficient of the intermediate products |
系数越接近1.000 0, 相关性越好, 该组成成分就越接近于标准品。 从表2也可以很明显的看出, 随着生产过程的进行, 样品纯度越来越高。
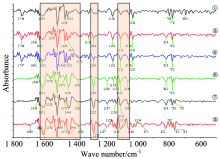
为更好地分辨红外光谱中重叠的吸收峰, 增强谱图特征性, 提高表观分辨率, 对原花青素生产过程中各原始红外谱图进行二阶求导。 图2为粉碎、 脱脂、 提取浓缩、 纯化生产过程中原花青素在500~1 800 cm-1区域的二阶导数红外光谱图, 分别为①, ②, ④, ⑥, ⑦, ③。 由图可以看出, 许多特征峰都被分解为多个峰, 说明落叶松树皮生产过程中各中间物都含有一些结构相近的物质分子。 相比一维红外光谱图, 1 300~1 000 cm-1区域内增加了很多谱峰, 说明红外光谱上这一范围的吸收峰由酚类分子的O— H弯曲振动吸收与C— O伸缩振动吸收等多种成分组成, 并且兼具有苯环的骨架振动峰。 例如: 苯骨振动从1 614, 1 517, 1 468, 1 452 cm-1到1 643, 1 611, 1 562, 1 518, 1 470, 1 446 cm-1, 特征峰增多, 且1 611和1 446 cm-1等处的峰明显增强至趋于稳定。
在提取液浓缩过程中, 1 650 cm-1附近到1 800 cm-1区域的吸收峰基本消失, 1 611, 1 446, 1 285, 1 113 cm-1等处吸收峰明显增强。 对比原花青素标准品谱图, 提取浓缩之后的变化的谱图与原花青素标准品更为相似, 由此可以说明乙醇提取已将大部分原花青素提取出来。 对比纯化过后的样品与原花青素标准品谱图可以发现, 纯化后样品谱图中1 611和1 446 cm-1峰接近等高, 819和780 cm-1等高, 而原花青素标准品谱图中1 605和1 441 cm-1等高, 821和765 cm-1等高, 且峰强明显增加。 在1 156~971 cm-1之间也增加了许多密集的较为明显的峰, 加之一维谱图中的相关系数比较, 这些足以说明整个生产过程一直到纯化过后得到的样品成分虽然很接近原花青素标准品, 但是仍存在一些杂质。
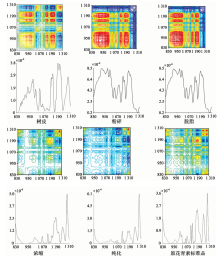
二维红外光谱法是指将传统红外引入外界扰动, 将传统光谱在第二维上展开, 以获得样本更多的信息, 提高样本分辨率的方法。 本课题是以热为微扰诱因, 所获得的二维相关红外光谱(本实验选取了830~1 310 cm-1区域), 反映的是原花青素提取过程各组分的有关基团在升温过程中对温度的敏感程度。 图3是各过程样品二维红外相关光谱图及自动峰强度曲线图。 由图3可以看出, 生产过程中各样品谱图对角线上自动峰数目均不同, 分别有16, 14, 13, 12, 14, 13个较为明显的自动峰。 原始树皮最强峰出现在1 200 cm-1附近。 粉碎后树皮以及脱脂后树皮二者峰形比较相似, 均在920~980 cm-1之间出现了最强峰, 并且12 00 cm-1附近的自动峰明显减弱。 1200 cm-1是C— O伸缩振动, 粉碎过程中大量C— O键被破坏, 自动峰强减弱, 这也验证了前述推论。 920~980 cm-1是苯环上C— H的弯曲振动, 说明在粉碎后树皮和脱脂后树皮中含有大量苯环, 且苯环对热变化较为敏感。
提取液浓缩、 纯化得到的样品和原花青素标准品二维谱图中最强峰均出现在1 290 cm-1附近, 三者谱图极为相似。 在提取浓缩过程中, 自动峰的峰强、 位置和数目均有很大改变。 920~980 cm-1区域最强峰消失, 1 200 cm-1附近最强峰移到了1 290 cm-1, 谱图更接近于原花青素标准品, 充分说明提取过程中大部分原花青素已被提取出来。 对比纯化后所得样品与原花青素标准品二维相关谱图, 二者虽然极为相似, 但是在1 100~1 270 cm-1之间各峰强度有很大不同, 说明虽然纯化过后所得样品成分已十分接近原花青素标准品, 但还是有些许杂质, 纯度没有达到100%, 这也与前述结论相呼应。
红外的三级鉴定是一种能够快速准确识别、 鉴定不同混合物的方法。 通过一维红外光谱、 二阶导数光谱及二维相关光谱对原花青素生产工艺过程进行分析评价, 我们得出现有的生产过程所生产的原花青素纯度较高, 一维谱图中纯化过后的样品谱图与原花青素标准品相关系数高达0.96, 但是依然含有少量杂质。 二维与二阶导数谱图更是放大了微小差异, 从而分析出各过程组分含量的变化。 这证实了通过此过程提取的原花青素随生产过程的进行纯度逐渐增大, 最后通过纯化得到的样品已十分接近原花青素标准品, 并且对原花青素提取工艺过程的优化提供了理论依据。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|