作者简介: 刘明宝, 1982年生,陕西省尾矿资源综合利用重点实验室教授 e-mail: lmb74@163.com
石煤钒矿中的含钒云母是钒的重要来源矿物之一, 氧化剂及氟化物的存在对含钒云母中钒元素的浸出具有重要的促进作用, 但其影响机理则一直未能完全明确。 以陕西省商洛市山阳县石煤钒矿为研究对象, 采用恒温水浴硫酸浸出工艺, 系统研究了氧化剂及第Ⅰ、 Ⅱ主族金属元素二元氟化物、 Na+/K+/
Vanadium-bearing mica in stone coal vanadium ore serves as one of the important vanadium source minerals. While the presence of oxidizing agents and fluorides significantly enhances vanadium leaching efficiency, the underlying mechanisms remain incompletely understood. This study focuses on the ShanYang stone coal vanadium deposit in Shangluo, Shaanxi Province. Using a thermostatic waterbath-sulfuric acid leaching technique,the effects of oxidizing agents and fluoride systems, including binary fluorides of GroupⅠ, Ⅱ, Ⅲ metals, hydrofluorides (K+/Na+/
钒是一种重要的战略金属, 在化工、 冶金、 国防、 新能源、 新材料等新兴领域具有不可替代的作用, 被誉为“ 工业味精” 、 “ 工业维生素” [1, 2]。 自然界中钒元素的来源主要包括钒钛磁铁矿和石煤钒矿两大类, 其中石煤钒矿为我国特有的钒资源, 储量超过600亿吨, 主要分布在湖北、 湖南、 陕西、 浙江、 江西等地。 石煤钒矿中V2O5品位在0.5%~1%之间, 钒金属储量在1.2亿吨左右, 占全国钒资源总量的87%左右, 远远超过钒钛磁铁矿中的钒储量[3]。 因此, 含钒石煤中钒资源绿色高效回收工艺的研发对我国钒产业的高质量发展具有重要的实际意义。 含钒石煤矿物成分复杂, 工业上主要采用焙烧-浸出、 直接浸出和加压浸出等化学选矿技术进行钒元素的高效回收。 三类技术中加压浸出仍然停留在实验室阶段; 焙烧工艺中的钠化焙烧已经被淘汰, 钙化焙烧对原料适应性能差, 空白焙烧则因排放出大量的二氧化碳而被许多地区明令禁止; 直接浸出过程中因无温室气体排放, 浸出酸液经净化后可循环利用, 从而被部分石煤提钒企业所青睐[4]。
石煤钒矿中的钒元素主要以V3+取代Al3+的形式赋存于云母矿物晶格中, 云母矿物晶格能较大, 难以破坏, 因此在含钒石煤的直接浸出过程中, 氧化剂及氟化物经常被用来作为促进剂以加速破坏云母矿物晶格, 从而提高钒元素的浸出率。 王振文等[5]研究了氯酸钠对石煤钒浸出的影响, 结果表明当氯酸钠加入量为3%时, 钒浸出率可提高12个百分点。 Yuan[6, 7]等研究了MnO2、 NaNO3等氧化剂对石煤钒浸出行为的影响, 结果显示当浸出体系中添加氧化剂后, 钒浸出率得到大幅提高的同时还可以在一定程度上降低硫酸用量。 通常认为V(Ⅲ )氧化后浸出的反应可表示为[8]
一般认为, 氟化物在石煤钒矿的硫酸浸出体系中通过生成HF而对含钒云母晶格起到腐蚀作用, 因此, 氟化物经常被用来作为石煤钒矿浸出过程的助浸剂[9]。 Zhang[9, 10, 11, 12]等研究了氟化钙在石煤钒浸出过程中的作用行为, 认为氟化钙在浸出过程中与硫酸生成的氢氟酸对含钒矿物的强破坏性促进钒浸出过程, 并推断出了20余个浸出过程可能发生的化学反应。 张成强[13]等采用氟化钙作为石煤钒矿直接浸出过程的助浸剂, 钒元素浸出率均得到大幅提高。 李崇[14]、 韩峰[15]等研究了NaF、 NH4F、 CaF2为助浸剂时钒的浸出行为。 不同学者的研究表明, 硫酸体系中氟化物存在时含钒云母的分解反应可用式(2)来表示[16]
由以上论述可看出, 氧化剂及氟化物对石煤钒矿中钒元素浸出的重要作用已经得到了广大研究者的普遍认可, 相关研究也推断出了浸出过程可能发生的化学反应, 但含钒云母的具体腐蚀路径则一直未能明确, 尤其是对氟化物的研究主要集中于CaF2, 对类型多样的氟化物的助浸规律缺乏系统性的认识。 鉴于此, 采用恒温水浴硫酸浸出工艺, 系统研究了氧化剂及二元、 三元氟化物对石煤钒矿中钒元素浸出的影响规律, 同时借助于SEM和Element Mapping等光谱学手段, 重点明晰了氟化物类型与含钒云母腐蚀路径的关系, 相关研究可为我国石煤提钒高效工艺的开发提供理论支撑和技术指导。
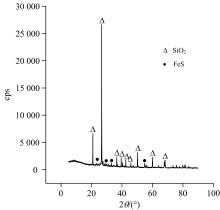
本试验所用石煤钒矿来自陕西省商洛市山阳县, 原矿多元素分析及XRD图谱分别如表1和图1所示。
| 表1 原矿化学多元素分析(wt%) Table 1 Muti-element analysis of the raw ore (wt%) |
由表1可知, 原矿中有价元素主要为钒, 含量(以V2O5计)为0.98%, 达到工业开发品位要求。 SiO2含量超过60%, 说明该矿主要为硅质矿物, 与XRD测试结果一致。 同时, 样品中硅质矿物的存在显示氟化物添加对提高浸出过程钒浸出率的必要性。 样品中碳含量接近14%, 远低于煤中碳含量, 因此, 该石煤钒矿燃烧热值较低, 不能作为能源原料应用。
| 表2 含钒矿物化学物相分析(wt%) Table 2 Phase analysis for vanadium-bearing minerals(wt%) |
| 表3 钒价态物相分析(wt%) Table 3 Phase analysis for vanadium state(wt%) |
由表2可看出, 接近94%的钒元素赋存在矿物晶格能较大的钒云母和白云母中, 浸出难度较大。 由表3可知, 所有钒元素中, 以V(Ⅲ )形式存在的占钒元素总量的82.53%, 该部分钒主要是以类质同象形式取代云母矿物晶格中的Al元素。
试验所用氧化剂为次氯酸钙[Ca(ClO)2], 购自阿拉丁生化科技股份有限公司, 工业纯。 所用氟化物主要有: 第一主族金属氟化物(LiF、 NaF、 KF、 CsF), 第二主族金属氟化物(MgF2、 CaF2、 SrF2、 BaF2), 氟氢化盐(KHF2、 NaHF2、 NH4HF2)、 氟硅(铝、 磷)酸盐[Na2SiF6、 (NH4)3AlF6、 Na3AlF6、 (NH4)2SiF6、 NH4PF6], 所有氟化物均购自麦克林生化科技有限公司, 纯度均为AR级别。 浓硫酸购自扬州市华富化工有限公司, 分析纯。 试验用水为实验室自制超纯水。
ϕ 240× 90型球磨机(武汉探矿机械厂), RW20型搅拌器(德国IKA公司), HH-2型数显恒温水浴锅(常州智博瑞仪器制造有限公司), Agilent-715型ICP-OES(安捷伦科技有限公司), ZEISS Sigma 360型电子扫描显微镜(德国蔡司公司)。
称取-0.074 mm粒级占75%的石煤钒矿100 g放入1 000 mL 烧杯中, 依次加入质量浓度为18%的H2SO4溶液200 mL, Ca(ClO)2和氟化物助浸剂, 将烧杯放入水温已升至80 ℃的水浴锅中, 调整搅拌器转速为400 rpm, 80 ℃恒温水浴下搅拌浸出4 h, 将浸出后矿浆过滤, 滤液稀释后采用ICP测定钒元素含量, 计算钒浸出率, 筛选特定条件下的浸出渣进行SEM分析和表面元素的Mapping扫描。
SEM工作电压为10 kV, 视野宽度为22.87 μ m, 工作距离为5.4 mm, 放大倍数为5 000, Element Mapping采用EDS模式进行分析。
矿浆氧化电位的提高, 有利于钒云母中Si— O键和Al— O 键的破坏, 因此, 试验探索了氧化剂对钒浸出率的影响。 在CaF2为原矿量的2%时, 氧化剂次氯酸钙对石煤钒矿浸出效果的影响如表4所示, 浸出渣的SEM及Al元素的Mapping分析如图2所示。
| 表4 氧化剂对石煤钒浸出效果影响(ppm) Table 4 Effect of oxidant on vanadium leaching (ppm) |
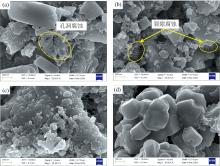
由表4可以看出, 当浸出矿浆中添加原矿量3%的Ca(ClO)2时, 矿浆中主要杂质元素除铁离子和钡离子以外均大幅增加, V离子浓度由6.86 ppm增加到11.97 ppm。 由图2(a)和(b)中浸出渣的SEM图谱可看出, 当矿浆中存在Ca(ClO)2时, 浸出渣“ 孔洞腐蚀” 和“ 裂隙腐蚀” 痕迹明显增加, 说明Ca(ClO)2的加入大幅提高了含钒云母的破坏程度, 从而使得钒离子得以从晶格中释放出来。 图2(c)和(d)浸出渣中Al元素的Mapping图谱也表明, Ca(ClO)2用量为3%时浸出渣Al元素丰度(0.72 wt%)明显低于无Ca(ClO)2时(1.52 wt%), 进一步说明氧化剂的存在促进了含钒云母的分解。
2.2.1 第一主族金属元素氟化物对钒浸出效果影响
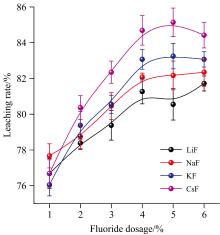
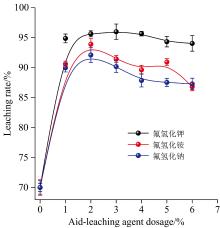
氧化剂Ca(ClO)2为原矿量的3%时, 第一主族金属氟化物类型及用量对石煤钒矿的浸出效果如图3所示。
由图3可知, 四种浸出体系中钒浸出率均随氟化物用量的增加而逐渐增大, 说明氟化物在浸出体系中生成的HF对云母矿物的腐蚀作用是提高钒浸出率的关键因素。 CsF体系中钒浸出率高于其他体系, 最高可达85.14%左右。 不同氟化物对钒浸出率的影响顺序为CsF> KF> NaF> LiF, 与第一主族金属元素离子半径大小成正比。 由湿法冶金相关理论可知[17, 18], 一价金属阳离子及铵根离子在高温及酸度较强的硫酸溶液中易于生成黄铁矾盐, 其反应方程式为:
2(Fe、 Al)(OH)SO4 +2(Fe、 Al)2(OH)4SO4+2M++2H2O=M2(Fe、 Al)6(SO4)4(OH)12(黄铁矾盐)+2H+, 其中; M=Li+、 Na+、 K+、 Cs+、
一价金属阳离子的存在可不断消耗矿浆中的Al3+、 Fe3+生成相应的黄铁矾盐, 阳离子半径越大, 生成的黄铁矾盐结晶性能越好, 越容易沉淀, 反应向右进行的趋势越大。 随矿浆中氟化物金属阳离子半径增大, Fe3+、 Al3+消耗量增加, 而矿浆中全部的Al3+和部分Fe3+均来自于云母矿物的分解, 因此, 随半径增加, 一价金属阳离子所引起的云母分解效应越显著, 钒浸出率越高。
卡普斯钦斯基曾提出可用式(3)计算二元化合物的晶格能[19], 由式(3)计算所得碱金属氟化物晶格能如表5所示。
式(3)中: L0为化合物晶格能(kJ· mol-1); r为离子半径(pm); Z为离子电荷。
| 表5 碱金属氟化物晶格能 Table 5 Lattice energies of alkaline metal fluorides |
由图3和表5可看出, 氟化物对石煤钒浸出效果的影响与其晶格能大小成反比关系, 也就是说, 晶格能越小, 氟化物的助浸作用越强。 这主要是因为晶格能越小, 其在矿浆中的解离越充分, 越容易与含钒云母发生反应。
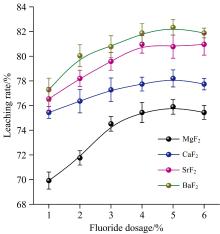
2.2.2 第二主族金属元素氟化物对钒浸出效果影响
相同试验条件下, 第二主族金属氟化物对石煤钒矿浸出效果如图4所示: 由图4可知, 随助浸剂用量增加, 四种浸出体系中钒浸出率均呈现出逐渐上升并最终趋于平衡的趋势, 其中氟化钡作为助浸剂时, 钒浸出率最高, 可达到82%左右。 第二主族金属氟化物对钒浸出效果影响顺序为: BaF2> SrF2> CaF2> MgF2, 与金属离子半径减小顺序一致。 不同氟化物与硫酸反应生成HF的标准吉布斯自由能变化情况如图5所示, 由图5可看出, BaF2与H2SO4反应的标准吉布斯自由能变化最大, 说明相同用量下, BaF2作为助浸剂时体系中HF浓度较高, 与其对钒浸出率影响最大的试验现象一致。 值得注意的是, 在整个温度区间内MgF2与H2SO4反应的标准吉布斯自由能变化均为正值, 说明MgF2作为助浸剂时无法通过与H2SO4的反应直接生成HF, 矿浆中HF的生成必定是耦合了其他复杂反应的结果。
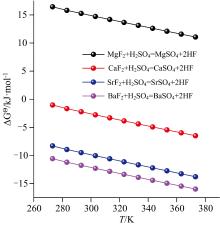 | 图5 第二主族金属氟化物与硫酸反应标准吉布斯自由能变化Fig.5 Δ Gθ variations for reactions MF2+H2SO4=MSO4+2HF (M=Mg, Ca, Sr, Ba) |
2.2.3 Na+、 N
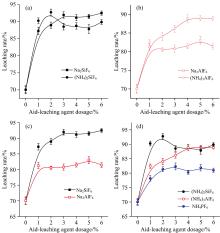
图6(a)显示在助浸剂用量小于2%时, (NH4)2SiF6体系中钒最高浸出率可达92.7%, 助浸效果(NH4)2SiF6> Na2SiF6; 而当助浸剂用量大于2%时, Na2SiF6的助浸效果则大于(NH4)2SiF6。 图7为助浸剂用量为原矿量的6%时, 浸出渣的SEM图谱, 图7(a)和(b)显示, Na2SiF6体系中钒元素浸出以“ 孔洞腐蚀” 路径为主, 而(NH4)2SiF6体系中则存在大量“ 裂隙腐蚀” 的痕迹。 相对于“ 孔洞腐蚀” , 反应物及产物在“ 裂隙腐蚀” 过程中的传质速度明显要快, 这可能是助浸剂用量较少时(NH4)2SiF6体系钒浸出率高于Na2SiF6体系的主要原因。 图7(c)和(d)显示, Na3AlF6作为助浸剂时, 体系中的不同颗粒被“ 粘结” 到了一起, 说明浸出过程中生成了某种胶体物质, 从而阻碍了钒元素的浸出反应, 这是图6(b) 中Na3AlF6体系中钒浸出率小于(NH4)3AlF6体系的主要原因。 图8为上述两种体系中浸出渣表面V和K元素的Mapping扫描图像, (NH4)3AlF6体系中V、 K元素的丰度分别为0.04 wt%和0.23 wt%, 均大幅小于Na3AlF6体系(0.16 wt%、 0.65 wt%), 进一步说明前一体系中含钒云母的崩解程度要大于后一体系。
由图6(c)可看出, Na2SiF6和Na3AlF6两类体系中最高钒浸出率分别达91%和83%左右, 整个试验范围内含氟铝(硅)酸盐对石煤钒浸出效果的影响均表现为Na2SiF6> Na3AlF6。 这主要是因为: ①Al3+与F-可在溶液中生成稳定常数较大的络合物[20, 21], 从而减少了溶液中游离HF的浓度, 进而降低了Na3AlF6对含钒云母的破坏能力; ②Na3AlF6体系中生成的某种胶体物质将不同的矿物颗粒粘结在一起, 从而阻碍了钒元素的浸出。 由图6(d)可看出, 当阳离子同为N
2.2.4 氟氢化盐对石煤钒浸出效果的影响
NaHF2、 KHF2、 NH4HF2对石煤钒矿浸出效果的影响如图9所示, NaHF2与NH4HF2对钒浸出效果的影响近似相同, 随助浸剂用量增加均呈现出先增加后降低趋势, 最高值分别为93.9%、 92.1%。 而随KHF2用量增加, 钒浸出率缓慢上升到最高点后又呈现出缓慢下降的趋势, 相较于其他两种药剂, KHF2浸出体系钒浸出率最高, 处于96%± 1.28%范围内, 不同助浸剂对钒浸出的影响顺序为: KHF2> NH4HF2> NaHF2。 由图10中原矿及三种助浸剂(原矿质量的6%)体系中浸出渣的SEM图像对比可看出, KHF2体系中浸出渣有丰富的腐蚀孔洞, 说明该体系中“ 孔洞腐蚀” 是钒元素浸出的主要原因, 而另外两种助浸剂体系中浸出渣的孔洞数量远远小于KHF2体系, 这可能是KHF2体系中钒浸出率高于其他体系的主要原因。 图11显示, KHF2、 NH4HF2、 NaHF2助浸剂用量为原矿量的6%时, 浸出渣中Al元素的相对质量百分数分别为0.17%、 0.21%和0.24%, 表示KHF2助浸体系中含钒云母分解程度最高, NH4HF2助浸体系次之, NaHF2助浸体系最低, 与不同体系中钒浸出率大小顺序一致。
如前所述, 不同碱金属及铵根离子在钒浸出体系能够与Fe3+生成黄铁矾类复盐, 不同复盐生成反应的标准吉布斯自由能变如表6所示[23, 24]。
| 表6 不同黄铁矾复盐生成反应的标准吉布斯自由能变 Table 6 Δ GΘ changes for formation reaction of various jarosites |
由表6可看出, 钾黄铁矾、 铵黄铁矾、 钠黄铁矾生成反应的标准吉布斯自由能变化分别为-75.9、 -59.6和-53.7 kJ· mol-1, 与相应浸出体系中钒浸出率变化规律一致。
(1) 氧化剂和氟化物强化含钒云母中钒的浸出效果主要通过“ 孔洞腐蚀” 和“ 裂隙腐蚀” 两种方式进行。 第Ⅰ 、 Ⅱ 主族金属的二元氟化物对石煤钒的助浸作用大小顺序分别为CsF> KF> NaF> LiF和BaF2> SrF2> CaF2> MgF2。
(2) Na+、 N
(3) K+、 Na+、 N
(4) 整体看来, 氟化物对钒浸出率的影响大小顺序为: K+、 Na+、 N
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|