作者简介: 李嘉晨, 女, 2002年生, 太原师范学院生物科学与技术学院硕士研究生 e-mail: jiachen1415@163.com
产金属β-内酰胺酶细菌的出现和在世界范围内的传播, 对治疗耐药细菌感染提出了巨大挑战, 特别是新德里金属β-内酰胺酶(NDM-1)。 其可使几乎所有的β-内酰胺类抗菌剂失活, 且至今临床上没有抑菌剂可用。 为了解NDM-1与β-内酰胺类抗菌剂之间的分子识别和相互作用, 利用猝灭光谱、 同步荧光、 圆二色光谱及分子动力学模拟方法对NDM-1与美罗培南(MER)之间的互作展开探讨。 猝灭光谱结果揭示MER可使NDM-1发生由静态猝灭引起的内源性荧光猝灭, 且仅影响和改变约一个Trp残基的微环境; 同步荧光光谱显示最大发射波长均发生蓝移4.0和2.0 nm, 表明Tyr和Trp残基均参与结合过程; 圆二色光谱表明NDM-1与MER作用之后, β-片层含量减少, 无规则卷曲含量增加, 两者之间发生柔性结合; 分子动力学结果揭示NDM-1在与MER结合过程中活性口袋附近的β4(40-47)部分变成无规则卷曲, loop2发生明显波动, 使得两者发生诱导契合效应, 与同步荧光和圆二色光谱结果一致; Trp93和His250氨基酸残基与MER分别于侧链氨基和β-内酰胺环上的甲基形成疏水相互作用, 且Ile35、 Val73、 Ala74、 Gly36、 Met67等疏水氨基酸残基均与MER形成范德华力, 进一步促进结合。 本研究对NDM-1与MER的分子识别过程提供了见解, 可能为未来设计和研发新的抗生素和抑制剂在分子层面提供新启示和理论依据。
The emergence and worldwide spread of metallo-β-lactamase-producing bacteria, particularly New Delhi metallo-β-lactamase (NDM-1), has poseda tremendous challenge in treating drug-resistant bacterial infections. It hydrolyzes almost all β-lactam antimicrobial agents, coupled with the absence of clinically available inhibitors. To comprehend the molecular recognition and interaction between NDM-1 and β-lactam antimicrobial agents, the interaction between NDM-1 and meropenem (MER) was probed by quenching spectroscopy, synchronous fluorescence spectroscopy, circular dichroism spectroscopy, and molecular dynamics simulation. Quenching spectroscopy revealed that MER could cause NDM-1 to undergo endogenous fluorescence quenching and affect the microenvironment of approximately one Trp residue of NDM-1.Synchronous fluorescence spectroscopy displayed that the maximum emission wavelengths of NDM-1 were blue-shifted by 4.0 and 2.0 nm, implying that both Tyr and Trp residues were involved in the binding. Circular dichroism spectroscopy exhibited that the secondary structure of NMD-1 was changed after its interaction with MER, with a decrease in β-sheets, and an increase in irregularly coiled content, suggesting a flexible binding process. In the molecular dynamics results, the β4 (40-47) located near the active pocket of NDM-1 adopted an irregular coil conformation, and loop2 exhibited substantial fluctuations, facilitating NDM-1-MER induced fit. The induced fit effect between NDM-1 and MER was consistent with synchrotron fluorescence and circular dichroism spectroscopy results. Trp93 and His250 amino acid residues formed hydrophobic interactions with MER at the side-chain amino group and the methyl group of the β-lactam ring, respectively, and the amino acid residues of Ile35, Val73, Ala74, Gly36, and Met67 formed van der Waals forces with MER, further promoting the binding. This present study gives crucialinsights into the molecular recognition process of NDM-1 with MER, which may provide new perspectives and a theoretical basis for future development of novel antibiotics and inhibitors targeting this clinically important resistance mechanism.
多年来β -内酰胺类抗生素在治疗致病菌感染疾病方面呈现着至关重要的作用。 然而, 近年来抗生素的滥用, 使得细菌出现许多不同的耐药机制, 其中包括β -内酰胺酶的产生, 尤其是金属β -内酰胺酶(metallo-β -lactamases, Mβ Ls), 引起社会的极大关注[1, 2]。
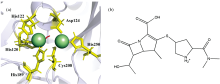
新德里金属β -内酰胺酶1(New Delhi metallo-β -lactamase 1, NDM-1)最初报道于克雷伯氏菌肺炎起源于印度, 但目前已在全球广泛传播[3]。 它是一种质粒编码的单链蛋白含有N端信号肽, 形成典型的β -内酰胺酶α /β /β /α 夹层折叠, 活性位点含有两个锌离子(Zn1和Zn2), 其中Zn1与三个组氨酸残基(His120、 His122、 His189)配位, Zn2与组氨酸(His250)、 天冬氨酸(Asp124)和半胱氨酸(Cys208)残基配位[图1(a)]。 在Mβ Ls中, NDM-1几乎可以水解所有已知的β -内酰胺类抗生素, 因此显示出广谱的β -内酰胺酶活性[4, 5]。 目前, 治疗中还无可用的抑制剂, 急需开发新的候选药物。
许多文献研究揭示NDM-1与β -内酰胺类抗生素的水解化学反应中, 抗生素羰基氧与Zn2+(Ⅰ )配位, β -内酰胺氮与Zn2+(Ⅱ )配位, 底物结合使β -内酰胺键极化, OH-的攻击导致氧化阴离子被Zn2+(Ⅰ )稳定, 随后C— N键断裂, β -内酰胺氮作为阴离子排出, 并与作为一般酸的Zn2+(Ⅱ )配位稳定[6, 7]。 然而, 化学水解前的分子识别过程, 也是Mβ Ls与β -内酰类抗生素结合的关键步骤。 因此本研究选择了临床上使用的美罗培南(Meropenem, MER)[图1(b)], 通过荧光光谱法和分子动力学旨在阐明MER与NDM-1之间的分子识别和互作机制, 为新抗生素的发现给予了新的途径和前景。
美罗培南(北京索莱宝公司), NDM-1冻干粉(本实验室提供), ZuCI2、 Tris和HCl均为常规使用的分析纯。
F-2700型荧光分光光度计(日立高新技术公司); MOS-500圆二色光谱仪(大连华洋分析仪器有限公司); CEB105N微量电子分析天平(上海衡际科学仪器有限公司); PHS-25型pH计(上海雷磁有限公司); SZB-20型制冰机(江苏常拓有限公司)。
1.2.1 溶液配制
20 mmol· L-1, pH 7.4 Tris-HCl缓冲液, 0.40 mmol· L-1 ZuCl2溶液, 提前配置放置室温。
NDM-1溶液: 上述缓冲液配制浓度为1.0× 10-6 mmol· L-1, 4 ℃保存备用。
MER溶液: 上述缓冲液配制浓度为1.0× 10-2 mmol· L-1和1.0× 10-3 mmol· L-1, 4 ℃保存, 尽量现配现用。
1.2.2 NDM-1与MER相互作用的荧光光谱分析
所有光谱实验均采用10 mm石英比色皿在F-2700荧光光谱仪上采集数据, 其中激发/发射狭缝宽度、 电压和扫描速度均分别保持10/10 nm、 400 V和12 000 nm· min-1不变。
猝灭光谱测定: 分别在277、 281和285 K下测定NDM-1与MER互作荧光光谱, 且其终浓度之比分别为1∶ 0, 1∶ 1, 1∶ 2, 1∶ 4, 1∶ 6, 1∶ 8, 1∶ 10和1∶ 11。 激发波长278 nm, 检测宽度200~400 nm, 记录间隔1 nm。 同时以相应不同浓度的美罗培南为背景对照, 每组重复扫描三次。
为了避免MER荧光内滤效应的影响, 结合紫外吸收光谱根据如式(1)进行荧光校正[8]
式(1)中, Fobs是实测荧光强度, Fcorr是校正荧光强度, Aexi和Aemi分别为激发和发射波长下所对应的吸光度。 因在实验测定中MER几乎无吸光度, 且加入的体积少于10 μ L, 因此, MER自身对荧光强度的影响可忽略不计。
同步荧光检测: 分别在277 K、 Δ λ 为15或60 nm条件下, 记录数据间隔2 nm, NDM-1与MER的终浓度之比分别为1∶ 0、 1∶ 20、 1∶ 40、 1∶ 60、 1∶ 80、 1∶ 100、 1∶ 150和1∶ 200。
1.2.3 NDM-1与MER互作的圆二色光谱分析
在150 W氙灯下按照两者1∶ 1比例进行远紫外CD光谱分析。 将10 μ L MER溶液(100.0 μ mol· L-1)加入到1 mL NDM-1溶液(1.0 μ mol· L-1)中。 扫描宽度200~260 nm, 记录间隔1 nm, 重复检测三次, 求平均值。 之后, 用Savitzky-Golay滤波器进行数据平滑处理。
1.2.4 NDM-1与MER之间的分子动力学研究
利用NCBI数据库中获得MER的结构, 并用MOE软件进行了能量最小化和质子化。 从蛋白质数据库中下载NDM-1结构(PDB ID: 4ey2), 通过PyMOL进行去水加氢预处理。 然后, 利用Autodock 4.2程序软件模拟NDM-1与MER的结合过程。 其中格点设置为60× 60× 60 Å , LGA运行时间固定为1 000次, Lamarckian遗传算法预测和评估NDM-1与MER的结合可视化信息。 最后, 通过聚类分析和可视化分析, 获得了最稳定的NDM-1-MER复合物结合模式, 将其作为动力学模拟的初始构象。
所有的计算机理论体系均在Amber14包中的Sander模块下建立和执行。 在正式动力学模拟开始之前, 首先对MER小分子进行电荷计算和添加力场; 然后将NDM-1置于一个截断八面体的周期性TIP3P水盒中, 其边缘距离水盒外部为8 Å , 力场为Amber ff14SB, 并保留桥接水分子, 锌配位的氨基酸质子化, CYS修改为CYX, HIS修改为HIN, 此外, 还加入了12个Na+, 以维持系统的电中性。 随后再对系统进行了两步能量最小化, 先只选择优化极性水分子和Na+。 之后优化整个系统, 最陡下降2 000步, 共轭梯度3 000步。 随之, 系统将在NVT下升至300 K, 在NPT下100 ps的平衡。 最后, 在NPT系综下正式10 ns模拟。 其中, SHAKE算法[9]被选择用来限制整个体系中H原子的化学键, 时间步长间隔规定为2 fs。 采用PME方法[10]计算系统中的所有远程静电相互作用, 此外, 我们也对空载NDM-1进行了10 ns模拟, 结果通过Discovery Studio和PyMOL软件作图。
Thomas等[3]报道了298 K时NDM-1水解MER的动力学参数, 其中Km为(54± 3) μ mol· L-1, Kcat为(138± 3) s-1, 说明NDM-1能够显著且完全地水解MER。 因水解反应非常迅速, 无法精确地检测到物理识别过程。 因此, 尝试在低温下延长水解化学反应, 从而延长分子物理识别时间。 所以, 本研究的荧光光谱是在低温下操作的, 实验中MER过量, NDM-1与MER始终处于结合形式, 可近似认为实际扫描得到的光谱数据来源于NDM-1与MER的配合物。
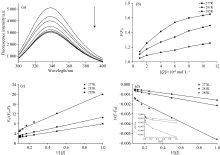
NDM-1分子包含4个Trp、 4个Tyr和10个Phe残基, 使其在激发波长为278 nm时产生较强的内源荧光, 最大发射峰为338.6 nm。 在277 K下, 不同浓度MER对NDM-1荧光光谱的影响如图2(a)所示, 可看出, 伴随着MER浓度的上升, NDM-1的荧光强度有明显的削弱, 但荧光发射峰的位置和峰形无显著变化。 表明MER与NDM-1之间通过形成非共价键相互作用。
2.2.1 猝灭机制
蛋白质和配体的猝灭机制一般可分为以下类型: 动态、 静态和混合猝灭[11]。 其中温度与猝灭常数或激发态寿命之间的联系常被用于判断猝灭类型。 高温下体系内分子过快的扩散速度, 导致动态猝灭频率增多, 进而产生猝灭常数与温度成正比的现象, 反之则是静态猝灭[12]。 MER诱导NDM-1的荧光猝灭可以用Stern-Volmer方程来分析[11]
式(2)中, F、 F0分别为有无MER时NDM-1的荧光强度; KSV代表猝灭常数; kq为动态猝灭速率常数; τ 0为无MER时NDM-1的平均寿命, 约为6 ns [11]; [Q]表示MER的浓度。 显然, 由式(2)可知, 当猝灭形式单一时, F0/F与[Q]的关系是线性的, 而多元时, 关系则是非线性的, 呈接近Y轴的向上趋势[13]。 从图2(b)中可以明显看出, 随着MER浓度的增加, 曲线倾向于向X轴倾斜, 这意味着NDM-1的内源荧光不能被MER完全猝灭。 这一现象与NDM-1中存在4个Trp残基的事实吻合, 其中Trp93位于NDM-1活性口袋附近, Trp59/104/168位于蛋白质表面, 远离活性口袋, 与MER没有直接作用。 为了明确猝灭类型, 我们利用修正的Stern-Volmer方程深入探讨[13]
式(3)中, fa表示NDM-1荧光猝灭比, Ka表示获得性猝灭常数。 根据式(3), 在不同温度下F0/(F0-F)与1/[Q]的关系如图2(c)所示, F0/(F0-F)与1/[Q]之间存在良好的线性关系, 表明MER对NDM-1的猝灭机制为单一形式。 Ka和fa由截距和斜率得到见表1。 随着温度的升高, Ka在3.22× 105~2.44× 105 L· mol-1之间变化, kq远超过最大动态猝灭常数2.0× 1010 L· mol-1· s-1, 表明MER使NDM-1引起的猝灭属于混合猝灭, 但以静态猝灭为主。 此外, fa为0.51~0.25, 表明MER可以猝灭NDM-1中约1/4的荧光, 即MER与NDM-1的结合仅影响和改变一个Trp残基的微环境。
| 表1 不同条件下MER对NDM-1的猝灭和速率常数 Table 1 The quenching and rate constants of NDM-1 with MER under different conditions |
2.2.2 结合常数
结合常数Kb是描述蛋白质与配体亲和力的定量参数。
由于NDM-1-MER复合物具有荧光特性, 因此Kb通过修正的Benesi-Hildebrand方程估算[14]
式(4)中, F1为饱和NDM-1-MER复合物的荧光强度; Kb和n分别为结合常数和结合摩尔比。 从图2(d)可见, 1/(F-F0)与1/[Q]之间存在较好的正比关系(r2> 0.98), 而1/(F-F0)与1/[Q]2之间具有非线性关系, 暗示MER与NDM-1的化学计量比近似为1∶ 1。 由表2可看出, 随着NDM-1与MER结合的温度从277 K升高到285 K, Kb值从3.12× 105降低到2.44× 105, 表明温度对NDM-1与MER的结合有显著影响。
2.2.3 热力学参数
为了探究NEM-1与MER的互作力类型, 利用Van't Hoff和热力学公式计算热力学参数[15]
式(5)和式(6)中, R为气体常数(8.314 J· K-1· mol-1), Kb视为结合常数。 根据Ross定律可知: Δ H> 0、 Δ S> 0, 互作力为疏水相互作用, Δ H< 0、 Δ S< 0, 氢键相互作用和范德华力, Δ H< 0、 Δ S> 0, 静电力。 两者结合的热力学参数统计于表2, Δ G为负, NDM-1与MER是自发结合。 Δ H为负, Δ S为正, 揭示两者由焓和熵协同促进结合, 互作力为静电力。
| 表2 不同条件下MER对NDM-1的结合常数及热力学性质 Table 2 The binding constants and thermodynamic properties of NDM-1 by MER at different conditions |
同步荧光法常被用来解析氨基酸残基与其周围环境的变化[16]。 波长差(Δ λ )为60或15 nm时, 扫描观察到的荧光光谱曲线分别显示Trp或Tyr残基信息, 其最大发射波长极易因微环境极性的改变而偏移。 若其向左偏移(蓝移), 则暗示NDM-1微环境的非极性增强, 反之, 则疏水性降低[17]。 图3显示了NDM-1与MER互作时的同步荧光光谱, 可知随着MER的加入, 其荧光强度逐步削弱, 最大发射波长分别发生了4.0和2.0 nm的蓝移, 说明MER改变了NDM-1中Trp和Tyr的微环境。 在NDM-1分子中, 3个Tyr和1个Trp分别存在于结合袋区域, 疏水性的增强有利于MER的作用。
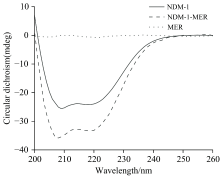
远紫外CD光谱可利用(208和222 nm)负峰预测蛋白质二级结构的变化, 进而常用于探究蛋白与配体互作使得构象变化[18]。 如图4所示, NDM-1的CD光谱是富含α -螺旋和β -片层的蛋白质典型光谱特征。 通过CDNN软件预测可知NDM-1的α -螺旋含量约为31.5%± 0.3%, 与Guo等[19]报道的野生型NDM-1晶体结构中α -螺旋含量一致。 然而, 当MER存在时, α -螺旋含量变化不明显, β -片层含量减少, 无规则卷曲含量增加。 这表明在NDM-1与MER结合过程中, 其二级结构发生变化, 可能部分β -片层被转变为无规则卷曲, 氨基酸微环境发生变化与同步荧光结果契合。
| 表3 NDM-1与MER作用前后的CD光谱测定 Table 3 The CD spectral determination of NDM-1 with and without MER |
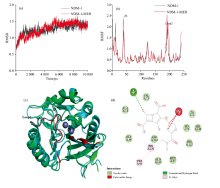
在蛋白与配体的互作过程研究中分子动力学模拟技术可被用于观察构象动态变化。 其中均方根偏差RMSD值常被用于判断模拟过程中体系的稳定性[20]。 从图5(a)可知, NDM-1的体系和NDM-1-MER体系均在5 ns以后趋于平稳, 表明构象趋于稳定。 RMSF值被用于评估在整个模拟过程中每个氨基酸残基的平均波动程度[20], 以此推断蛋白柔性变化大小。 从图5(b) 可看出, NDM-1与MER结合后β 4(40-47)和loop2(185-198)波动最为明显。 从图5(c)可看出, NDM-1与MER结合过程中β 4(40-47)部分变成无规则卷曲, 且loop2与β 4均位于活性口袋附近, 表明NDM-1与MER之间发生诱导契合效应, 与CD光谱结果一致。 从图5(d) 可知, Zn2+与MER的侧链发生相互作用, 促使侧链结构的扭转, 利于整个分子进入活性位点。 然而, Zn2+未与β -内酰胺环的核心结构发生直接相互作用, 可能是Zn2+在前期分子识别和后期化学水解中扮演不同的角色[6]。 Ile35与β -内酰胺环羰基O之间形成氢键, 促进MER构象的稳定。 Trp93和His250氨基酸残基与MER分别于侧链氨基和β 内酰胺环上的甲基形成疏水相互作用, 且Ile35、 Val73、 Ala74、 Gly36、 Met67等疏水氨基酸残基均与MER形成范德华力, 进一步促进NDM-1与MER的结合。
蛋白与配体之间的互作可用自由能直接评价。 对于NDM-1-MER复合物体系的自由能通过MM-GBSA进行计算[20, 21], 如式(7)— 式(9)
式(7)— 式(9)中, Δ Gbind代表结合过程中的结合自由能, Δ Eint(内能)、 Δ Eele(静电相互作用能)和Δ EVDW(范德华相互作用能)共同构成Δ EMM, 溶剂化自由能Δ Gsolvation分为Δ GGB(极性溶剂化能)和Δ GSA(非极性溶剂化能)。 在互作过程中熵值(Δ S)是被忽略, 因而在能量计算中不考虑熵。 表4为NDM-1与MER结合过程中能量结果, 从表中可知, Δ G为负值, 说明它们之间的结合是一个自发的过程; Δ Eele远小于Δ EVDW, 表明静电力为主要驱动力, 与上述荧光结果一致; Δ GGB远大于Δ GSA, 是因为整个模拟体系是位于极性水环境中, 不利于两者的结合。 但是Δ G数值上存在差异, 可能是实验环境及研究方法不同导致。
| 表4 NDM-1与MER结合过程中能量结果(kcal· mol-1) Table 4 The energy results of NDM-1 binding with MER(kcal· mol-1) |
通过多光谱法及分子动力学模拟技术探究NDM-1与MER之间的识别机制。 光谱结果揭示MER可以使NDM-1发生静态猝灭, 且使NDM-1的微环境和构象发生转变。 分子动力学表明NDM-1在与MER结合过程中活性口袋附近的β 4(40-47)部分变成无规则卷曲, loop2发生波动, 使得NDM-1与MER之间发生诱导契合效应, Trp93、 His250、 Ile35、 Val73、 Ala74、 Gly36、 Met67、 Gln123等氨基酸残基均与MER发生互作。 两者通过静电相互作用驱动自发结合, 与实验结论一致。 本研究对NDM-1与MER的分子识别过程呈现了新视角, 为未来设计和研发新的抗生素和抑制剂在分子层面提供新思路和理论依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|