作者简介: 王凤婵, 女, 1987年生, 青岛大学附属青岛市海慈医院(青岛市中医医院)呼吸与危重症诊疗中心主治医师e-mail: wangfc0462@126.com
铜绿假单胞菌是导致临床肺炎产生的重要病原菌之一。 传统的基于培养法的药敏鉴定方法耗时长, 严重影响患者的治疗疗效。 因此, 临床亟需一种基于免培养的铜绿假单胞菌药敏快速鉴定方法。 据此, 我们进行单细胞拉曼光谱技术结合重水标记方法对铜绿假单胞菌的药敏研究。 通过美罗培南、 头孢他啶、 头孢吡肟三种抗生素对铜绿假单胞菌标准株和两株临床分离株进行药物敏感实验, 结果表明, 通过拉曼光谱技术进行的药敏试验与肉汤稀释法获得的药敏鉴定结果高度一致(分类一致率100%, 基本一致率88.9%), 且能在4 h内准确判定菌株的药敏结果。 因此, 单细胞拉曼光谱结合重水标记技术有望成为临床病原菌药敏快速鉴定的理想工具。
Pseudomonas aeruginosa is one of the important pathogens causing clinical pneumonia. The rapid spread of antibiotic resistance threatens our fight against bacterial infections. However, the culture-based broth microdilution method (BMD) is the gold standard method for in vitro antimicrobial susceptibility tests (ASTs), which seriously affects the therapeutic effect of patients due to longer detection time. Single-cell Raman spectroscopy (SCRS) is label-free, culture-free, rapid, accurate and low-cost. Here we research the AST of Pseudomonas aeruginosa using the Clinical Antimicrobials Susceptibility Test Ramanometry (CAST-R), based on D2O-probed Raman spectroscopy. We selected three antibiotics (Meropenem, Ceftazidime and Cefepime) and three Pseudomonas aeruginosa strains to carry out the AST. CAST-R results show 100% essential agreement and 88.9% categorical agreement with BMD methods, and it can achieve the AST results within 4h. The speed, reliability, and general applicability of CAST-R suggest its potential utility for guiding the clinical administration of antimicrobials.
铜绿假单胞菌(Pseudomonas aeruginosa, P. aeruginosa)属革兰氏阴性菌, 能引起严重的医院获得性肺炎[1]。 随着气管切开、 气管插管等有创检查的逐渐增加, 铜绿假单胞菌感染比率不断上升, 成为临床治疗的难点。 虽然抗生素的滥用问题已受到国内外的高度重视, 但据全国细菌耐药监测报告显示, 铜绿假单胞菌耐药菌甚至多重耐药菌出现的比例依然很高(17.7%, 2021年)[2], 对患者的治疗造成重要的影响。 因此, 快速鉴定铜绿假单胞菌对抗生素药物的敏感性, 对治疗医院获得性肺炎具有重要的意义。
自最初发现细菌至今, 培养方法仍是明确病原菌和进行药敏试验(antimicrobial susceptibility tests, ASTs)的金标准。 临床病体样本需进行处理分离并接种培养, 增殖至可检测水平后经生化检验确定病原菌类型; 再通过梯度稀释或纸片扩散等传统药敏试验方法判断其耐药属性和程度[3]。 肉汤稀释法(broth microdilution method, BMD)通过体外培养细菌18~24 h后观察抑制培养基内病原菌生长的最低药物浓度, 即为该药物对待检菌的最低抑菌浓度(minimum inhibitory concentration, MIC), 它是定量评价药物抑菌效能的重要指标和金标准[4]。 然而其基于培养法的前提, 致使其需要24 h以上的时间获得药敏结果。
单细胞拉曼光谱技术(single-cell Raman spectroscopy, SCRS)是基于拉曼光谱技术实现细胞内物质结构检测的新方法, 通过获取生物体特有的“ 指纹图谱” 反映检测物的生物学信息(包括蛋白质、 核酸、 脂质等)组成, 并结合不同的分析方法实现对检测物的快速、 准确区分[5, 6]。 由于其具有无需样本预处理、 可以进行活体检测、 操作简单等优点, 该技术被广泛应用于病原微生物鉴定领域[7, 8, 9]。 重水标记单细胞显微拉曼光谱技术(D2O-labeled single-cell Raman micro-spectroscopy, D2O Ramanometry), 是重水标记技术和拉曼技术的结合, 其是一种不依赖培养、 基于代谢的药敏鉴定方法[10, 11, 12, 13, 14, 15]。 每个单细胞拉曼光谱由数千个拉曼峰组成, 这些拉曼峰单独或共同代表细胞内代谢物化学键的共振频率, 是细胞代谢状态的表征。 当D2O被活细胞摄入胞内, D元素会参与物质代谢过程, 新合成的大分子中的碳氘键会在细胞的拉曼光谱的一个静默区域(2 040~2 300 cm-1)产生“ C-D峰” , 其强度指示了D2O的消耗量[16]。 C-D比值(即C-D ratio, CDR), 定义为C-D波段(2 040~2 300 cm-1)的综合光谱强度与C-D波段和“ C-H波段” (2 800~3 100 cm-1)之和的百分比, 可以定量反映细胞的代谢活性。 因此, Δ CD/(CD+CH)(即Δ C-D Ratio或Δ CDR), 即药物暴露后CDR相对于无药情况下平均CDR的时间变化, 被用来模拟药物暴露对细胞代谢的抑制程度[10]。 相应地, 基于代谢的最低抑制浓度(minimal inhibitory concentration via metabolic activity, MIC-MA)作为药敏实验的定量指标也被提出[10], 并开发出临床微生物拉曼药敏快检技术(clinical antimicrobials susceptibility test Ramanometry, CAST-R)[17], 这种测量细胞D2O摄入量(即代谢活力)而不是细胞增殖作为药物敏感性的测量, 大大降低了药敏检测结果的时间[10, 11, 12, 13, 14, 15]。
然而, 基于重水拉曼技术用于铜绿假单胞菌药敏鉴定的可行性和普适性尚未明确。 因此本研究采用肉汤稀释法和重水拉曼光谱法, 研究铜绿假单胞菌对不同抗生素的耐药情况, 对重水拉曼技术用于铜绿假单胞菌药敏鉴定的可行性进行了细致研究和讨论, 为临床快速准确药敏鉴定提供新思路。
实验涉及铜绿假单胞菌三种: 标准株ATCC 27853、 临床分离株38388、 38714(菌株来自于南方医科大学珠江医院)。
实验所用的试剂、 药物及来源如表1所示。 三种抗生素为: 美罗培南(Meropenem, MEM)、 头孢吡肟(Cefepime, FEP)、 头孢他啶(Ceftazidime, CAZ)。
| 表1 实验试剂及药物 Table 1 The list of drugs and reagents |
实验菌株的培养: 将铜绿假单胞菌用接种环在哥伦比亚血平板中三区划线接种, 37 ℃培养箱过夜培养16~18 h。 取3个单克隆接种于MHB培养基中, 于37 ℃恒温培养箱中培养2~3 h, 备用。
将实验菌株 ATCC 27853 接种于含不同浓度(0%、 30%、 50%)重水的培养基中(0%为对照组), 培养6 h。 在不同时间点(0、 1、 2、 3、 4、 5、 6 h)分别取样进行拉曼技术检测, 以评价该菌株对重水的吸收规律, 探究最优的孵育条件实现快速药敏检测。
取恒温培养箱中培养2~3 h的实验菌株(ATCC 27853)菌液少许, 置于2 mL MHB培养基中, 调整菌密度至0.5麦氏浓度, 稀释10倍, 调至菌的浓度为1× 107 CFU· mL-1。 实验设置空白对照组: 只含培养基, 以排除培养基污染的可能性; 阴性对照组: 含有培养基+实验菌, 以证明实验菌株可以在培养基中生长良好; 实验组: 含有培养基+实验菌+不同浓度的抗生素。 实验组中, 通过调整培养基和不同抗生素配比, 使美罗培南的浓度最终为2、 1、 0.5、 0.25、 0.12、 0 mg· L-1; 头孢吡肟的浓度最终为12、 6、 4、 2、 1、 0.1、 0.05和0 mg· L-1; 头孢他啶的浓度最终为32、 16、 8、 4、 2和0 mg· L-1。 37 ℃温度下培育24 h, 观察实验结果。
对于分离株38388、 38714分别进行和标准菌株相同的实验方法进行实验。
将实验菌株(ATCC 27853)分别接种至含美罗培南(浓度: 2、 1、 0.5、 0.25、 0.12和0 mg· L-1), 头孢吡肟(浓度: 12、 6、 4、 2、 1、 0.1、 0.05和0 mg· L-1)、 头孢他啶(浓度: 32、 16、 8、 4、 2和0 mg· L-1)的MHB培养基中, 实验体系中具体成分含量如表2所示。 37 ℃培养1 h后取出加30%重水, 加重水后继续37 ℃培养2 h, 取样0.2 μ L测量样品点在疏水石英玻片上, 风干, 做三个生物学重复。 利用临床单细胞拉曼耐药性快检仪(CAST-R, 青岛星赛)采集拉曼光谱。 系统采用波长为532 nm的Nd:YAG 激光作为激发光源。 激光经过100倍物镜(N.A.=0.95, Olympus, Japan)聚焦后进行单细胞拉曼光谱激发, 产生的拉曼信号通过物镜进入光谱仪。 信号经过600 grooves· mm-1光栅分光后, 进入EMCCD探测器(Newton 970, Andor, UK), 从而获得单细胞的拉曼光谱信号。 系统同时具有显微成像功能, 可实现单个细胞的精准定位。 单细胞拉曼实验参数: 激光功率为60 mW(物镜之前), 采集时间为1.5 s, 拉曼光谱范围 500~3 200 cm-1, 在不同视野中随机采集50~75个单细胞的拉曼图谱。 获得的单细胞光谱经过减背景、 减基线、 归一化和最大值标准化处理后计算出Δ CDR值[培养时间与0 h的CDR的差值, Δ CDR=(CDR2 h-CDR0 h)/(CD + CH)][18]。 整个单细胞重水拉曼药敏实验时间约为3~4 h, 包括重水孵育(2 h), 菌株手动清洗和氟化钙玻片制片(0.5 h)以及后续的单细胞拉曼光谱采集和数据处理(约1 h)。
| 表2 药敏实验中培养基的具体成分用量 Table 2 The dosage of the medium in ASTs |
对于分离株38388、 38714分别进行和标准菌株相同的实验方法进行实验。
将铜绿假单胞菌株ATCC 27853在不同浓度的重水环境下培养6 h, 在不同时间点进行拉曼检测, 获得的不同浓度重水环境下铜绿假单胞菌拉曼光谱的CDR 随时间的变化结果(图1)。 可以发现, 与对照组相比, 在30%和50% D2O环境中, 从1 h开始就可以看到CDR值有明显的升高, 而且从3 h开始CDR 值逐渐趋于平稳, 说明铜绿假单胞菌生长过程中可以很容易吸收重水。 同时由30%重水环境下铜绿假单胞菌ATCC 27853随时间变化的单细胞拉曼谱图(图2)和图1(b)中的差异性分析结果可以看出, 从1 h时出现重水峰(C-D峰, 2 040~2 300 cm-1), 在2 h时C-D峰强度明显增加, 并且重水孵育2与1 h的差异性明显高于其他时间。 因此本研究选择不影响实验菌株生长又能产生明显C-D拉曼峰的重水浓度, 即30%重水作为后续实验的默认重水浓度, 后续药物敏感实验中采用2 h进行重水孵育。
 | 图1 不同浓度重水环境下铜绿假单胞菌拉曼光谱的CDR随时间的变化 (a): 0%; (b): 30%; (c): 50%Fig.1 Temporal change of CDR curve for P. aeruginosa under different D2O concentration (a): 0%; (b): 30%; (c): 50% |
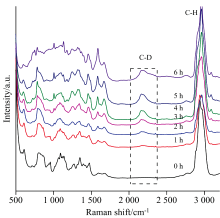 | 图2 30%重水环境下铜绿假单胞菌ATCC 27853随时间变化的单细胞拉曼光谱2.2 不同药物对铜绿假单胞菌的MIC测定结果Fig.2 Temporal change of single cell Raman spectrum for P. aeruginosa ATCC 27853 under 30% D2O |
采用测量最低抑制浓度的金标准方法(肉汤稀释法)[4], 测定不同铜绿假单胞菌菌株对美罗培南、 头孢吡肟和头孢他啶这三种药物的敏感性, 实验获得的MIC如表3所示。 最低抑菌浓度实验结果的MIC值与M100抗微生物药物敏感性试验标准相比较, 可判断菌株对该抗生素的药物敏感性[17]。 通过表3和表4比较发现, 铜绿假单胞菌标准株ATCC 27853、 分离株38714对美罗培南、 头孢吡肟、 头孢他啶均敏感; 分离株38388对美罗培南耐药, 对头孢吡肟、 头孢他啶敏感。
| 表3 试验获得的铜绿假单胞菌对抗生素的MIC折点 Table 3 The MIC breakpoints of antibiotics in P. aeruginosa |
通过拉曼光谱技术检测单个病原菌细胞吸收重水之后拉曼光谱的变化, 能够检测细胞在抗生素处理下的代谢活性[10]。 拉曼光谱检测技术相对于采用肉眼观察的最低抑菌浓度实验更加精确, 且能从微观上反映不同浓度抗生素对菌株的抑制效果。 为了评估重水拉曼光谱技术用于铜绿假单胞菌药敏实验的可行性, 我们进行铜绿假单胞菌与美罗培南、 头孢吡肟、 头孢他啶三种抗生素药物作用下的药敏实验, 测定不同药物浓度下单细胞的拉曼光谱, 获得Δ CDR随药物浓度的变化曲线(图3), 其中红线是通过Loess回归生成的[19], 代表随着药物浓度的Δ CDR变化趋势。 从图中可以发现, 随着抗生素浓度的增加Δ CDR的值逐渐降低, 当抗生素达到一定浓度后, Δ CDR的值几乎不再变化, 趋于平稳。 当Δ CDR< 0且标准差< 0.005时, 可认为此浓度下的菌已经全部被抑制杀死不再进行生长代谢, 此标准下的抗生素浓度即为基于代谢的最低抑菌浓度(MIC-MA)[10]。 基于此获得重水拉曼技术测得的最低抑制浓度结果(表5), 与肉汤稀释法获得的MIC(表3)对比发现, 铜绿假单胞菌采用两种方法获得的最低抑制浓度不大于2倍, 且, MIC-MA对应的药物浓度等于或者大于MIC, 表明微生物的生长受到抑制时, 细胞代谢活性仍可以得到保留。
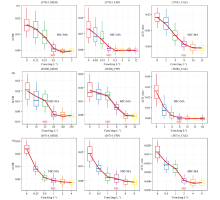 | 图3 铜绿假单胞菌在美罗培南、 头孢吡肟、 头孢他啶环境下随药物浓度的Δ CDR的变化曲线 (a): ATCC 27853; (b): 38388; (c): 38714Fig.3 Drug concentration-dependent Δ CDR of P. aeruginosa (a): ATCC 27853; (b): 38388; (c): 38714 |
| 表5 重水拉曼技术测得的铜绿假单胞菌的最低抑制浓度 Table 5 The MIC-MA breakpoints of antibiotics in P. aeruginosa using CAST-R |
最终对比CLSI药敏判定标准(表4), 获得3株铜绿假单胞菌肉汤稀释法和重水拉曼方法的药敏分类对比结果(图4)。 结果发现采用重水拉曼方法测得的药敏鉴定结果与肉汤稀释法高度一致, 分类一致率达到100%(9/9耐药与非耐药判别)。 同时可以发现, 实验中几乎所有的MIC-MA值都与肉汤稀释法获得的MIC相同或在± 1倍稀释范围内(图4 中红色和绿色阴影区域), 只有菌株ATCC 27853对头孢吡肟为2倍稀释差, 基于前期研究MIC-MA与MIC值相同或者在± 1倍稀释范围内认为结果一致[17], 获得MIC-MA与MIC的基本一致率为88.9%(8/9)。 因此, 此结果证明MIC-MA可作为铜绿假单胞菌药敏鉴定结果的有效参数。
 | 图4 不同抗生素作用下三株铜绿假单胞菌的MIC与MIC-MA的结果对比 (a): 美罗培南; (b): 头孢吡肟; (c): 头孢他啶Fig.4 Comparison of MIC and MIC-MA of the P. aeruginosa with different Antibiotics (a): MEM; (b): FEP; (c): CAZ |
| 表6 肉汤稀释法和重水拉曼方法的药敏鉴定对比结果 Table 6 Comparative results of ASTs by BMD and CAST-R |
将单细胞重水拉曼技术用于铜绿假单胞菌的药敏鉴定, 分别采用肉汤稀释法和单细胞重水拉曼技术进行药敏实验, 结果对比表明单细胞重水拉曼技术通过Δ CDR的变化鉴定的药敏结果与肉汤稀释法高度一致, 分类一致率达到100%, 基本一致率为88.9%。 具体分析而言, 稀释肉汤法和重水拉曼方法鉴定的基本一致率的差异在于获得的MIC-MA值高于MIC值, 表明微生物的生长受到抑制时, 细胞代谢活性仍可以得到保留, 这与MIC-MA指数并不基于传统方法所依赖的细胞分裂与增殖, 而是从细胞代谢活性角度对药物作用效能做出精确的判定和评估一致[10]。 因此, 基于免培养法的单细胞重水拉曼技术可以快速评价抗生素药物对铜绿假单胞菌的代谢抑制效果, 进而衡量药敏结果, 为更快速的临床药敏鉴定提供技术支持。 单细胞拉曼技术有快速、 简易、 成本低等优势, 可在免培养的前提下将整个药敏实验过程缩短为3~4 h, 未来通过大量的临床样本检验及数据扩充, 可望成为临床低成本、 快速、 便捷的药敏鉴定方案。
此外, 由于单细胞拉曼光谱技术可获得即微生物细胞的“ 指纹谱” , 而不同的微生物间和同一物种的不同生长时期均存在差异[10], 因而拉曼光谱技术结合各种机器学习方法在微生物样品的种类快速鉴定领域广泛应用[20]。
综上, 单细胞拉曼光谱技术以其独特的优势, 可对临床微生物病原菌同时进行药敏鉴定和物种鉴定, 可为临床诊断及微生物学研究提供有力的技术支撑。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|


