作者简介: 王晓霞, 女, 1984年生, 内蒙古科技大学化学与化工学院副教授 e-mail: wxx572369@163.com
通过荧光光谱、 同步荧光光谱、 三维荧光光谱、 紫外-可见吸收光谱、 圆二色谱、 红外光谱和分子对接模拟系统性的研究了黄腐植酸(FA)与纤维素酶(CEL)在特定条件下的相互作用及其对CEL构象的影响。 荧光光谱分析表明, 随着CEL浓度的增加, FA的荧光强度呈现出规律性的猝灭现象。 此外, 猝灭常数随温度升高而降低, 这表明FA对CEL荧光存在显著的静态猝灭效应。 热力学分析表明, FA与CEL之间的相互作用主要由范德华力和氢键作用主导, 且该反应在热力学上具有自发性。 Förster能量转移理论计算表明, FA与CEL之间可能存在非辐射能量转移。 紫外-可见吸收光谱和同步荧光光谱进一步验证了静态猝灭机制, 并表明FA的结构密度和氨基酸残基微环境发生变化。 圆二色谱分析显示, FA与CEL的结合位点位于色氨酸残基附近的疏水腔内, 导致CEL二级结构的疏水性降低, 肽链更加舒展, 进一步证实了两者之间的相互作用及FA对CEL二级结构的影响。 分子对接研究表明, FA与CEL之间的相互作用主要由范德华力和氢键主导, 二者通过这些作用力实现稳定结合, 该结论与热力学计算结果相符。 红外光谱结果也支持这一结论。
In this study, the interaction between fulvic acid (FA) and cellulase (CEL) and its impact on CEL conformation were systematically investigated using fluorescence spectroscopy, synchronous fluorescence spectroscopy, three-dimensional fluorescence spectroscopy, UV-VIS absorption spectroscopy, circular dichroism, infrared spectroscopy, and molecular docking simulations. Fluorescence quenching analysis revealed that the fluorescence intensity of FA decreased in a concentration-dependent manner with increasing CEL concentration. Moreover, the quenching constant decreased with rising temperature, indicating FA's significant static quenching effect on CEL fluorescence. Thermodynamic analysis demonstrated that the interaction between FA and CEL is primarily driven by van der Waals forces and hydrogen bonding, rendering the reaction thermodynamically spontaneous. Förster resonance energy transfer theory suggests potential non-radiative energy transfer between FA and CEL. Ultraviolet-visible absorption and synchronous fluorescence spectra further confirmed the static quenching mechanism and indicated changes in FA's structural density and amino acid residues' microenvironment. Circular dichroism analysis revealed that the binding site of FA and CEL is located in the hydrophobic cavity near the tryptophan residue, leading to reduced hydrophobicity in CEL's secondary structure and an extended peptide chain. This finding corroborates the interaction between FA and CEL and the influence of FA on CEL's secondary structure. Molecular docking studies also showed that the interaction between FA and CEL is predominantly governed by van der Waals forces and hydrogen bonds, achieving stable binding through these interactions, which aligns with the thermodynamic results. Infrared spectroscopy results further support this conclusion.
黄腐植酸(fulvic acid, FA)是一类相对分子量较低的腐植质物质。 作为褐煤腐植酸中活性和抗逆性最优的组分, 该物质不仅能够轻易溶于稀碱、 酸和水, 还具有芳香族、 脂肪族及多功能基团的结构特征[1](结构如图1所示)。 褐煤黄腐植酸以芳香族结构为核心, 含有丰富的含氧官能团(如羧基、 酚羟基、 醇羟基、 甲氧基和醌基等), 这些官能团作为关键活性位点赋予了黄腐植酸多种功能。 具体而言, 褐煤黄腐植酸能够调节土壤保水性[2]、 改良盐碱地[3]、 增强植物抗旱耐寒能力[4]、 提高抗病虫害性能、 阻遏重金属污染[5]、 提升肥料利用率以及促进农作物生长, 并且可以调控土壤pH值。 此外, 褐煤黄腐植酸能够促进土壤颗粒的团聚作用, 从而增强土壤结构的稳定性, 有效减轻侵蚀和养分流失。 因此, 将黄腐植酸添加到土壤改良剂中, 不仅可以提高土壤的水分稳定性, 还能改善土壤通气性, 进一步优化土壤对水分和养分的保持能力。 目前, 褐煤黄腐植酸在农业、 畜牧业、 医药工业以及环境领域得到了广泛的应用[6]。
纤维素酶(cellulase, CEL)是降解纤维素生成葡萄糖的一组酶的总称, 它是起协同作用的多组分酶系, 是一种复合酶[8](立体结构如图2所示)。 纤维素酶广泛存在于自然界的生物体中, 主要存在于细菌、 真菌和高等植物中, 用于分解纤维素[9]。 此外, 土壤中含有丰富的纤维素酶, 在土壤生态系统中起着至关重要的作用。 纤维素酶活性可以调节土壤代谢过程和养分转化能力, 是评价土壤中纤维素分解菌数量和活性的指标。 通过量化纤维素酶活性, 我们可以深入了解微生物领域的有机物分解动力学和养分循环机制[10]。 通过调节纤维素酶活性, 可以对植物中纤维素的降解速率产生影响, 从而控制农作物的生长发育[11]。 目前, 纤维素酶已广泛应用于食品、 能源和医药等领域[12], 深入研究纤维素酶将有助于进一步拓展其应用领域。
在化肥、 农药、 杀虫剂及土壤改良剂等的研发过程中, 分析其成分与土壤酶之间的相互作用是揭示作用机理的关键途径之一。 Gundi等在室内条件下研究了杀虫剂相互作用对土壤纤维素酶活性的影响, 发现低浓度杀虫剂的联合作用对土壤纤维素酶表现出加性或增效效应。 此外, 杀虫剂组合对土壤中纤维素酶活性的互作效应与杀虫剂处理下土壤中纤维素降解微生物群落的变化密切相关[14]。 Srinivasulu等研究了农药单独施用和联合施用对土壤中淀粉酶、 纤维素酶和转化酶活性的影响, 以探讨土壤中微生物与农药的相互作用。 研究结果表明, 在一定剂量下, 杀虫剂单独使用或与杀菌剂联合使用能够显著提高土壤中参与碳循环的关键酶(如淀粉酶、 纤维素酶和转化酶)的活性[15]。 当黄腐植酸作为土壤改良剂的成分进入土壤并发挥作用时, 会与土壤中的酶产生相互作用, 从而改变土壤的理化性质。 为了深入揭示黄腐植酸对土壤理化性质的影响机制, 并进一步优化其提高土壤对水分和养分的保持能力, 本研究采用多光谱分析方法和分子对接模拟技术, 系统探讨了黄腐植酸与纤维素酶之间的相互作用机理及其结合过程。 研究结果为黄腐植酸在土壤改良剂中的应用提供了重要的参考依据。 通过深入研究纤维素酶与黄腐植酸的结合及其作用机制, 可以确定黄腐植酸是否会影响酶的生理活性和稳定性[16]。 目前, 黄腐植酸与纤维素酶之间相互作用的具体机制尚未明确。 深入研究两者之间的相互作用将为揭示其作用机理提供重要的理论依据和参考价值。
1.1.1 仪器
紫外-可见分光光度计(上海仪电分析仪器有限公司, L6S); 傅里叶变换红外光谱仪(铂金埃尔默企业管理有限公司SPECTRUM 3); 电子天平丹佛仪器(北京)有限公司, 京制00000249号); 荧光分光光度计(美国PerkinElmer公司, LS-55); 圆二色光谱仪(英国应用光物理公司, Chirascan plus)。
1.1.2 试剂
制备浓度为1× 10-3 mol· L-1的黄腐植酸(fulvic Acid, 简称FA, 质量分数≥ 99%)溶液: 在分析天平上准确称量0.030 8 g的FA, 用去离子水将其定容至100 mL容量瓶中, 备用。
制备浓度为5× 10-5 mol· L-1的纤维素酶(Cellulase, 简称CEL, 纯度≥ 99%)溶液: 在分析天平准确称量0.120 0 g 的CEL, 用去离子水将其定容至100 mL蒸馏瓶中, 备用。
实验室所有用到的试剂全部为分析纯, 实验所用的水均为去离子水。
1.2.1 FA与CEL荧光光谱法的测定
取9只10 mL比色管, 用移液管移取0.8 mL的CEL溶液(c=5× 10-5 mol· L-1)到比色管中, 然后再分别移取0, 0.5, 1, 1.5, 2, 2.5, 3, 3.5和4 mL的FA溶液(c=1× 10-3 mol· L-1)到比色管中, 用去离子水定容至刻度, 摇勺, 静置10 min。 设置恒温水浴锅温度分别为298、 303和308 K, 将比色管放置在恒温水浴锅中20 min, 随后测定比色管中溶液的荧光强度。 荧光分光光度计参数设置: 激发波长为280 nm; 发射波长为290~550 nm; 狭缝宽度为5 nm; 光谱扫描速度为1 500 nm· min-1。 分别扫描温度为298、 303和308 K时的发射光谱, 并记录下相应的荧光值。
1.2.2 FA与CEL的同步光谱测定
测定同步荧光光谱时溶液配制过程与荧光光谱相同。 定容后的溶液中CEL的浓度为4× 10-6 mol· L-1, FA浓度分别为(0, 0.5, 1.0, 1.5, 2.0, 2.5, 3.0, 3.5, 4.0)× 10-4 mol· L-1。 荧光分光光度计参数设置: 激发波长为280 nm; 狭缝宽度为5.0nm; 扫描速度为1 500 nm· min-1。 分别测定发射波长265 nm, Δ λ =15 nm和发射波长310 nm, Δ λ =60 nm时的同步荧光光谱。
1.2.3 FA与CEL的三维荧光光谱测定
取2 mL的CEL溶液(c=5× 10-5 mol· L-1)放入两个比色管中, 然后移取1 mL的FA溶液(c=1× 10-3 mol· L-1)放入一个比色管中, 用去离子水定容至刻度, 摇匀静置。 此时所得溶液中CEL的浓度为1× 10-5 mol· L-1, FA溶液的浓度分别为0和1× 10-4 mol· L-1。 用荧光分光度计分别测定2个比色管溶液的三维荧光光谱图, 记录荧光值。
参数设定为: 发射波长范围为200~500 nm; 狭缝宽度为5 nm; 扫描速度为1 500 nm· min-1; 激光波长为200 nm; 激发波长间隔为5 nm; 连续测定30组。
1.2.4 FA与CEL的紫外-可见吸收光谱测定
取9支10 mL的比色管, 先分别用移液管移取2 mL的CEL溶液(c=5× 10-5 mol· L-1), 再分别加入0, 0.5, 1.0, 1.5, 2.0, 2.5, 3.0, 3.5, 4.0 mL的FA溶液(c=1.0× 10-3 mol· L-1), 用去离子水定容至刻度, 摇匀、 静置。 用去离子水作参比, 测定波长在190~400 nm之间不同浓度的FA与CEL的紫外吸收光谱。
1.2.5 结合距离的测定
取两个10 mL比色管, 用移液管分别移取1.2 mL的CEL溶液(c=5× 10-5 mol· L-1)到比色管中, 在其中一个比色管中, 再移取0.06 mL的FA溶液(c=1× 10-3 mol· L-1), 用去离子水定容, 测定其荧光光谱。
取一个10 mL比色管, 用移液管移取0.06 mL的FA溶液(c=1× 10-3 mol· L-1), 用去离子水定容, 并进行紫外光谱分析。 紫外可见分光光度计的测量波长设定在190和400 nm 之间。 荧光分光光度计的激发波长设定为280 nm, 狭缝的宽度设定为7 nm, 光谱的扫描速度设定为1 500 nm· min-1, 发射波长的发射光谱设定为290~550 nm, 记录数据。
1.2.6 FA与CEL体系圆二色谱的测定
取2支一样的比色管, 向其中一支比色管里加入2 mL浓度为5× 10-5 mol· L-1的CEL溶液, 用二次蒸馏水定容至刻度线, 摇匀; 再向另一支比色管里加入2 mL浓度为5× 10-5 mol· L-1的CEL溶液和6 mL浓度为5× 10-5 mol· L-1的FA溶液, 再用去离子水定容至刻度线, 摇匀, 测定其圆二色谱。
1.2.7 FA与CEL相互作用的红外光谱测定
称量FA与CEL的干燥固体颗粒, 依照质量比1∶ 1和1∶ 0进行混合, 再进行研磨, 研磨5 min后, 将溴化钾晶体与FA药品和FA与CEL混合药品分别用玛瑙研钵充分研磨, 样品与溴化钾的质量比例大约为1∶ 100, 即使用十万分之一的天平, 准确称量1~1.5 mg的样品与100 mg左右的溴化钾混合后压片。 将扫描范围设定在500~4 500 cm-1, 分辨率设为4 cm-1, 扫描次数设定为40次, 然后测定红外光谱。
1.2.8 FA与CEL的分子对接模拟
利用网站(https://zdock.umassmed.edu/), 选择ZDOCK 3.0.2进行黄腐植酸作为配体与纤维素酶的分子对接。 采用RCSB蛋白数据库提供的分辨率为1.90 Å 的纤维素酶PDB文件(1G9G)。 此外, 从Pubchem (Compound CID: 440950)获得了黄腐植酸3D结构的SDF格式。 随后, 作者利用Discovery Studio 4.5 Client软件保存PDB格式, 并利用该软件进行分子对接研究, 旨在预测能够有效结合蛋白结合位点的小分子模式[17, 18]。 为了准确地确定配体与酶结合的位置, 需要进行初始对接程序。 随后, 进行了额外的对接模拟, 以确定FA和CEL构型的相互作用状态和最佳立体化学构型。 在整个分子对接过程中, 酶保持刚性, 而FA表现出一定的灵活性。 考虑了FA的方向和随机扭转等因素。 选择结合能最有利的配体建立其结合模式。 在分子对接研究中, CEL和FA混合物的网盒尺寸设置为126 Å × 126 Å × 126 Å , 描述间距为0.575 Å 。 在网格框架中, 所有网格间距为1a的临界氢原子都附着在酶上。 利用Lamarck遗传算法进行了200次分子对接研究。 利用AutoDock 4.2.6软件研究FA与纤维素酶的分子间相互作用[19, 20]。
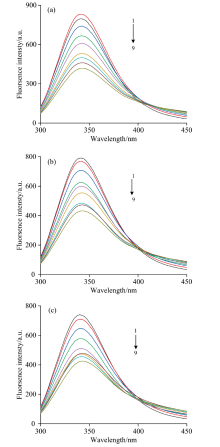
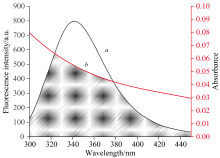
CEL是一种内源性荧光物质, 其激发波长设置为280 nm, CEL的最大荧光峰出现在350 nm附近。 FA对CEL的荧光猝灭如图3所示。
图3是对298、 303和308 K的研究, FA对CEL相互作用后, 在保持CEL的浓度不变时, 按顺序逐渐增大FA的溶液浓度, CEL的荧光强度规律性下降, 但发射峰位置没有明显变化, 所以证明FA与CEL发生了相互作用, 并使荧光强度发生猝灭。
分子与蛋白质分子相互作用的过程, 包括静态猝灭和动态猝灭两种猝灭途径[21]。 动态猝灭是一种将电荷或者能源进行转移的作用过程, 静态猝灭是电子发生了相互配合的作用, 从而形成了不发射出荧光的相互配合体。 这两种猝灭方式都是遵循Stern-Volmer方程[22]。
式(1)中, F0为未加FA的荧光强度, 而F是加入CEL的荧光强度, τ 0是生物大分子内源荧光寿命, [Q]是猝灭剂的浓度, Kq是猝灭速率常数, KSV是动态猝灭常数, τ 0是没有猝灭剂时生物体内的大分子的内源性的荧光寿命, 约为10-8 s。 利用式(1)计算数据, 将所得结果列入表1中。
| 表1 Stern-Volmer线性方程及相关系数 Table 1 Stern-Volmer linear equations and correlation coefficients |
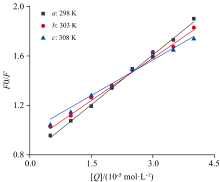
以F0/F为纵坐标, 以CEL总浓度[Q]为横坐标, 绘制FA-CEL体系的Sterm-Volmer荧光猝灭曲线, 如图4所示。 回归方程的斜率表示KSV, 相关系数R2由统计学原理确定。 淬火常数Kq由式1计算。 由表1可知, FA-CEL体系的猝灭常数(Kq)超过2× 1010 L· (mol· s)-1, 并随着温度的降低而不断降低。 综上所述, FA对CEL的猝灭机理不是分子碰撞、 扩散等动态过程, 而是基态配合物中分子间配位引起的静态猝灭。
计算结果表明静态荧光猝灭作用是FA导致CEL发生荧光猝灭最主要的原因, 对于静态猝灭过程, 假设小分子上存在n个结合位点数, 利用静态猝灭双对数公式计算[23]。
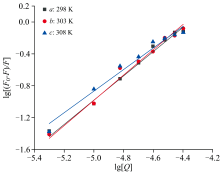
以lg[Q]为x轴, lg[(F0-F)/F]为y轴绘制FA诱导CEL猝灭的Scatchard方程, 如图5所示。 通过分析曲线的斜率和截距, 我们计算出不同温度T下的结合常数KA和结合位点数n的值, 如表2所示。 从表2的结果可以明显看出, 与CEL相比, FA具有明显更高的结合常数KA, 达到103个数量级。 此外, KA随着温度的升高而持续降低, 但在每个温度下两种化合物的结合位点都保持在一个左右, 表明FA和CEL之间具有很强的亲和力。
 | 图5 不同温度下FA对CEL的猝灭Scatchard方程Fig.5 Scatchard equation for the quenching of CEL by FA at different temperatures |
| 表2 三种温度下的结合常数KA和结合位数n Table 2 Binding constant KA and number of binding bits n at three temperatures |
实验测定了FA的紫外吸收光谱和CEL的荧光发射光谱, 发现两种光谱之间具有一定的重叠(如图6所示), 因此存在非辐射能量转移的可能性[24]。
根据Fö rster's非辐射能量转移理论[25], 能量转移的效率E取决于重叠面积大小, 供受体间的距离以及受体过度耦合的相对位置, 能量转移的效率E和FA与CEL的结合距离, 可根据式(3)— 式(5)计算出
式(3)— 式(5)中, F为FA与CEL浓度比为1∶ 1时蛋白质的荧光发射峰强度, F0为未加入FA前CEL的荧光强度, R0为能量转移效率为E=50%时的临界距离, K2为偶极空间取向因子(取K2=2/3), n为介质的折射率(一般取水和有机物的平均值即n=1.336), φ 是供能体的荧光量子产率(CEL中色氨酸残基量子效率φ =0.118J), J为CEL的荧光发射光谱和FA的紫外吸收光谱的光谱重叠积分, F(λ )为
CEL在波长λ 处荧光强度, ε (λ )为能量受体FA在波长λ 处的摩尔吸光系数。
根据所列式(3)— 式(5)求得两者之间重合部分的积分J=7.917× 10-20 cm3· L· mol-1, R0=0.736 nm, E=47.45%, r=0.748 6 nm。 因为r< 7 nm, 0.5R0< r< 1.5R0的非辐射能量转移临界距离, 因此可以推断出CEL与FA之间能发生非辐射能量转移[26]。
Ross理论可以用于判断结合反应的实际作用力[27]。 当Δ H< 0, Δ S< 0时, 作用力为范德华力和氢键; Δ H< 0, Δ S> 0时, 作用为静电作用力。
根据Vant'Hoff式(6)— 式(8), 计算出298、 303和308 K下热力学参数焓变Δ H=-353.5 kJ· mol-1, 熵变Δ S=-111.6 J· (mol· K)-1, 吉布斯自由能Δ G=-257.9 kJ· mol-1(298 K), Δ G=-254.1 kJ· mol-1(303 K), Δ G=-299.2 kJ· mol-1(308 K), 可知, Δ H< 0, Δ S< 0能推测出FA和CEL间主要作用力是范德华力和氢键作用力, Δ G< 0, 说明FA和CEL的静态猝灭为自发, 放热的结合过程。
| 表3 不同温度下FA-CEL的热力学参数 Table 3 Thermodynamic parameters of FA-CEL at different temperatures |
为了评估FA与CEL之间的相互作用, 使用分子对接模拟程序进行了200次重复实验。 实验结果包括最终分子间能量、 自由结合能、 抑制常数(Ki)以及氢键和静电相互作用能, 并将这些数据汇总于表4中。 自由结合能计算值为负(-14.54 kJ· mol-1), 表明FA与CEL自发相互作用。
| 表4 200次对接后的对接结果及相互作用残留物 Table 4 Docking results with the interacting residues after 200 runs of docking |
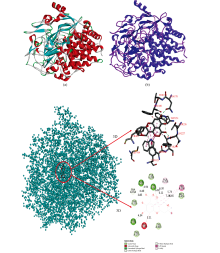
根据图7(a)和(b)所示, FA被CEL立体结构包裹, 且FA整个分子处于CEL分子结构的活性中心处。 进一步观察FA与CEL的微环境作用情况, 具体分析FA与CEL中的各氨基酸残基的作用力。
图7(c)所示, FA与CEL中的THR174, THR226, TYR299, TYR403和MET414等氨基酸残基之间存在范德华力。 FA与ASN178, ASN227, TRP154和TYR323氨基酸残基形成氢键(Conventional Hydrogen Bond, Carbon Hydrogen Bond, Pi-Donor Hydrogen Bond), 键长为4.34、 4.94、 3.85、 4.48和6.02、 6.22 Å 。 由此可知, FA与CEL之间主要作用力为氢键和范德华力。
除上述作用力外, FA与CEL中氨基酸残基PHE108还存在不利碰撞作用形式, 键长为3.21 Å 。 FA与CEL中的氨基酸残基TRP198存在着π — π 堆叠作用力, 键长为5.73、 6.65和7.29 Å , 并且与CEL中的ALA288存在疏水作用力(Pi-Alkyl), 键长为6.30 Å 。 分子对接模拟结果表明, 多种作用力的相互作用使FA与CEL二者之间稳定结合, 形成了较稳定化合物。
2.7.1 FA对CEL作用的紫外光谱分析
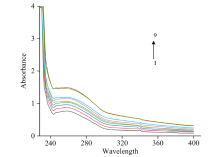
紫外分光光度法是光谱法的重要组成部分, 是通过测定被测物质在特定波长处或一定波长范围内的吸光度或发光强度, 对该物质进行定性和定量分析的方法。 对FA-CEL体系的吸光度进行测定, 绘制紫外吸收光谱图如图8所示。
图8是在298 K温度下, FA与CEL相互作用的紫外光谱图。 根据图8所示, 随着FA浓度的增加, CEL的吸收峰吸光度显著增强。 由于动态猝灭仅影响荧光分子的激发态而不改变其吸收光谱, 而静态猝灭则会因基态分子的变化而导致吸收光谱的改变。 因此, 这一现象表明FA与CEL之间存在相互作用, 并且猝灭机制为静态猝灭。 最大吸收峰从258 nm处红移至260 nm处, 红移了2 nm。 红移的原因是小分子碱基与π 电子结合, 导致π — π * 跃迁能量降低。 这表明CEL内部的色氨酸和酪氨酸残基所处环境的极性增加, 亲水性增强而疏水性减弱。 因此, FA的加入引起了CEL二级结构的变化。
2.7.2 FA与CEL作用的同步荧光光谱分析
波长差值Δ λ =15 nm时, 光谱图对应CEL酪氨酸(Tyr)的同步荧光光谱图如图9(a)所示; 在波长值Δ λ =60nm时, 对应CEL色氨酸(Trp)的同步荧光光谱如图9(b)所示。 固定CEL的浓度不变, 随着FA的溶液浓度的增加, 酪氨酸(Tyr)与色氨酸(Trp)的荧光强度发生了规律性的降低, Δ λ =15 nm时酪氨酸(Tyr)的同步荧光峰值基本没有发生明显改变, 荧光猝灭程度小; Δ λ =60 nm时但色氨酸(Tyr)残基的同步荧光峰值对应波长随者FA的浓度的增长发生红移现象, 从289 nm红移到292 nm, 红移了3 nm, 说明包围在CEL内部的色氨酸和酪氨酸残基的极性增大, 亲水性增大, 疏水性减小。 且色氨酸(Trp)荧光猝灭程度高于酪氨酸(Tyr)荧光猝灭程度。 表明FA主要作用于CEL的色氨酸残基(Trp)上, 所以导致了FA的二级结构发生了变化。
2.7.3 FA和CEL三维荧光光谱测定
如图10所示, 三维荧光光谱呈现出两个显著特征: 一是被称为“ 脊峰” 的散射峰, 二是呈现为类似“ 驼峰” 形状的特征荧光峰, 分别标记为峰1和峰2。 这些峰类似于在等高线地图上观察到的中央“ 指纹线” 。 在图10中, 在280 nm附近的激发波长(λ ex)观察到的PEAK 2归因于蛋白质中的多胺肽链结构, 而280 nm附近的PEAK 1主要代表CEL中色氨酸残基的荧光光谱特征, 这与FA的二级结构有关。 如图9(a)所示, 当FA不存在时, CEL的荧光峰(λ ex/λ em, F)有两个特征参数: (280.0/341.0, 609.0)和(225.0/339.0, 434.3)。 此外, 如图10(b)所示, 在系统中加入FA后, FA-CEL配合物的荧光峰参数移至(280.0/344.0, 424.8)和(230.0/341.0, 253 .9)。
 | 图10(a) CEL溶液的三维荧光图以及三维等高线图 c(CEL)=1× 10-5 mol· L-1; T=298 KFig.10(a) Three dimensional fluorescence and three dimensional contour map of CEL solution c(CEL)=1× 10-5 mol· L-1; T=298 K |
根据表5所示, PEAK1峰的荧光强度减弱, 这表明CEL中的多肽段发生了水解。 此外, FA与CEL相互作用导致PEAK2的最大发射波长从339 nm红移到341 nm。 这种转变意味着由于FA加入后, CEL中Trp和Tyr残基的极性和亲水性增加, 进而降低了其疏水性。 因此, FA诱导了CEL二级结构的改变。 综上所述, FA调节了CEL微环境因素和构象特征。
| 表5 三维荧光光谱特征参数 Table 5 Characteristic parameters of 3D fluorescence spectrum |
2.7.4 FA与CEL体系的圆二色谱分析
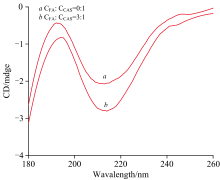
如图11所示, CEL分子的圆二色性(CD)光谱在254 nm处显示出一个特征的单负峰, 表明β 折叠。 该吸收峰的大小可作为蛋白质二级结构含量变化的指标。 为了确定CEL和FA-CEL体系的二级结构含量值, 利用CD色谱数据并将其输入CDNN软件。
表6的分析表明, CEL主要采用β -折叠(β -sheet)构象, 其含量为46.2%。 将CEL与FA的浓度比调整为c(FA)∶ c(CEL)=1∶ 3后, CEL的β -折叠(β -sheet)含量由46.2%降至44.8%。 α -螺旋(α -Helix)含量从3.80%下降到3.50%, β -转角(β -Turn)含量从19.3%略微上升到19.0%, 无规则扭转(Random coil)含量从35.3%略微上升到34.9%。 这些发现表明, FA与CEL相互作用, 诱导其微环境的改变, 从而影响其二级结构。
| 表6 CEL和FA-CEL二级结构含量 Table 6 Secondary structure content of CEL and FA-CEL |
2.7.5 FA与CEL相互作用的红外光谱测定
蛋白质的二级结构是指多肽链在蛋白质分子中的局部折叠方式, 主要通过氢键形成稳定的构象。 这种结构是蛋白质空间结构的基础层次, 常见的二级结构包括α -螺旋和β -折叠。
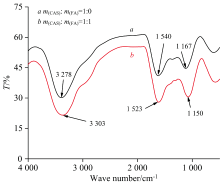
在CEL的红外光谱图中(如图12所示), 加入FA之后CEL的峰值从3 278 cm-1移到3 303 cm-1, 透过率减小, 该吸收峰是由酰胺带的N— H伸缩振动的, N— H的吸收峰主要在3 500~3 200 cm-1附近。 位于酰胺Ⅰ 带(1 600~1 500 cm-1)内的峰值从1 540 cm-1移动到1 523 cm-1, 是由C— N伸缩振动于N— H弯曲振动引起的。 位于酰胺Ⅱ 带(1 200~1 100 cm-1)内的峰值从1 150 cm-1移动到1 167 cm-1, 是由C=O伸缩振动产生的。 FA和CEL结构中的N— H、 C— N和C=O发生了作用, 使CEL的透过率减小, 所以FA使CEL的二级结构发生较大改变。
在多种实验条件下系统地分析了FA与CEL在模拟生理环境中的相互作用。 在FA-CEL体系内改变FA浓度, 导致CEL的荧光发生猝灭。 根据加入FA前后CEL的紫外可见吸收光谱结果显示, 推断FA对CEL是静态猝灭。 由Stern-Volmer方程得出的实际猝灭速率常数Kq, 其数值远大于最大速率常数, 并且猝灭常数KSV随着温度的升高而呈现规律性地减小, 可以推断FA-CEL体系的作用过程是静态猝灭过程。 同步荧光和三维荧光的光谱研究表明, FA的作用使得CEL的结构密度发生变化并且CEL内部的氨基酸残基微环境发生改变。 紫外可见吸收光谱分析, 可以进一步证明FA与CEL是通过静态猝灭的方式相互作用的, 并且FA在289 nm 处的吸收峰主要是由其肽链上的色氨酸Trp残基和酪氨酸Tyr残基的苯杂环π — π * 跃迁引起的, 从而改变CEL二级结构。 圆二色谱分析证明了CEL中主要由β -折叠与β -转角结构占主导, 通过FA诱导使CEL的二级结构发生了改变。 红外光谱分析对FA与FA-CEL体系的酰胺带Ⅰ 和酰胺带Ⅱ 峰的位置、 宽度和相对强度进行研究, 说明CEL的二级结构发生了改变。 利用分子对接模拟技术进行FA对CEL作用分析, FA-CEL中除氢键与范德华力外还存在着疏水作用力以及静电力, 多种力的相互作用使FA与CEL稳定结合。 以上分析结果证明了分子水平上FA与CEL的作用机理, 说明FA改变了纤维素酶的稳定性和生物学特性, 会对动植物体内和土壤中的纤维素酶产生一定的影响, 为更加科学合理的利用黄腐植酸提供了数据支持。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|