作者简介: 谭方萍, 2001年生,西藏大学硕士研究生 e-mail: m19123282213@163.com
灵芝是一种有悠久药用历史的名贵真菌, 因其种类繁多且生长环境各异, 使得灵芝的真伪鉴别和品质评价面临挑战。 结合近红外光谱技术与光谱预处理方法, 对市场上不同生长环境的灵芝进行鉴定分析。 采集分析五种灵芝的近红外图谱, 利用光谱预处理方法(一阶导数、 二阶导数、 连续小波变换等方法进行基线校正, 以及多元散射校正、 标准正态变量变换等进行散射校正)消除背景、 散射、 噪声等干扰因素, 使得光谱数据更加准确地反映灵芝的特性, 深入研究基团特征吸收峰和含氢基团在近红外波段的分布特点。 结果显示: 不同生长环境下的灵芝菌柄与菌盖近红外光谱有明显的差异, 分别呈现出独特的特征吸收峰及含氢基团分布。 这些特征吸收峰与灵芝中的活性成分密切相关。 产地环境(如温度、 湿度、 光照等, 会影响灵芝的生长周期和代谢活动, 进而影响活性成分的合成和积累)和栽培条件(如不同的栽培原料木屑、 麦麸、 石膏等, 对灵芝的生长速度、 菌丝长势以及单体重、 菌柄长度、 菌柄直径、 菌盖直径、 菌盖厚度等有不同程度的影响, 进而影响灵芝中活性成分的含量和分布)是影响这些活性成分的关键因素, 提出了一种鉴别灵芝真伪的有效方法。 显著提升了灵芝产品的质量控制水平, 有助于更全面地评价灵芝的品质以及市场上劣质灵芝的淘汰, 确保消费者能够选择到合适的灵芝品种, 满足市场需求。
Ganoderma lucidum (G. lucidum), a precious fungus with a long history of medicinal use, faces challenges in authenticity identification and quality evaluation due to its diverse species and varying growth environments. This study integrates near-infrared spectroscopy (NIRS)and spectral preprocessing methods to analyze G. lucidum samples from different growthenvironments in the market. By collecting and analyzing NIRS data of five G. lucidum samples, spectral preprocessing methods—including baseline correction (first-/second-order derivatives, continuous wavelet transform (CWT)) and scattering correction (multiplicative scatter correction (MSC) , standard normal variate transformation (SNV))—were applied to eliminate background noise. This enhanced the accuracy of spectral data in reflecting the intrinsic characteristics of G. lucidum, with a focus on the distribution of characteristic absorption peaks and hydrogen-containing groups in the NIRS region. The results revealed significant differences in NIRS between the stipes and pilei of G. lucidum from distinct growth environments, exhibiting unique characteristic absorption peaks and hydrogen-containing group distributions. These absorption peaks were closely associated with active components in G. lucidum, where environmental factors (e. g., temperature, humidity, light intensity) and cultivation conditions (e. g., substrates such as sawdust, wheat bran, and gypsum) were identified as key determinants of active component synthesis and distribution. Environmental factors influence growth cycles and metabolic activities, while cultivation substrates affect growth rates, mycelial vigor, biomass, and morphological parameters (stipe length, stipe diameter, pileus diameter, pileus thickness). This method provides an effective approach for the authenticity identification of G. lucidum. Its implementation significantly enhances quality control of G. lucidum products, facilitates comprehensive quality evaluation, aids in eliminating inferior products in the market, and ensures consumers select appropriate G. lucidum varieties to meet market demands.
灵芝[1]最早记录于神农本草经, 位列上品, 据《本草纲目》记载, 芝本作之, 篆文象草生地上之形, 为了区别加上草字头, 又因其功效灵验, 故名灵芝, 在传统中医中已被使用数百年。 它的形态特征和生长受到各种环境因素的影响, 生长表现详见图1。 灵芝主要成分为多糖类、 三萜类、 核苷类以及在不同生长方式下存在微异的酚类成分, 不仅可以提高机体免疫力, 调节血压血脂血糖, 还可以抗肿瘤抗病毒。 现代药理学与临床实践证实了灵芝的药理作用, 并证实灵芝多糖是灵芝扶正固本、 滋补强壮、 延年益寿的主要成分。 因此灵芝常用于日常保健, 且多数人追求野生灵芝, 但由于野生灵芝常生长在高海拔地区或深山中, 数量非常少且价格更高, 不少不良商家将人工养殖的灵芝冠以“ 野生” 来提高档次, 以劣充优, 因而市场乱象丛生。 本研究基于近红外光谱技术[2]结合光谱预处理方法[3]对五种灵芝的近红外图谱进行预处理, 消除背景、 散射、 噪声等影响, 分析基团的特征吸收峰与含氢基团在近红外波段的分布情况, 以期实现对不同生长方式的灵芝进行有效鉴别。
在中国, 灵芝的主要产地分布较为广泛, 涵盖了多个省份和地区, 详细见图2。 通常情况下, 人们主要是看色泽、 观形态和闻气味来判断灵芝属于野生还是人工养殖, 实际上灵芝种类众多, 成分复杂(其生化成分及生物活性见图3), 单靠观察外形等难以区分灵芝质量的优劣。 现阶段近红外光谱法(near-infrared spectroscopy, NIRS)因其高效、 无损检测等优势, 已成为中药材鉴定的关键技术。 近红外光谱技术在食品安全检测[4]中的应用也日益广泛, 比如: 能在短时间内完成对食品样品的检测, 通过测量水果的近红外吸收来检测其新鲜度[5], 以及对食用油脂的种类鉴别与掺伪分析等; 而且检测过程中不需要对样品进行破坏性处理, 能够保持样品的完整性, 例如在检测牛奶成分时, 不需要对牛奶进行预处理[6]; 还能够检测到样品中微小的成分变化, 如对食品中的蛋白质、 糖类、 脂肪等成分进行定量分析, 并且检测结果具有较高的精度和可靠性[7]; 与传统化学检测方法相比, NIRS技术不需要使用有毒化学试剂, 避免了环境污染和对操作人员的健康风险。 本研究采用NIRS技术对不同产地的灵芝进行分析, 实现了野生灵芝与人工养殖灵芝的有效区分。 实验中将灵芝的菌柄与菌盖分开处理, 采用近红外光谱技术, 得到五种灵芝菌柄与菌盖在波长350~2 500 nm的指纹图谱数据, 利用origin等软件绘制出相应的光谱图像, 再通过光谱预处理方法对数据进行分析。 红外图谱技术具有不损伤样品, 不经过化学处理, 光谱特征信号强, 样品使用量小等优点。 红外光谱分为三个波段, 分别为近红外波段(780~2 500 nm), 中红外光谱区(可分成1 300~4 000和600~1 300 nm两个区域。 最有分析价值的基团频率在1 300~4 000 nm之间, 这一区域称为基团频率区、 官能团区或特征区), 和远红外波段(大于25 000 nm); 其中近红外波段主要分析含氢基团的特征吸收峰(— OH, — CH), 中红外波段[8]研究多数有机与无机化合物的化学键, 远红外波段[9]研究金属有机化合物的振动键。
实验的样品分别是野生八一灵芝、 野生金边灵芝、 人工金边灵芝、 尼泊尔赤芝和人工赤芝(详见表1), 且每个地区均选取了的多个样品, 详细见图4。 八一灵芝产自西藏林芝八一地区, 生长在海拔三千米的高原, 一般呈半球形或圆柱形, 表面有明显的纹路与可见的环节数。 金边灵芝顾名思义是灵芝在成熟时菌柄周边为金黄色的一种形态名, 金边灵芝的子实体非常饱满, 蕴含了最为精华的种子-灵芝孢子粉。 尼泊尔赤芝又称桑松赤芝, 主要产自喜马拉雅山脉及其周边地区, 尼泊尔赤芝形态长而细, 呈红棕色, 它仅在半年寒暑交替时生长1~3 cm, 因此尼泊尔赤芝价格昂贵且数量稀少。 人工赤芝也称人工栽培赤灵芝, 人工赤芝与天然赤芝形态相似, 但从营养成分上看两者品质功效有一些差异, 人工赤芝不能代替天然赤芝。 灵芝由菌柄与菌盖构成, 我们对每种灵芝的菌柄与菌盖进行对比研究, 同时得出灵芝不同的部位在不同的生长环境下的区别。
| 表1 样品资料 Table 1 Sample information |
 | 图4 五种灵芝样品(按表1序号排列)Fig.4 Five different ganoderma lucidum samples (arranged according to the serial numbers in Table 1) |
实验用仪器及生产厂家见表2, 其所对应的部分实物见图5。
| 表2 实验仪器 Table 2 Experimental instruments |
首先对灵芝样品进行编号, 按顺序进行清洗, 清洗过后放入50 ℃真空干燥箱干燥6 h, 再通过中药粉碎机将样品粉碎, 取3 g用于建立灵芝的近红外图谱库。 根据灵芝的不同来源与性质, 粉碎可采用单独粉碎、 混合粉碎、 干/湿法粉碎等方法。 本实验采用的是单独粉碎法, 以确保实验的结果准确性。 在样品粉碎前先对样品进行清洗、 烘干、 切碎成小块, 在粉碎过程中要注意不能掺杂金属物, 否则容易起火。 使用分析天平过程中, 为了保证称量结果的准确, 对使用环境有严格要求, 远离通风口, 周围没有高压线变压器, 同时保证天平处于水平位置。 粉末压片机工作流程: 填充— 计量— 压片— 成品收集, 将灵芝粉末填入模孔, 保证每个模孔中填充的灵芝重量一致, 通过上下压轮将灵芝压成片, 最后将压成片的灵芝收集。 参考已有的相关灵芝文献[10, 11], 确定灵芝的采集参数, 使用傅里叶红外色谱仪采用高密度接触式反射探头直接照射样品, 扫描波长范围为350~2 500 nm, 分辨率为3 cm-1, 扫描64次, 每个样品进行3次测量, 并最后取平均光谱。
近红外光谱广泛应用于化学分析[12, 13]、 药品检测[14]等多个领域。 其原理是: 当近红外光照射到样品上时, 部分光被样品吸收, 部分光被散射, 根据吸收光谱的特征, 可以推断出样品的化学成分, 详见图6。
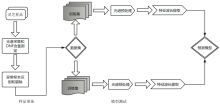
近红外光谱数据分析方法常用于鉴定和解析样品的特性。 在灵芝的产地鉴别方面, 它提供了一种高效的途径。 其近红外光谱分析过程见图7。
1.3.1 光谱预处理方法的选择
由于实验所得光谱数据容易受到噪声、 背景、 散光等[15, 16, 17]干扰, 会导致实验误差增加或分析效果不佳, 影响数据质量与结果的准确性, 因此要对实验数据进行预处理, 方法详见表3。 预处理的步骤是由基线校正、 散射校正、 平滑处理和尺度缩放[18, 19, 20]四部分完成, 处理后将有助于提高光谱数据的质量, 使得后续的分析工作更加准确和有效。
| 表3 光谱预处理方法 Table 3 Spectral preprocessing methods |
基线校正主要包括一、 二阶导数以及连续小波变换(continuous wavelet transform, CWT)。 基线校正可以有效地控制仪器背景与基线漂移带来的影响, 一阶导与二阶导可以消除曲线背景, 使光谱的分辨率更高; CWT可以将曲线背景矫正同时还能去除噪声, 使光谱图像更光滑。 一阶导和二阶导对数据的平滑和去除噪声有一定的鲁棒性, 并且对数据的平稳性要求相对较低。 CWT对数据的噪声和平稳性要求较高, 如果数据存在噪声或不平稳性, 连续小波变换可能会产生不准确或混乱的结果, 因此基线校正采用一阶导与二阶导方法。 散射校正包括多元散射校正(multivariate scatter correction, MSC)、 标准正态变量(standard normal variate, SNV), 这两种方法主要是消除实验样品因其大小, 形状, 分布不均等因素对模型的影响, 其中MSC是对所有样本进行数据处理, 将得到的数据平均值作为标准进行比较, SNV是对一组数据进行数据分析, 通过标准差对所有光谱数据进行纠正, 两种都是光谱数据预处理中消除散射常用的方法, 可以通过实际效果选择更合适的消除散射方法。 平滑处理一般采用S-G平滑(多项式平滑法), 在光谱预处理步骤中, 所有平滑处理方法都是为了消除光谱图中的随机噪声, 我们可以通过周期性改变原始窗口数量对数据拟合以提高样本的信噪比。 尺度缩放可以消除数据尺度差距过大带来的影响, 最大最小归一化是把每组光谱中去掉最小值后与最大最小值的差值之比。 实验所得的灵芝近红外光谱数据有明确边界和范围, 采用最大最小归一化方法更合适, 且最大最小归一化适用于大规模数据集。
1.3.2 光谱预处理结果分析
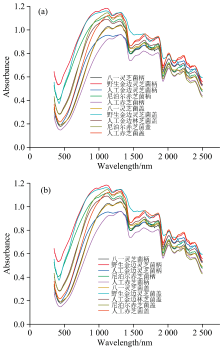
将各样本的吸光度数据导入光谱分析软件, 并对原始数据进行S-G平滑处理, 绘制的波长-吸光度百分比图, 详见图8。
在光谱采集过程中, 数据质量受到多种因素的影响, 包括随机噪声[21]和基线漂移[22], 这些因素可能会降低后续分析模型的准确性。 为了改善数据质量, 我们对原始光谱数据进行了平滑处理, 如图8(b)所示。 通过平滑处理, 灵芝在440、 1 320、 1 447、 1 921和2 236 nm处的吸收峰变得明显。 特别在520~1 380 nm波长范围内, 野生金边灵芝的菌柄和菌盖吸光度高于人工金边灵芝, 这可能与其独特的生长环境和地理位置有关, 为区分野生与人工金边灵芝提供了科学依据。
为了进一步消除样品间由于光程长度或样品浓度差异引起的光谱强度变化, 我们对灵芝样本数据进行了最大最小归一化处理, 将所有光谱数据缩放到0到1的范围内, 如图9所示。 归一化处理有助于在同一尺度上比较不同样品的光谱, 图9中经过处理的数据在1 450~2 500 nm波长范围内样品被明显分离, 尤其是在1 670、 1 863和2 019 nm处的峰值变得更加明显。 人工金边灵芝在该波长范围内的吸光度远高于其他灵芝样品, 表明这些波长范围可以作为人工金边灵芝与其他灵芝鉴别的特征波段。
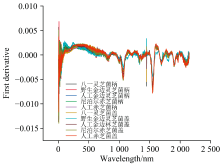
为了深入探究光谱数据中的细微变化和吸收峰的精确位置, 对平滑处理后的数据进行了一阶导数[23]计算, 结果如图10所示。 一阶导数处理显著增强了光谱中的吸收峰差异, 使得原本不明显的光谱特征得到突出, 从而更清晰地识别和解析重叠峰。 图10显示, 野生金边灵芝在360、 454、 603、 1 801和2 064 nm处的吸收峰相较于其他灵芝更为突出, 这不仅验证了平滑处理后的结论, 而且进一步验证了野生金边灵芝中的相关药用成分要高于其他灵芝。
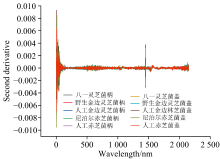
考虑到灵芝化学结构的复杂性和成分的多样性, 常常出现多种成分吸收峰的叠加现象。 因此, 在一阶导数的基础上, 我们进一步进行了二阶导数计算, 以使峰值更加突出和清晰, 如图11所示。 二阶导数处理后, 2 450 nm波长处的特征峰变得更加明显, 进一步突出了野生金边灵芝与其他灵芝的差异性。 然而, 在400和1 800 nm处的特征峰形状相似, 二阶导数处理未能提供足够的信息来区分它们, 这可能是由于原始数据信噪比较低, 二阶导数处理放大了噪声, 掩盖了光谱的真实特征。
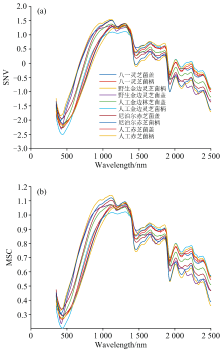
灵芝的红外光谱原始数据可能受到颗粒大小、 密度和生长环境等多种因素的影响, 导致光谱中的散射效应和基线漂移。 这一现象在何晋浙[24]等的研究中得到了验证。 他们对不同地区的灵芝的红外光谱数据进行了分析, 发现不同地区的灵芝在光谱峰值有明显的差异。 为了提高光谱数据的信噪比并确保分析结果的精确性, 我们对原始红外光谱数据进行了预处理, 包括标准正态变量变换(SNV)和多元散射校正(MSC), 如图12所示。 这些预处理方法有效地提高了数据集的一致性和分析模型的鲁棒性。 考虑到灵芝样本质地坚硬可能导致颗粒大小不一, 经过MSC处理后的图像显示出较大的振幅变化, 而SNV处理显示出更高的适用性。 通过SNV处理得到的光谱图谱显示, 在446和1 210 nm波长处, 人工金边灵芝菌柄的吸光度显著低于其他样本, 这可能与其特有的生长环境和地理位置有关。 这一发现与刘有菊[25]等学者在保山市野生灵芝和人工栽培灵芝的红外光谱对比分析中的研究结果一致, 他们也发现在二阶导数光谱中, 野生灵芝与人工栽培灵芝在波长约为1 400 nm处均呈现出显著的特征峰。 因此, 这些波长处的吸光度差异可以作为区分人工与(野)生金边灵芝的重要依据, 为灵芝的鉴别提供了一种有效的分析手段。
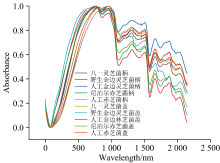
我们采集了五种不同灵芝实体的近红外波段图谱, 以评估和比较它们在特定波长范围内的吸收特征。 图13是五种灵芝菌柄菌盖的近红外波段图谱, 展示了各自独特的光谱特征, 这些特征为我们提供了关于灵芝中活性成分含量和种类的重要信息。
图13(a)、 (b)、 (e)三种是野生灵芝, (c)、 (d)两种是人工养殖的灵芝, 从图中明显看出野生灵芝菌柄菌盖的吸光度几乎完全重叠, 揭示其不同部位所含化学成分的细微差异[26]; 而两种人工养殖的灵芝菌柄与菌盖吸光度相差较大, 且人工养殖的灵芝菌盖吸光度始终高于菌柄, 我们可以通过这种方法来判断灵芝的生长方式。 整体分析图形可看出除野生金边灵芝外其余灵芝的菌柄与菌盖吸光度趋势基本相同, 而野生金边灵芝菌柄菌盖的吸光度趋势相差较大, 通过对比研究可得出是野生金边灵芝菌盖的吸光度趋势异常, 这是因为将样品研磨搅拌再取样属于随机取样, 导致取到比较偏僻的部位, 并且藏药在运输及加工过程中脱水程度不同, 影响近红外光谱的分析。 图14(a)是五种灵芝菌柄的吸光度对比图, 其中人工金边灵芝、 人工赤芝与八一灵芝的吸光度在波长350~1 120 nm处没有太大差异, 但相较于野生金边灵芝与尼泊尔赤芝的吸光度有明显差异, 在1 400~2 500 nm五种灵芝的吸光度差异小于350~1 400 nm, 整体来看, 野生金边灵芝、 尼泊尔赤芝这两种野生灵芝与人工金边灵芝、 人工赤芝这两种人工种植的灵芝相比是有明显的差异, 八一灵芝在350~1 120 nm波段与人工种植的灵芝吸光度非常接近, 但在1 120~1 300 nm八一灵芝吸光度明显高于人工种植的灵芝, 可以得出虽然野生灵芝菌柄的吸光度整体高于人工种植灵抓, 但即使同是野生灵芝, 在不同地域环境中生长也会有明显差异。 图14(b)为五种灵芝菌盖的吸光度对比图, 野生金边灵芝的吸光度高于其他四种灵芝, 尼泊尔赤芝、 人工赤芝与人工金边灵芝的吸光度相差不大, 八一灵芝在350~1 400 nm处吸光度低于其他四种灵芝, 在1 400~2 500 nm五种灵芝的菌盖吸光度没有太大差别, 对比两张图可以看出这几种灵芝的菌盖吸光度相差幅度小于菌柄, 菌盖中对应含氢基团的含量相差不大, 其中八一灵芝菌柄与菌盖最稳定, 图14(a)中两种人工种植的灵芝吸光度低于八一灵芝, 在图14(b)中高于八一灵芝, 可以得出人工养殖的灵芝菌柄与菌盖所含有的含氢基团相差较大。
 | 图14 五种不同灵芝菌柄(a)、 菌盖(b)光谱对比图Fig.14 Spectral comparison of stipes (a) and caps (b) of five ganoderma species |
灵芝酸F是一种从灵芝中分离出来的三萜类化合物, 在不同种类的灵芝真菌鉴别中起了重要作用。 在近红外光谱分析中, 灵芝酸F的特征吸收峰通常位于1 200~1 500 nm的波长范围内。 通过对图14(a)的分析, 我们观察到在这一特定波长范围内, 人工灵芝菌柄的吸光度显著低于野生灵芝菌柄。 这表明人工灵芝菌柄中灵芝酸F的含量低于野生灵芝菌柄。 并且, 图14(b)也显示出相同的趋势, 这可能归因于野生与人工灵芝不同的生长环境和条件, 这些差异可能影响了灵芝酸F的含量及其光谱特性。
光谱的解析一般需要通过特征频率和特征吸收峰来确定主要官能团信息, 物质的近红外光谱是其分子结构的反映, 谱图中的吸收峰与分子中各基团的振动形式相对应。 表4为常见基团的吸收峰, 而表5为实验用灵芝菌柄吸收峰所对应的含氢基团分布表, 表6为实验用灵芝菌盖吸收峰所对应的含氢基团分布表。
| 表4 基团的特征吸收峰(nm) Table 4 Characteristic absorption peaks of functional groups (nm) |
| 表5 菌柄吸收峰所对应的含氢基团表 Table 5 Hydro functional groups corresponding to absorption peaks of stipes |
| 表6 菌盖吸收峰所对应的含氢基团表 Table 6 Hydro functional groups corresponding to absorption peaks of caps |
将5种灵芝的近红外数据导入OMNIC中, 利用高斯乘积函数找峰法结合表5(基团的特征吸收峰)得到五种灵芝含氢基团的吸收峰, 将灵敏度调至75时, 系统在每个灵芝的菌柄、 菌盖处分别确定7组波峰, 其中C— H基团在这7组波峰中有4组, 剩余3组分别是位于合频区的N— H基团、 合频区的羧酸衍生物RCO2H以及灵芝的特有峰。 尝试将灵敏度再上调, 看是否可以找出更多的N— H基团与O— H基团, 将灵敏度调至99时发现, 野生八一灵芝、 野生金边灵芝与人工金边灵芝的菌柄波峰均为8个, 菌盖波峰为9个, 而两种赤芝的菌柄波峰为7个, 菌盖为8个波峰, 赤芝波峰比灵芝少一组, 然而并没有因为调高灵敏度使其他几种含氢基团的占比提高, C— H基团占比依然很大。 由于藏药在运输以及后期研磨加工等过程中会损失大量水分, 因此在红外图谱中探测到水的含量很少, 由此我们可知其他含氢基团在近红外光谱中弱于C— H基团。
根据波峰数据分析, 这五种灵芝在1 100~1 150 nm处都有C— H基团, 其中1 100 nm为C— H基团的ArCH, 1 130~1 150 nm的C— H基团均为饱和的CH3, 1 300 nm的波峰推测为灵芝在近红外波段的特有峰, 在1 650与1 800 nm 也含有不饱和C— H基团, 1 850 nm的羧酸衍生物中有含氢基团中的O— H, 波长为2 010 nm的酰胺基衍生物CONH2R, 波长2 200~2 500 nm范围均为C— H基团, 由于近红外光谱的谱峰重叠, 因此波长为2 380 nm处五种灵芝菌柄菌盖含有CH3、 CH2CH三种基团。 五种灵芝的近红外光谱图中, 1 440与1 930 nm处的波谷都是由于水的含量降低导致的。
采用一阶导数、 二阶导数、 多元散射矫正(MSC)和Savitzky-Golay(S-G)平滑等多种方法对五种灵芝的光谱数据进行了预处理, 以提高光谱分析的准确性和可靠性。 通过这些先进的数据处理技术, 我们成功地消除了由于样品制备过程中的颗粒大小不均引起的散射效应, 并减少了噪声的影响, 从而显著提高了光谱数据的质量。 主要结论如下:
(1)野生灵芝的菌柄和菌盖在近红外波段的吸光度较为接近, 表明其化学成分含量基本相同。 相比之下, 在特定波长范围内(如特征吸收峰1 200~1 500 nm), 野生灵芝的菌柄和菌盖的吸光度显著高于人工灵芝, 这表明野生灵芝中灵芝酸F的含量高于人工灵芝菌柄。 这可能与人工栽培条件下的环境控制有关。 我们的研究结果与现有文献中关于野生灵芝化学成分丰富性的观点相一致, 同时也揭示了人工种植条件下可能存在的化学成分差异。
(2)原始光谱数据受到多种因素的影响, 包括随机噪声和基线漂移, 这些因素会影响分析模型的准确性。 因此, 对数据进行平滑处理是必要的, 平滑处理后, 灵芝的吸收峰在特定波长处变得明显, 如440、 1 320、 1 447、 1 921和2 236 nm。 这有助于区分野生和人工金边灵芝。
(3)对平滑处理后的数据求一阶导数, 可以增强吸收峰的差异, 清晰识别重叠峰, 突出不明显的光谱特征。 野生金边灵芝在360、 454、 603、 1 801和2 064 nm处有明显突出峰。
(4)二阶导数处理使峰值更突出, 有助于识别野生金边灵芝与其他灵芝的差异。 但在某些波长处, 如400和1 800 nm, 二阶导数处理可能因放大噪声而难以区分特征峰。
(5)标准正态变量变换(SNV)和多元散射校正(MSC)是提高数据集一致性和分析模型鲁棒性的常用预处理方法。 在本研究中, SNV显示出更高的适用性。 经过SNV处理后, 人工金边灵芝菌柄在446和1 210 nm波长处的吸光度显著低于其他样本, 这可能与其生长环境和地理位置有关, 为区分人工与(野)生金边灵芝提供了依据。
对野生与人工种植灵芝的光谱特征进行了比较分析, 此外, 还探讨了灵芝生长环境对其化学成分的影响。 我们发现, 野生灵芝的活性成分与其生长环境密切相关, 包括土壤成分、 气候条件和周围植被等因素。 这些因素在灵芝生长过程中对化学物质的积累和组成产生了显著影响, 进而反映在近红外波段的光谱特征上。 这一发现为理解灵芝的生物活性和临床应用提供了新的视角。
尽管本研究在灵芝光谱分析方面取得了一定的进展, 但仍存在一些局限性。 例如, 我们未能全面探讨所有可能影响灵芝化学成分的环境因素。 因此, 未来的研究可以进一步探索这些因素, 以及它们如何影响灵芝的生物活性和临床效果。 此外, 我们建议未来的研究应更加关注环境因素对灵芝化学成分的影响。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|