作者简介: 胡玉霞,女, 1983年生,安徽建筑大学电子与信息工程学院博士研究生 e-mail: yxhuhf@163.com
研究水体中细菌微生物活性, 快速评估细菌在水体环境中的生长态势与繁殖能力, 对于水资源科学管理以及公共卫生安全保障具有重要意义。 传统细菌活性检测技术, 如菌落计数法、 染色观察法和分子生物学方法等, 虽然有效, 但操作流程繁琐, 耗费时间与人力, 难以满足实时在线检测的需要。 针对传统细菌活性检测技术的弊端, 提出了一种基于多波长透射光谱的细菌活性快速检测新方法。 以水体常见大肠埃希氏菌(大肠杆菌)为研究对象, 采用紫外-可见分光光度计测量其在190~800 nm波段范围内的透射光谱, 并深入研究不同活菌比例下大肠杆菌透射光谱的特征及规律; 通过系统分析不同波长下大肠杆菌透射光谱随活性变化的相关性和灵敏性, 构建出双波长光密度比值与细菌活性之间关系模型, 基于该模型计算出细菌活性, 并对比分析了不同双波长比值法下细菌活性计算结果的准确性和稳定性。 结果表明: (1)由于不同活性的细菌体内所含生物分子的含量存在差异, 在 230~300 nm波段范围内, 活菌比例较高的细菌菌液具有更高的光密度; (2)通过分析230~300 nm波段范围内大肠杆菌透射光谱随活性变化的灵敏性和相关性, 发现大肠杆菌活性和光密度值之间相关系数范围值为0.959 2~0.993 3, 初步确定为细菌活性定量的最优波段; (3)选取230 nm作为测定波长, 670 nm作为参比波长, 构建了两波长光密度比值与细菌活性拟合曲线, 其相关系数达到0.946 2, 活细菌比例检测范围为0%~100%; (4)基于该拟合曲线对3份具有不同活性的大肠杆菌菌液活性进行测定, 与平板菌落计数法相比, 最大相对误差为3.70%, 平均相对误差为 1.43%, 准确性最优。 本方法仅需测量230和670 nm处的光密度, 检测时间在1秒钟以内, 就能完成对细菌活性的快速准确检测。 该研究成果为水体细菌微生物活性的快速检测与预警提供了新的技术思路, 具有潜在的应用价值。
Studying the microbial activity of bacteria in water and rapidly assessing the growth status and reproductive capacity of bacteria in water environments are of great significance for the scientific management of water resources and the guarantee of public health security. Although traditional bacterial activity detection techniques, such as the colony counting method, staining observation method and molecular biology methods, are effective, they have cumbersome operation procedures, consume a lot of time and workforce, and are difficult to meet the needs of real-time online detection. In response to the drawbacks of traditional bacterial activity detection techniques, a novel rapid detection method for bacterial activity based on multi-wavelength transmittance spectra is proposed. Taking the common Escherichia coli ( E. coli) in water as the research object, the transmittance spectra of E. coli within the wavelength range of 190~800 nm were measured using an ultraviolet-visible spectrophotometer. The characteristics and regularities of the transmittance spectra of E. coli under different proportions of viable bacteria were thoroughly studied. A relationship model between the ratio of double-wavelength optical density and bacterial activity was constructed through the systematic analysis of the correlation and sensitivity of the transmittance spectra of E. coli with changes in activity at different wavelengths. Based on this model, the bacterial activity was calculated, and the accuracy and stability of the calculation results of bacterial activity under different double-wavelength ratio methods were compared and analyzed. The results show that: (1) Due to the differences in the contents of biomolecules in bacteria with different activities, within the wavelength range of 230~300 nm, the bacterial solutions containing higher proportions of viable bacteria have higher optical densities. (2) By analyzing the sensitivity and correlation of the transmittance spectra of E. coli in the wavelength range of 230~300 nm with the activity changes, it was found that the correlation coefficient ranges between the activity of E. coli and the optical densities is 0.959 2~0.993 3, which preliminarily determines the optimal wavelength band for quantitative determination of bacterial activity. (3) Selecting 230 nm as the measurement wavelength and 670 nm as the reference wavelength, a fitting curve of the ratio of optical densities at the two wavelengths to bacterial activity was constructed. The correlation coefficient reached 0.946 2, and the detection range of the viable bacteria proportion was 0%~100%. (4) This fitting curve determined the activities of three E. coli bacterial solutions with different activities. Compared with the plate colony counting method, the maximum relative error was 3.70%, the average relative error was 1.43%, and the accuracy was optimal. This method only requires the optical densities at 230 and 670 nm, and the detection time is within 1 second, which can complete the rapid and accurate detection of bacterial activity. This research achievement provides a new technical idea for the rapid detection and early warning of bacterial activity in water and has potential application value.
细菌微生物作为水体中的主要污染物, 其浓度超标严重威胁人类健康和水安全[1, 2, 3]。 细菌活性, 是衡量微生物生命特征的一个重要指标。 细菌浓度、 总量与细菌活性存在显著关联, 这主要是由于具有活性的细菌更易于生存和繁殖, 进而对水环境和人类健康造成重大影响[4, 5]。
目前, 检测细菌活性的方法主要有菌落计数法、 染色计数法、 分子生物学法和三磷酸腺苷(adenosine tri-phosphate, ATP)含量测定法等, 其中: 菌落计数法是细菌活性常用测量方法[6, 7], 该方法适用于成本低、 易培养且的微生物检测, 但操作繁琐、 耗时较长(24~48 h, 甚至更久), 不利于实时在线检测; 染色计数法包括化学染色法和荧光染色法, 利用活细胞和死细胞对染色试剂的不同作用效果, 实现细菌活性检测[8, 9, 10], 这些方法操作简单, 但需使用试剂对细胞进行染色, 且要借助光学显微镜、 荧光显微镜或流式细胞仪等设备对染色细胞进行分析; 分子生物学法无需对细菌进行培养, 就能检测低浓度细菌, 结果也较为准确, 然而该方法需要用到如聚合酶链反应系统和电泳系统等昂贵专业仪器[11]。 内源性三磷酸腺苷生物发光法是通过测定细菌中的ATP浓度来反映细胞的活性程度, 此方法无需培养, 操作简便, 不过也需要昂贵实验仪器[12, 13, 14]。 与之相比, 多波长透射光谱技术具有测量速度快、 无需染色、 非接触以及所需仪器设备相对简单等优点, 已广泛应用于细菌的分类、 鉴定和浓度定量等方面[15, 16, 17]。 然而, 由于细菌体内生物分子较少, 且成分相对简单, 致使其透射光谱信号较弱, 特征峰的数量少, 所以该技术在细菌活性检测方面的应用较少。 细菌活性, 是防控细菌污染的关键指标, 也是评估消毒处理是否达标的唯一指标。 快速、 准确地获取细菌活性信息, 对于水质监测、 公共卫生安全保障以及微生物学研究等科学领域至关重要。
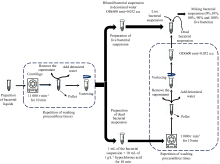
细菌活性的变化通常伴随着细胞膜完整性和细胞增殖能力等生命特征的改变, 而这些改变在分子层面体现为细胞核酸、 蛋白质和脂类等物质的变化[18, 19]。 多波长透射光谱技术基于细菌对光的吸收或散射特性, 能够反映细菌浓度、 大小和细胞内生物分子含量等信息[20]。 因此, 针对不同活性细菌体内生物大分子(核酸、 蛋白质等)含量、 结构等方面的变化, 利用透射光谱技术进行检测, 通过谱图呈现这种分子层面的变化, 进而推测出细菌的活性状态, 实现对细菌活性的快速测量。 本文提出一种基于多波长透射光谱快速获取细菌活性的检测方法。 首先, 制备浓度相等的活菌和死菌菌液, 并按照不同体积比配制具有不同活性的大肠杆菌菌液, 随后, 测量不同活性的大肠杆菌的多波长透射光谱, 分析细菌活性和光密度值之间的相关性, 构建双波长光密度比值与细菌活性之间关系模型, 最后, 利用所构建的模型计算细菌活性, 并对测量结果的准确性和稳定性进行分析。
大肠埃希氏菌(Escherichia coli, CMCC(B)44102)由中国医学细菌保藏管理中心提供, 经“ 菌种活化→ 接种到牛肉膏蛋白胨培养基培养→ 液体培养基扩菌培养(18 h)→ 离心机离心→ 去离子水清洗(3遍)” 的流程制成活菌悬浮液。
细菌灭活实验: 将1 mL活菌菌液和10 mL有效氯含量为1 g· L-1的次氯酸溶液混合, 置于室温条件下作用10 min, 杀死细菌活性。 将已杀死细菌活性悬浮液加入离心管, 离心11 000 r· min-1, 10 min, 吸取上清液, 加灭菌的去离子水, 以此方法清洗三次, 最后一次加灭菌的去离子水, 充分摇匀即可制成去除消毒剂影响的死菌悬浮液。
多波长透射光谱采用紫外-可见分光光度计(型号: UV2700i, 日本岛津)进行获取, 光谱测量范围设定为190~800 nm, 采样间隔为1 nm, 狭缝宽度为2.0 nm。 测量过程中, 以去离子水作为参比, 重复3次测量取平均值作为测量结果。 此外, 文中所采用的透射光谱均经过仪器基线校准。 数据处理使用Matlab2020a软件(Version 9.8, MathWorks Inc., USA), 自行编写有关Matlab程序。
根据Mie散射理论, 多波长透射光谱的光密度值表达式为[24]
式(2)中, 细菌消光系数Qext=Qabs+Qsca, Qabs和Qsca分别为细菌吸收系数和散射系数; Np为细菌浓度, D为细菌直径, l为光程。 由式(2)可知, 透射光谱的光密度值, 不仅与细菌微生物的吸收和散射能力有关, 也与细菌尺寸、 浓度和光程相关。 为消除细菌大小、 浓度和光程对光谱的影响, 需对测量光谱进行归一化处理。 根据课题组前期的研究, 在400~800 nm范围内, 水体细菌微生物光谱变化呈现稳定性[20], 因此, 选取该波段范围内光谱测量平均值作为细菌全波段光谱数据归一化的参照, 平均归一化后的光谱可表示为
式(3)中, τ (λ )'为归一化后的值; τ (λ )为细菌原测量谱中各波长点下光密度值, τ 为参照值。 将式(2)代入式(3), 可得到
因测量同一细菌悬浮液, 式(3)中的细菌浓度、 大小和光程相同, 分子和分母相除, 消除了Np、 D和l, 即归一化后的光谱表征的是水体中单个细菌微生物光谱随波长的变化曲线。 在测量过程中, 菌液浓度难以精确控制, 为制备出同一浓度但活性不同的细菌菌液, 需配制出等浓度的全活细菌菌液和全死细菌菌液。
其具体步骤是: 根据式(3), 分别对大肠杆菌全活菌液和全死菌液进行归一化处理, 其结果如图1所示。 研究发现, 在600 nm波长处, OD(600)'100% live≈ OD(600)'0% live, 即大肠杆菌全活细胞菌液和全死细胞菌液归一化后光密度近似相等。 因此, 选取600 nm波长光密度值作为标定值, 测量出全活菌液光密度为0.678 a.u, 全死细胞菌液光密度为0.032 a.u。 因0.678/0.032=21.18, 为配制出与全死细菌菌液浓度相等的活菌菌液, 需将全活菌液稀释 21.18倍。 随后, 将稀释后的活菌菌液与死菌菌液按照0∶ 10、 1∶ 9、 2∶ 8、 3∶ 7、 4∶ 6、 5∶ 5、 6∶ 4、 7∶ 3、 8∶ 2、 9∶ 1、 10∶ 0的体积比, 配制成11个活性不同的大肠杆菌菌液, 具体制备过程如图2所示。
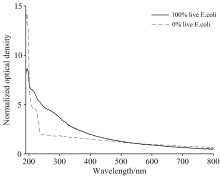 | 图1 大肠杆菌全为活细胞菌液和全为死细胞菌液归一化后光谱Fig.1 Spectra of normalized optical density of 100% live cells and 0% live cells solution for E. coli |
为了表明多波长透射光谱可应用于细菌活性检测, 对细菌活细胞比例从0%递增至100%过程中的透射光谱进行测量。 图3(a)是活性分别为0%、 20%、 40%、 60%、 80%和100%的大肠杆菌在190~800 nm波长范围内的透射光谱; 图3(b)是活性分别为10%、 30%、 50%、 70%和90%的大肠杆菌在190~800 nm波长范围内的透射光谱。 在190~210 nm范围内, 不同活性的大肠杆菌透射光谱存在交叉点, 为更清晰地展现该波段不同活性光谱特征, 将其放大, 结果如图3(a)和图3(b)右上角插图所示。 可以观察到, 在190~199 nm范围内, 随着细菌活细胞比例增大, 光谱的光密度值减小, 且在193 nm附件存在一个强吸收峰, 这主要是由于细菌内肽键对光具有吸收作用。 在199~230 nm波长范围内, 光谱特征较为丰富, 存在光谱吸收谷、 吸收峰以及光谱变化急剧部分, 并且不同活性光谱的吸收峰波长发生位移, 在199、 200、 201和202 nm波长处, 不同活性透射光谱存在交点, 如表1所示。 随着活性增强, 吸收峰朝着短波方向移动, 且当活性等于或大于50%时, 细菌光谱的吸收谷和吸收峰消失了, 其原因是细菌活性变化, 导致细菌内一些生物分子构象和含量发生改变, 进而使吸收峰、 谱带半宽度改变, 谱型发生畸变。 因此, 该波段的光谱信号与大肠杆菌活性之间的对应关系出现失真, 不适合用于测量大肠杆菌的活性。 在230~300 nm波段范围, 每条透射光谱变化较平缓, 无吸收峰, 随着活性增强, 其光密度值增大, 表明光谱信号与活性具有较好的相关性。 在300~800 nm, 不同活性的细菌透射光谱出现混叠现象, 表明光密度值与细菌活性失去线性相关性。
| 表1 199~230 nm不同活性大肠杆菌透射光谱吸收谷、 吸收峰和等吸光点的波长 Table 1 The wavelengths of absorption trough, absorption peak and iso-absorptive point for E.coli transmittance spectra in different viabilities (199~230 nm) |
为了对细菌活性进行准确定量, 需分析细菌在230~300 nm 波长范围内, 光密度随活性变化的灵敏度和相关性。 假定各波长点的光密度与细菌活性呈比例关系, 运用最小二乘拟合算法, 选取活性为0%、 10%、 20%、 30%、 40%、 50%、 60%、 70%、 80%、 90% 和100%的细菌透射光谱, 在同一波长下, 通过对11个数据点进行线性拟合, 得到了光密度与活性之间线性关系函数
式(5)中, 参数m为曲线斜率, 其表征的是单个波长点的光谱线随细菌活性变化的灵敏度。
除了要明确各个波长点光谱线随细菌活性变化的灵敏性外, 还需知晓光密度值与细菌活性之间的相关系数, 其表达式为
式(6)中, Cov(Viability, OD)为细菌活性与光密度值的协方差, Var(Viability)为细菌活性的方差, Var(OD)为细菌光密度的方差。 依据式(5)和式(6)计算得出大肠杆菌菌液在230~300 nm波段范围内的斜率谱m以及相关系数谱R2。 如图4(a)和图4(b)所示。
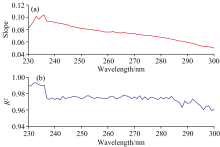 | 图4 大肠杆菌在230~300 nm波段范围内的斜率谱和相关系数谱Fig.4 Spectra of the slope m and the coefficient of determination R2 in the region of 230~300 nm in E.coli |
可知, 在230~300 nm波段范围内, 相关系数范围值为0.959 2~0.993 3, 表明在该波段光密度值与细菌活性呈现出良好的线性关系, 同时该波段光谱对活性的灵敏性适中, 适用于细菌活性的反演。
不同细菌的活性状态会影响细菌内部蛋白质、 核酸的构象和含量。 文献[20]研究表明, 细菌内蛋白质和核酸在230~300 nm波长范围内具有较强的吸收能力。 当细菌活性产生变化时, 该波段的光谱也会随之出现差异, 因此, 可根据细菌活性变化过程中230~300 nm的光谱差异, 构建细菌活性的预测模型。
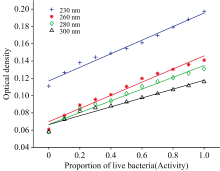
理论上, 仅需知晓单个波长点的光密度值, 即可实现对细菌活性的测量。 以活细菌的比例(proportion of live bacteria)为横坐标, 光密度(optical density)为纵坐标, 构建最优波段范围中4个波长处(230、 260、 280和300 nm)的光密度与细菌活性的拟合函数, 如图5和表2所示。 由此可知, 在这四个波长处, 光密度与细菌活性呈现出较好的线性关系, 经过线性拟合后, 各个波长下的拟合直线的相关系数R2超过0.95。 此外, 随着波长增大, 灵敏度逐渐降低, 线性关系逐渐变弱。 其中, 230 nm处的拟合线性相关系数最大, 达到0.984 9, 拟合效果最佳。
| 表2 大肠杆菌在230、 260、 280和300 nm处细胞活性x与光密度值y的线性关系及评价指标 Table 2 Linear correlation and evaluation indices between bacteria viability (x) and optical density (y) at 230, 260, 280 and 300 nm for Escherichia coli |
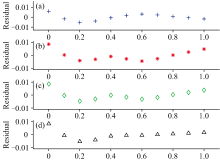
为验证拟合曲线的合理性, 图6给出了4个波长点处测量的光密度与拟合模型计算所得光密度的残差随细菌活性变化的散点图。 可以看出, 随着细菌活细胞比例的增大, 残差值在0值附近上下波动, 这表明随着活菌比例的变化, 拟合得到的模型具有稳定性。 此外, 计算四个波长点拟合曲线的残差标准差(residual standard error, RSE), 结果显示, 在230 nm处的RSE值(0.003 4)最小(见表2), 表明该波长点建立的拟合函数对细菌活性预测精度最高, 可将其选为细菌活性测定的最佳波长点。
考虑到单个波长点光密度测量值, 不仅与细菌活性相关, 还受到细菌浓度、 光程等因素的影响, 在此, 尝试采用平均归一化方法, 消除细菌浓度等其他因素的干扰, 建立了归一化后四个波长点的光密度与细菌活性的线性关系, 如表3所示。 显然, 引入归一化方法后, 光密度值与细菌活性线性相关性受到影响, 以230 nm波长点为例, 其相关系数降至0.726 3。 由此可见, 采用归一化法, 一方面会降低细菌活性预测的准确性, 另一方面, 由于需要测量多个波长点的光密度, 在实际应用中对仪器性能提出了更高要求。
| 表3 大肠杆菌平均归一化后在230、 260、 280和300 nm处细胞活性x与光密度值y的线性关系及评价指标 Table 3 Linear correlation and evaluation indices between bacteria viability (x) and optical density (y) at 230, 260, 280 and 300 nm with average normalization methodfor Escherichia coli |
为了实现实时消除细菌浓度、 光程等因素对光谱的干扰, 且避免归一化处理, 构建了两个波长光密度的比值与细菌活性的关系函数。 测定波长选定为230 nm, 参比波长的选择基于两点考虑: 其一, 该波长下光密度值与细菌活性无关, 其二, 待测细菌活性在测定波长和参比波长的光密度比值应尽可能大[25, 26]。 由图1可知, 等浓度全活细胞菌液和全死细胞菌液光密度相等的波段为550~670 nm, 在此波段选取550、 570、 600、 650和670 nm这几个波长点作为参比波长, 计算出大肠杆菌细胞活性(x)与光密度比值(y)的线性关系, 结果如表4所示。
| 表4 大肠杆菌细胞活性与光密度比值的线性回归模型 Table 4 Linear regression model between bacteria viability and optical density ratio for Escherichia coli |
由此可知, 当以230 nm作为测定波长, 670 nm作为参比波长时, 两波长点光密度比值与细菌活性的线性关系拟合优度最佳, R2值达到了0.946 2。 依据该方法, 大肠杆菌的活性可表示为
制备三份具有不同活性的大肠杆菌菌液, 采用平板菌落计数法测定这三份菌液的活性。 除此之外, 对三份菌液各自对应的多波长透射光谱进行测量, 并采用五种双波长(测定波长固定为230 nm, 参比波长改变)比值法, 计算细菌活性, 结果如表5所示。 可以看出, 对于不同活性的大肠杆菌菌液, 采用不同双波长比值法, 计算得到大肠杆菌活性。 与平板菌落计数法相比, OD230 nm/OD550 nm、 OD230 nm/OD570 nm和OD230 nm/OD600 nm这三种光密度比值法计算活性的误差较大, 最大相对误差分别为16.74%、 17.05%和15.45%, 平均相对误差分别为9.40%、 9.28%和10.51%; OD230 nm/OD650 nm和OD230 nm/OD670 nm这两种光密度比值法在计算活性时的误差相近。 其中, OD230 nm/OD670 nm光密度比值法的平均相对误差最小。
| 表5 五种双波长比值法(测定波长相同、 参比波长改变)与平板菌落计数法所获得的大肠杆菌活性对比 Table 5 Comparison of E. coli viability between five methods of dual-wavelength ratios (same measuring wavelength, changed reference wavelength) and serial plate counting method |
表6是在参比波长固定为670 nm, 改变测定波长, 采用四种双波长光密度比值法计算得到细菌活性。 与平板菌落计数结果相比, 当参比波长为670 nm, 改变测定波长时, 平均相对误差大小关系为: OD230 nm/OD670 nm< OD260 nm/OD670 nm< OD280 nm/OD670 nm< OD300 nm/OD670 nm, 最大相对误差: OD230 nm/OD670 nm< OD300 nm/OD670 nm< OD280 nm/OD670 nm< OD260 nm/OD670 nm。 结果表明, 采用双波长(230 nm为测定波长, 670 nm为参比波长)光密度比值法对大肠杆菌菌液中的细胞活性进行测定, 能够取得较好的预测效果。
| 表6 四种双波长比值法(参比波长相同、 测定波长改变)与平板菌落计数法所获得的大肠杆菌活性对比 Table 6 Comparison of E. coli viability between four methods of dual-wavelength ratios (samereference wavelength, changed measuring wavelength) and serial plate counting method |
为验证所构建模型对大肠杆菌活性测量的准确度与精密度, 对同一大肠杆菌菌液的多波长透射光谱进行3次重复测量。 根据已构建双波长(230 nm为测定波长, 670 nm为参比波长)光密度比值与大肠杆菌活性之间函数关系, 计算出大肠杆菌活性, 其结果如表7所示。
| 表7 双波长比值法(OD230 nm/OD670 nm)与平板菌落计数法所获得的大肠杆菌活性对比 Table 7 Comparison of E. coli viability between dual-wavelength ratio method (OD230 nm/OD670 nm) and serial plate counting method |
由此可知, 通过三条光谱计算得出的大肠杆菌活性均值为0.785 8, 与平板菌落计数法所得结果相比较, 平均相对误差为0.10%, 三条光谱计算出的活性相对标准偏差为3.77% 。 这表明该双波长比值法测定大肠杆菌活性, 其结果准确且精密。
提出了一种基于多波长透射光谱的水体大肠杆菌活性快速检测方法。 在230~300 nm波长范围内, 活菌比例较高的大肠杆菌菌液呈现出更高的光密度值, 这主要是因为不同活性的细菌体内生物分子(如DNA、 蛋白质)的含量存在差异; 本研究构建了光密度比值(OD230 nm/OD670 nm)与细菌活性之间线性模型, 其相关系数达到0.946 2, 通过该模型对3份具有不同活性的大肠杆菌菌液的活性进行预测, 将预测结果与平板菌落计数结果对比, 最大相对误差为3.70%, 平均相对误差为1.43%, 两者均小于4%。 结果表明: 采用分光光度计, 仅测量230和670 nm处的光密度, 便能快速、 准确地完成大肠杆菌活性的测量。 该方法简便快捷、 在校正模型建立后, 整个测量时间可控制在1 s以内, 极大地节省了检测时间。 此外, 检测过程无需染色试剂辅助, 成本低廉且无污染, 有效减少了人为操作引入的误差。
该方法有望成为一种快速、 简便且有效的细菌活性检测手段, 但由于不同细菌的光密度与细胞活性之间的定量关系存在差异, 本研究所建立的模型无法直接应用于其他细菌的活性测量。 因此, 后续将开展大量实验, 尝试将该方法应用于对其他细菌的活性的快速检测, 以此提升该方法的可复制性和推广性。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|