作者简介: 李舒琦,女, 1998年生,深圳大学物理与光电工程学院硕士研究生 e-mail: 2200453050@email.szu.edu.cn
活体成像技术具有革命性意义, 能够在生物体内实现实时观测, 提供与生命过程密切相关的动态信息, 对于揭示疾病发生发展机制和评估治疗效果等具有重要作用。 相干拉曼散射(CRS)显微成像技术无需引入可能干扰生物分子正常功能的荧光标记物, 可直接对生物样品中特定分子进行特异性成像, 在活体成像领域展现出显著优势。 然而, 在实际应用于活体成像时, CRS显微技术仍面临光损伤、 成像深度受限和运动伪影等挑战。 近年来, 随着相关技术的飞速发展, CRS显微成像在克服光损伤难题、 突破成像深度限制、 消除或减少运动伪影以及实现多模态融合成像等方面取得了诸多突破, 并成功应用于人体皮肤以及实验动物模型的大脑、 脊柱等部位和体内肿瘤的实时成像监测, 有力推动了该技术在活体成像研究和临床应用中的发展。 本文全面综述了CRS显微技术在活体成像中的最新研究进展, 深入剖析其面临的挑战和相应解决方案, 旨在为该技术的持续发展和广泛应用提供参考。 克服光损伤的常用方法是通过限制激光功率和积分时间来减少激光在样品中引起的热效应和化学反应; 突破成像深度限制的方案包括对皮肤或皮肤附近部位进行成像、 结合光学窗口或直接对微创手术暴露的深层组织或器官进行成像、 采用AO技术兼顾深度和无创成像以及采用内窥成像技术等; 消除或减少运动伪影首先需要以适当的麻醉和固定方式保持生物体静止或减少运动, 其次可应用光学窗口和实时运动矫正算法进一步隔绝麻醉样品因呼吸和心跳等生理活动引起的抖动影响, 还可以通过设法提高成像速度来减少运动伪影; 此外, 结合双光子激发荧光和二次谐波产生等多种非线性光学显微成像实现CRS多模态融合成像, 能获取更丰富的信息, 增强对活体生物样品的分析能力, 助力对生物学信息的深入理解。
In vivo imaging technology has revolutionary significance, enabling real-time observation of living organisms and providing dynamic information directly related to biological processes. This is crucial for understanding disease mechanisms and evaluating treatment effects. Coherent Raman scattering (CRS) microscopy offers the advantage of specific molecular imaging in biological samples without the need for fluorescent probes that might interfere with biomolecular function, making it a promising tool in the field of in vivo imaging. However, CRS microscopy still faces challenges in practical applications in in vivo imaging, including photodamage, limited imaging depth, and motion artifacts. Recent advancements in related technology have led to significant breakthroughs, addressing these challenges by minimizing photodamage, extending imaging depth, eliminating or reducing motion artifacts, and enabling multimodal imaging. In vivo real-time imaging of human skin, brain, and spine in experimental animal models and tumors has driven substantial progress in CRS microscopy, both in in vivo imaging research and clinical applications. This paper offers a comprehensive review of the latest developments in CRS microscopy for in vivo imaging, providing an in-depth analysis of current challenges and their solutions to contribute to this technology's ongoing development and broader application. Common strategies to overcome photodamage involve reducing the thermal effects and chemical reactions induced by the laser in the sample, typically by limiting laser power and integration time. Several approaches have been explored to address the limitation of imaging depth, including imaging superficial tissues such as the skin or areas near the surface, combining optical windows, or directly imaging deeper tissues or organs exposed through minimally invasive surgery. Adaptive optics technology helps balance depth with non-invasive imaging, while endoscopic imaging provides an additional solution. To minimize or eliminate motion artifacts, it is crucial first to keep the organism stationary or reduce movement through appropriate anesthesia and fixation techniques. In addition, optical windows and real-time motion correction algorithms can be employed to mitigate further jitter caused by physiological activities like breathing and heartbeat in anesthetized samples. Increasing imaging speed is another way to reduce motion artifacts. Finally, combining CRS with other nonlinear optical microscopy techniques, such as two-photon excitation fluorescence and second-harmonic generation, enables multimodal imaging, providing richer information, enhancing the analysis of in vivo biological samples, and offering deeper insights into biological processes.
光学显微成像技术是深入理解生命过程的关键手段。 与广泛应用的荧光显微成像相比, 相干拉曼散射(coherent Raman scattering, CRS)显微成像的发明及其生物医学应用滞后许多[1]。 但随着活体(in vivo)成像需求日益增长, CRS显微成像因无标记特性而备受关注。
拉曼散射是光子与介质分子发生非弹性碰撞的过程, 期间入射光子与分子振动能级交换能量, 使散射光子频率发生变化。 通过测量不同频率差对应的散射光信号强度, 可获得与分子能级结构对应的拉曼光谱, 常用于分子结构分析和材料表征[2]。 而记录样品中不同空间位置的分子在同一频率差处的拉曼散射信号, 还可形成图像衬度, 实现无外源标记的特异性成像。 但这种自发拉曼散射信号通常极微弱, 采集时间长, 显微成像实用性不强。 CRS借助相干光场和共振效应, 将拉曼信号强度提升7个数量级[3], 大幅缩短信号采集时间, 使拉曼散射用于分子特异性显微成像成为可能[4, 5]。 当前, 常用的CRS成像有受激拉曼散射(stimulated Raman scattering, SRS)显微和相干反斯托克斯拉曼散射(coherent anti-Stokes Raman scattering, CARS)显微。
CRS显微为生物医学成像提供全新的解决方案, 被应用于脂类分子[6, 7]、 蛋白质[8, 9]、 代谢产物[10, 11]等生命体关键组成物质的显微观察。 相较于荧光显微成像, CRS无需引入可能干扰生物分子正常功能的荧光标记物, 因而也不存在光漂白和光毒性问题, 在活体成像中具备天然优势。 近年来, 随着相关技术的飞速发展, CRS显微成像在克服光损伤[12, 13, 14, 15, 16]、 突破成像深度[16, 17, 18, 19, 20, 21, 22, 23, 24, 25]、 减少运动伪影[20, 21, 26, 27, 28]和多模态融合成像[13, 19, 20, 29, 30, 31]等方面取得诸多突破, 已实现对人体皮肤[15, 28, 32, 33, 34, 35]、 实验动物大脑[17, 18, 19]和脊柱[23, 24]等部位及体内肿瘤的实时成像监测, 有力推动其在活体成像研究和临床应用的发展。 本文全面综述CRS显微及其活体成像最新研究进展, 深入探讨面临的挑战和解决方案, 以期为该技术的发展和应用提供参考。
发生拉曼散射时, 多数情况下散射光子能量低于入射光子, 此时散射光称为斯托克斯光; 反之称为反斯托克斯光。 能量改变量对应分子的某个振动能级, 相应频率差称为拉曼频移(Ω )。 CRS显微技术利用相干光场和共振效应, 增强样品中特定分子振动模式的拉曼散射信号, 进而实现高对比度分子特异性成像, 能非侵入性地获取样品的化学组分和结构信息。 CARS和SRS的增强原理有所不同, 因而其显微成像装置也存在差异, 且各有优缺点。
CARS基于四波混频非线性光学过程, 需要至少两束激光同时照射样品, 一束作为泵浦光和探测光(频率为ω p), 另一束作为斯托克斯光(频率为ω s)。 当两者频率差与样品分子的拉曼频移共振(即Ω =ω p-ω s)时, 会产生频率为ω as=2ω p-ω s的反斯托克斯光, 其强度与样品的三阶极化率有关。 在满足相位匹配条件时, 相干光场与分子振动的强烈耦合使信号强度大幅增强。 由于产生的反斯托克斯光与入射激光波长不同, 选择合适滤光片就能方便地探测该信号, 从而实现对样品中特定分子的CARS显微成像。 需要注意的是, 检测到的信号中不可避免地存在非共振背景(non-resonant background, NRB)干扰, 原因是CARS过程除了存在与分子振动模式相关的共振极化响应, 还存在非共振极化响应。 NRB的存在不仅会降低特征拉曼峰的对比度, 还可能使峰值位置发生偏移。 故在获取CARS信号时, 通常需考虑如何有效去除NRB的影响。
SRS则基于受激过程, 即当泵浦光强度超过一定阈值时, 斯托克斯光(或反斯托克斯光)会得到受激放大。 此过程可看作泵浦光失去一个光子的同时斯托克斯光产生一个光子, 故通过检测泵浦光能量损失(也称受激拉曼损耗)或斯托克斯光能量增量(也称受激拉曼增益), 即可实现对样品中特定分子的SRS显微成像。 由于SRS只在严格满足共振条件(Ω =ω p-ω s)时才发生, 因此不产生类似CARS中的NRB。 且与CARS过程不同, SRS自动满足相位匹配条件, 因此与自发拉曼相比, 其信号也得到极大提高。 但尽管如此, 需要探测的强度变化与入射激光强度相比依然很小(Δ I/I~10-4), 远小于典型的激光强度波动, 故需结合调制解调技术进行探测。
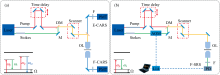
CARS和SRS过程的能级图及典型显微成像装置如图1所示。 两种系统的照明部分可采用相同结构, 均有两束脉冲激光分别作为泵浦光和斯托克斯光, 且频率差可调, 以匹配样品中不同分子振动模式的拉曼频移。 目前常见的CARS和SRS显微成像系统多采用光谱聚焦法[36], 将飞秒脉冲光色散啁啾成皮秒脉冲光来照射样品, 以提高光谱分辨率, 同时便于实现高光谱成像。 两束光除了在空间上要严格共线, 还需要在其中一束引入时间延迟装置, 以精确调整两脉冲的时间延迟量, 匹配分子振动频率并进行光谱扫描。 合束光经扫描装置和显微物镜聚焦于样品。 两种系统的探测部分则完全不同: 在CARS显微系统中, 产生的反斯托克斯光由物镜收集并经合适滤光片后, 由光电倍增管或雪崩二极管直接进行探测。 其中, 往前传播的信号光由位于样品另一侧的物镜收集, 称为前向CARS(forward CARS, F-CARS); 往后传播的信号光收集可与照明光路共用同一物镜, 称为后向CARS(epidetected CARS, E-CARS)。 相比之下, F-CARS信号更强, 但受NRB影响也更大; 而E-CARS由于照明和探测在同一侧, 在活体成像中更具优势。 在SRS显微系统中, 为检测微弱的能量变化, 入射的泵浦光或斯托克斯光需先经声光调制器或电光调制器进行频率调制, 而后对探测信号使用锁相放大器, 利用相敏检测技术从嘈杂的背景中提取出特定频率的信号。 由于SRS显微关注的是光强的微弱变化, 因此一般采用感光面积更大的光电二极管作为探测器, 且多采用前向探测方式(即F-SRS), 这在活体成像中存在一定限制。
生物样品中存在大量脂质、 蛋白质、 核酸等生物分子, 这些分子具有独特的拉曼振动模式, 源于分子内化学键的振动和转动。 例如, C— H键伸缩振动在2 800~3 000 cm-1拉曼频移范围, C=O键的伸缩振动在1 600~1 800 cm-1附近。 CRS显微成像可选择性检测样品中特定分子的拉曼振动模式, 实现对不同生物分子的无标记特异性成像。 这一特性避免了标记过程可能给生物样品带来的损伤或改变, 同时也规避了传统荧光显微成像中常见的光漂白和光毒性问题, 故在活体成像领域优势显著。 此外, CRS显微系统采用脉冲激光照明和点扫描成像方式, 易于与其他非线性光学成像方式— — 如双光子激发荧光(two-photon excitation fluorescence, TPEF)显微、 二次谐波产生(second harmonic generation, SHG)显微等— — 结合, 从而能从多个维度获取生物样品信息。
然而, 将CRS显微应用于活体成像仍面临诸多挑战。 首先, 鉴于非线性光学过程的阈值要求, 一般需较高激光功率才能有效激发CRS信号。 因此, 在将CRS显微应用于活体成像时, 首要克服的便是生物样品的光损伤问题。 其次, 活体生物样品存在严重的光吸收和光散射效应, 且生物组织的不均匀性和折射率变化还会引起光学像差, 这些因素限制了CRS显微的成像深度。 此外, 在活体成像过程中, 生物体的运动和呼吸、 心跳等生理活动导致的伪影问题不容忽视。 以下将详细阐述近几年来CRS显微技术克服上述问题所取得的研究进展。
光损伤是指成像过程激光束对样品产生的热效应和化学反应所导致的组织损伤。 这种损伤可能使细胞死亡、 蛋白质变性、 发生氧化反应或引发其他不可逆的生物化学反应, 进而影响结果准确性, 因而在活体成像中必须首要关注。 在显微成像领域, 避免光损伤的方法通常包括降低激光功率、 缩短成像时间、 采用红外波段激光等, 以减少激光对样品的热效应和化学反应。 CRS成像通常采用的近红外光或远红外光在大多数组织中吸收率很低, 能尽可能避免光损伤问题, 因此克服光损伤主要从控制激光功率和成像时间上下功夫。
Hellerer等[12]在对线虫进行活体CARS成像时指出, 由于CARS需要同时照射两束激光, 可能会对活体线虫造成一定损伤或干扰, 需采用低平均激光功率(7.5~38 mW)和短积分时间(20 s)来减少这种影响。 Kö nig等[13]在利用CARS对人体皮肤进行直接成像时, 则提出为避免任何组织损伤, 成像过程中物镜后激光功率要严格保持在50 mW以下。 Lee[14]、 Jung[15]、 Zhu[16]等在分别对小鼠皮下肿瘤、 耳朵皮脂腺、 小肠进行CARS活体成像时, 也都提到需要通过控制激光功率和缩短成像时间来避免光损伤, 但具体数值需要根据样品性质来决定。 表1给出了不同研究中用于CARS成像的典型实验参数, 包括激光功率、 数值孔径、 光斑直径等。 采用较高的数值孔径缩小了光斑尺寸, 提高了分辨率, 但同时也增加了局部光损伤的风险, 因此这些参数的选择通常还需要综合权衡利弊。
| 表1 不同研究中CARS成像的典型实验参数 Table 1 Typical experimental parameters of CARS imaging in different studies |
随着成像深度增加, 生物组织存在的光吸收、 光散射效应和光学像差会严重影响CRS显微成像质量。 此外, 由于需要两束波长不同的光共同照射样品, 这两束光在深层生物样品中会出现空间上的错位, 还会导致信号激发困难, 进一步影响成像效果。 这些因素使得CRS显微的成像深度受到限制。
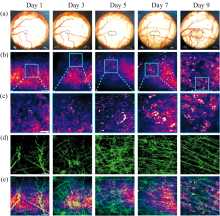
斑马鱼[29, 37]、 果蝇[38]、 线虫[12, 39, 40, 41, 42, 43, 44]等简单生物样品尺寸小, 成像深度限制一般可忽略。 但对于复杂的生物样品, 如小鼠和人体, 则成像深度制约问题必须考虑。 将CRS显微直接用于皮肤或皮肤附近部位可避免成像深度限制, 是最直接的活体成像应用方式。 如通过对皮肤中不同深度的脂质、 蛋白质进行成像, CARS显微能详细展示皮肤的表皮和部分真皮的结构和形态特征[44]。 CRS的无标记特性还能最大限度减少对样品的扰动, 使其适合观察活体的动态过程。 Evans等[28]在利用CARS显微对小鼠耳朵皮肤表层、 皮脂腺、 脂肪细胞、 血管网络等进行成像和光谱分析基础上, 跟踪了外部涂抹的矿物油在小鼠皮肤中的渗透过程。 类似地, Sarri等[32]利用CARS显微对人体皮肤中活性分子甘油的渗透进行成像和量化分析, 发现黄原胶作为甘油载体能在皮肤中持续释放甘油。 Liao等[33]开发了一种光纤传输的手持式便携SRS显微成像装置, 结合光谱分析, 可区分皮肤上是否涂抹化妆品。 Jung等[15]利用CARS显微对冷冻治疗前后小鼠耳内皮脂腺进行成像研究, 揭示了皮脂腺在全分泌过程中的动态变化, 以及对冷却引起的腺体损伤的反应。 Hajireza等[34]则利用SRS显微对小鼠耳朵中的血管进行成像, 观察血液中氧合血红蛋白和脱氧血红蛋白的吸收差异, 用于评估血液氧合水平。 此外, 皮肤中脂质分布和变化与某些皮肤疾病密切相关, 因此CRS显微还具备区分病变组织的能力。 Chen等[35]利用CARS显微对比了银屑病病变区域皮肤与健康皮肤的脂质图像, 发现两者的脂质分布存在显著差别。 他们定制了样品支架(图2), 可直接实现人体皮肤的CARS显微成像, 并对人体皮肤中油脂的扩散过程进行长达30 min的实时监测。
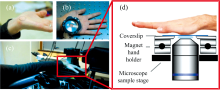 | 图2 手掌皮肤的CARS显微成像[35] (a): 手掌感兴趣区域; (b): 可磁吸固定于显微镜样品台的定制支架; (c): 手掌在显微镜上的摆放位置; (d): 定制支架设计图Fig.2 CARS microscopic imaging for palm skin[35] (a): Selected location on the palm; (b): Sample holder that can be attached to the microscope sample stage with a magnets; (c): Hand position on the microscope; (d): Detailed design of the sample holder |
然而, 要利用CRS显微对更深层的组织或器官(如实验动物大脑、 体内肿瘤等)进行成像研究, 上述装置和成像方案不再适用。 最直接的解决办法是对活体动物进行微创手术, 直接暴露要观察的部位, 再结合光学窗口来获得高质量的CRS显微图像。 光学窗口有不同类型, 如对小鼠大脑进行成像可采用颅窗(cranial window, CW), 而对小鼠皮下种植肿瘤进行成像可采用背脊皮翼视窗(dorsal skinfold window, DSW)(图3)。 这种方法对实验动物影响较小, 只要确保窗口部位不发生炎症或渗液, 还能长期观察。 Fu等[17]利用CW对小鼠大脑中皮层和皮下白质中的髓鞘纤维束进行CARS显微成像, 观察到皮下白质中的髓鞘纤维束比皮层中的纤维束排布更为均匀。 Galli等[18]利用CW对小鼠头部肿瘤进行CARS显微观察, 发现肿瘤组织内CARS信号的下降可作为肿瘤边界探测的可靠参考。 Luo等[19]利用CW对阿尔茨海莫症(Alzheimer's disease, AD)小鼠脑内血管和Aβ 斑块进行长期观察和定量分析。 Qu等[20]则利用DSW实现对小鼠皮下肿瘤生长过程中脂滴变化的长期CARS显微监测。 Lu等[21]在利用SRS显微对小鼠皮肤进行成像时也采用了DSW, 实现了对小鼠皮肤细胞分裂过程中DNA的成像。 此外, Wu等[22]开创性地利用微创椎间窗对小鼠脊髓进行长期的体内CARS显微成像。
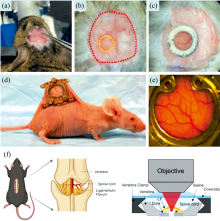 | 图3 光学窗口示意图 (a)— (c): 颅窗[19]; (d)— (e): 背脊皮翼视窗[21]; (f): 椎间窗[22]Fig.3 Schematic diagram of optical windows and DSW (a)— (c): Cranial window[19]; (d)— (e): Dorsal skinfold window[21]; (f): Intervertebral window[22] |
对于一些更深的组织和器官, 如脊髓、 肝脏、 小肠等, 也有研究人员选择微创手术打开皮肤后直接进行成像。 Shi等[23]对小鼠脊髓表面进行CARS显微成像时在脊柱钻一个小孔, 每次成像后在伤口处放置琼脂块用于保护, 也实现了对脊髓的多次、 长期成像。 Huff等[24]通过微创手术打开小鼠皮肤后, 直接利用CARS显微对坐骨神经中的髓鞘轴突进行成像。 Rodewald等[31]对小鼠进行手术, 暴露肝脏后对小鼠肝脏中维生素A进行CARS显微成像研究。 Zhu等[16]则对小鼠小肠组织进行手术暴露, 然后在CARS显微成像过程中使用温暖的培养基保持组织活性, 以实时观察膳食吸收过程中细胞质脂滴内三酰甘油的积累和消耗。 Fu等[25]通过手术暴露小鼠坐骨神经后, 对其髓鞘结构进行CARS显微成像, 从而发现髓鞘降解的机制和途径。
然而, 手术暴露毕竟是有创行为。 为更好地发挥CRS显微的无标记无创成像优势, 研究人员采用自适应光学(adaptive optics, AO)技术来突破成像深度的限制。 自适应光学通过实时检测和校正光波相位畸变有效补偿像差影响, 可大幅提高深层样品的成像质量。 Wright等[45]采用该机制, 校正CARS显微成像系统和肌肉组织样品引起的像差, 将700和260 μm深度处肌肉组织的CARS信号分别增强约3倍和6倍。 Fu等[17]采用类似方法, 借助CW实现对小鼠大脑内髓鞘轴突的CARS显微成像, 获得亚微米级的三维分辨率。 Lin等[46]则利用一种基于AO的SRS显微成像装置, 实时捕捉到了二甲基亚砜在人体汗孔中的动态扩散过程。
内窥技术也是提升成像深度的有效方法, 它通过细长光学管道将光源和成像设备引入体内, 可提供高分辨率图像并支持实时监测。 近年来已有诸多研究聚焦于实现CRS内窥显微成像, 但由于仍存在诸多难点待解决, 目前尚未有真正的活体成像应用报道。 以CARS内窥显微为例, 其主要难点在于四波混频背景和色差问题。 针对这些难点, 研究者们提出多种解决方案, 如Lukic等开发的新型光纤探头[47]和CARS内窥镜[48], Lombardini等[49]提出的共振扫描空心光纤设计, 以及Hirose等提出的梯度折射率透镜[50]等。
生物体的运动和呼吸、 心跳等生理活动会在活体成像过程中产生伪影, 导致图像模糊, 这在CRS显微成像中尤其不容忽视。 CRS显微成像通常采用高倍物镜, 成像视野相对较小, 且一般需较长积分时间以积累足够的信号光子, 因此与宽场成像相比, 相同幅度的运动伪影在CRS图像中会产生更显著的影响。
在活体成像中, 确保生物体静止或减少运动是基本需求, 通常通过麻醉和固定来实现。 对于小鼠等稍大型的活体样品, 一般采用腹腔注射氯胺酮与噻嗪混合物[22, 23, 51], 或吸入异氟醚气体[19], 以实现全身麻醉; 而对一些小型活体样品, 如斑马鱼、 果蝇和线虫等, 通常有特定的处理方法, 如斑马鱼可用三卡因甲磺酸进行麻醉, 而后固定于超低胶凝温度的琼脂糖中进行固定[29, 37]; 果蝇可采用乙醚烟雾麻醉, 并在成像过程中通过持续释放二氧化碳气体来保持其麻醉状态[38]; 对于线虫, 可将其置于铺有琼脂糖垫和叠氮化钠的载玻片上进行成像[12, 39, 40, 41, 42, 43, 44]。
但即便如此, 处于麻醉状态的活体样品仍有呼吸和心跳, 仍可能带来运动伪影。 采用光学窗口能有效减少这种影响[20, 21]。 如图3中的DSW能很好地固定成像部位, 最大程度隔绝呼吸和心脏收缩引起的抖动, 减少运动伪影影响, 显著提高活体CRS显微成像质量。 此外, 采用实时运动矫正算法也可有效减少呼吸和心跳造成的运动模糊。 通过在每一帧图像中选取感兴趣区域并计算与前一帧图像的互相关得到图像的相对偏移量, 用于对齐两帧图像, 可消除抖动影响。 Veilleux等[26]采用该算法消除CARS显微成像中的运动伪影, 成功获得小鼠眼睛虹膜血管的清晰图像。 Bé langer等[27]也在小鼠神经CARS成像过程中应用类似算法, 显著提高了成像质量和信噪比。
设法提高成像速度也是活体成像中减少运动伪影的一种有效策略。 Evans等[28]采用一种基于快速扫描头的CARS显微系统, 实现帧率达20 fps的宽视场(800 μm× 600 μm)高分辨率成像, 实时跟踪了矿物油在小鼠皮肤中的渗透过程。 Veilleux等[26]设计了一种快速激光扫描机制和时序电路, 利用旋转多边形镜和扫描振镜实现单向栅格扫描, 将小视场(4.11 μm× 16.46 μm)的扫描帧率进一步提高到120 fps, 从而实现对血管中快速流动细胞的清晰CARS成像。
值得一提的是, 上述方法通常不是单独使用的, 这些方法的结合有望提高CRS显微在活体成像中的应用效果, 为动态生物过程的研究提供有力支撑。
如前所述, CARS和SRS显微一般采用两束脉冲激光照明样品, 并采用点扫描方式成像, 这使得它们可以较方便地与TPEF和SHG显微等同样需要脉冲光和点扫描的非线性光学成像技术共用一套系统, 实现多模态融合成像。 每种非线性成像技术对特定分子或结构具有独特敏感性, 如CARS和SRS可实现对样品中特定分子的特异性成像, 还能获取样品的拉曼光谱信息以区分不同物质; TPEF可对生物组织中的自体荧光物质或外源荧光标记物进行成像; 而SHG则对生物组织中的胶原纤维等具有非中心对称的结构尤为敏感。 因此, 多模态融合成像能更全面观察复杂生物组织, 既能拓展光学显微成像在生命科学研究中的应用潜力, 又能提供更丰富的生物学信息, 助力更深入的理解。
将TPEF、 SHG与CRS整合到同一显微成像系统面临的最大挑战, 是这些成像方式对脉冲光要求的差异— — TPEF和SHG通常需要超短飞秒脉冲激光以确保高激发效率, 而CRS显微, 尤其是高光谱CARS或SRS显微则需要窄带的皮秒脉冲激光以提高光谱分辨率。 为实现多模态融合成像, Veilleux等[52]采用皮秒脉冲激光与飞秒激光组合的方案, 对小鼠的皮肤、 头骨骨髓和视网膜进行CARS、 TPEF、 SHG显微成像, 分别呈现出血管结构、 血管中的白细胞和胶原蛋白组织。 Wu等[53]则利用飞秒脉冲激光和皮秒脉冲激光组合的方案, 实现了小鼠脊髓的SRS和TPEF双模态显微成像, 同时监测了脊髓疾病发展过程中髓鞘和轴突的动态变化。 然而, 这种多激光器的配置方式增加了系统的复杂度和成本, 使推广应用受到限制。
Hellerer等[36]提出的光谱聚焦法可采用宽带飞秒脉冲激光作为光源, 通过在光路中引入色散介质将飞秒脉冲展宽为皮秒脉冲, 不仅可以在非线性光谱和显微成像中实现高光谱分辨率, 还能有效解决其与TPEF和SHG的光源兼容性问题。 Andreana等[29]利用该方法, 成功采用飞秒脉冲激光实现TPEF、 SHG和CARS多模态显微成像, 且其中CARS显微的光谱分辨率达35 cm-1, 能区分斑马鱼体内肿瘤中的脂质和用于麻醉固定斑马鱼的琼脂。 Qu等[20]基于类似方法搭建的CARS/SHG双模态显微系统, 可对活体小鼠肿瘤中的脂滴和胶原蛋白进行实时监测(图4), 为评估药物疗效提供新方案。 Luo等[19]在其利用CARS对AD小鼠大脑血管进行成像的工作中, 引入TPEF用于监测荧光标记的Aβ 斑块, 清晰观察到 AD小鼠脑内血管壁上的斑块沉积及其随月龄增加而显著增加的规律。 此外, Breunig等[30]结合TPEF和CARS对人体皮肤进行成像, Kö nig等[13]则结合CARS、 SHG和TPEF进行皮肤成像, 更全面地解析人体皮肤的结构和功能。 这些研究展示了CRS多模态融合显微成像在生物组织观察中的重要性和应用潜力。
CRS显微成像技术无需引入可能干扰生物分子正常功能的荧光标记物, 就能实现对生物样品中特定分子的特异性成像, 不存在光漂白和光毒性问题, 在活体成像中具备天然优势, 为复杂生物系统提供了全新的研究平台。 然而, 在实际应用于活体成像时, CRS显微技术仍面临光损伤、 成像深度限制和运动伪影等诸多挑战, 解决这些问题将进一步推动其在生物医学成像领域的应用。 近年来, CRS显微成像在克服上述问题、 实现活体成像方面取得了诸多研究进展, 但仍有许多进步空间。
在克服光损伤问题方面, 目前常规的做法是通过限制激光功率和积分时间来减少激光在样品中引起的热效应和化学反应。 但对于CRS显微成像所需的两束激光, 其功率变化与导致光损伤和影响成像质量的程度之间有何定量关系, 尚未有非常系统的研究。 因此, 目前能够参考的功率阈值数据十分有限。 此外, 采用低功率激光导致的CRS信号强度弱与缩短成像积分时间之间存在直接的矛盾关系, 如何有效解决该问题亟待深入思考。
在突破成像深度限制方面, 对皮肤或皮肤附近部位进行成像, 结合光学窗口或直接对微创手术暴露的深层组织或器官进行成像, 可以较好地避开生物组织的光吸收和光散射效应。 但前者的实际应用领域受到限制, 而后者则不能很好地发挥CRS显微无创的成像优势。 采用AO技术可以较好地兼顾深度和无创, 但目前能够达到的成像深度仍然比较有限。 内窥成像技术是突破成像深度限制、 实现对深层组织和器官进行无创成像的有效方法, 但目前仍存在诸多难点待解决, 尚未有真正应用于活体成像的CRS内窥显微成像技术。
在消除或减少运动伪影方面, 适当的麻醉和固定方式可确保生物体静止或减少运动, 光学窗口和实时运动矫正算法的应用可进一步隔绝麻醉样品因呼吸和心跳等生理活动引起的抖动影响, 而设法提高成像速度也可以在一定程度上减少运动伪影。 未来, 结合精密加工的固定装置和人工智能算法, 实现对自由运动的活体动物进行CRS显微成像也是有可能的。
此外, 结合TPEF、 SHG等多种非线性光学显微成像实现CRS多模态融合成像, 能够获取更丰富的信息, 增强对活体生物样品的分析能力, 助力对生物学信息的深入理解, 已成为目前的热门研究方向。 结合人工智能分析方法, 研究如何从多模态图像中提取更有用的信息, 也是研究人员正在努力的方向。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|