作者简介: 康子桐, 2000年生,中国农业大学资源与环境学院硕士研究生 e-mail: SY20233030642@cau.edu.cn
有机物经生物或化学转化聚合形成腐殖质的过程称为腐殖化, 该过程可由生物和非生物途径驱动, 非生物途径具有环境友好、 催化性能优良、 反应条件可控的优势, 在土壤肥力提升、 污染物调控、 提高堆肥质量等方面有重要作用, 但由于堆肥中微生物是有机物转化的主要驱动力且占主导地位, 导致非生物途径往往容易被忽视。 氨基酸是腐殖酸类物质的核心结构组分, 作为前体物质在非生物途径中, 参与酚蛋白与美拉德体系, 促进有机单体小分子物质聚合形成腐殖酸类物质。 以往研究表明腐殖质的形成过程普遍需要氨基酸参与合成反应, 不断缩合从而形成大分子聚合物, 然而, 不同氨基酸种类与浓度对非生物腐殖化的影响尚不清楚。 因此, 使用邻苯二酚和葡萄糖分别作为酚蛋白途径与美拉德途径反应底物, 对反应产物的提取溶液进行紫外-可见光谱、 三维荧光光谱分析, 以揭示氨基酸类前体物质对于腐殖酸非生物形成途径的影响机制为目标, 探究不同种类和浓度氨基酸对腐殖化过程的影响。 结果表明, 反应结束时赖氨酸参与的酚蛋白理论体系胡敏酸类物质(HLA)的浓度最高, 为120 mg·L-1。 在不同氨基酸参与的美拉德体系中, 仅在色氨酸添加体系观测到HLA的积累, 表明了芳香性氨基酸有助于美拉德体系中腐殖酸类物质的直接合成。 紫外-可见吸收光谱、 三维荧光光谱表明赖氨酸对非生物合成途径中腐殖酸的芳构化程度提升贡献更大。 随着赖氨酸浓度的提升, 各腐殖酸非生物形成体系中富里酸类物质(FLA)的含量也随之提升。 当赖氨酸浓度为0.025与0.05 mol·L-1时, 酚蛋白体系在反应的第24 h就产生了HLA。 在相同赖氨酸浓度下, 美拉德理论途径在反应结束时FLA含量最高, 酚蛋白体系的HLA产量最高、 胡富比(DP)也最高。 综合分析表明, 酚蛋白体系较美拉德体系具有更好的基于非生物途径合成腐殖酸的效果。 研究揭示了氨基酸种类与浓度对堆肥腐殖化进程的影响, 为进一步调控堆肥腐殖化程度、 强化酚-蛋白理论下的腐殖酸合成提供理论支撑。
The process by which organic matter is transformed and polymerized into humus through biological or chemical conversion is called humification. Both biological and abiotic pathways can drive this process. The abiotic pathway offers several advantages, including environmental friendliness, excellent catalytic performance, and controllable reaction conditions. It plays an important role in enhancing soil fertility, regulating pollutants, and improving compost quality. However, because microorganisms in compost are the primary driving force for organic matter transformation and play a dominant role, the abiotic pathway is often overlooked. Amino acids are the core structural components of humic acid substances and act as precursor substances in the abiotic pathway, participating in the phenolic protein and Maillard systems, and promoting the polymerization of small organic monomer molecules to form humic acid substances. Previous studies have shown that the formation of humus generally requires the participation of amino acids in the synthesis reaction, continuously condensing to form large molecular polymers. However, the effects of different amino acid types and concentrations on abiotic humification remain unclear. Therefore, in this study, catechol and glucose were used as the reaction substrates for the phenolic protein pathway and the Maillard pathway, respectively. The extraction solutions of the reaction products were analyzed by ultraviolet-visible spectroscopy and three-dimensional fluorescence spectroscopy. The aim was to elucidate the mechanism of amino acid precursor substances on the abiotic formation of humic acid and to investigate the effects of various types and concentrations of amino acids on the humification process. The results showed that at the end of the reaction, the concentration of humic acid-like substances (HLA) in the phenolic protein theoretical system with lysine participation was the highest, reaching 120 mg·L-1. In the Maillard systems with different amino acids, only the tryptophan addition system showed accumulation of HLA, indicating that aromatic amino acids are conducive to the direct synthesis of humic acid-like substances in the Maillard system. Ultraviolet-visible absorption spectroscopy and three-dimensional fluorescence spectroscopy indicated that lysine made a greater contribution to the aromatization degree of humic acid in the abiotic synthesis pathway. With the increase in lysine concentration, the content of fulvic acid-like substances (FLA) in each abiotic humic acid formation system also increased. When the lysine concentration was 0.025 and 0.05 mol·L-1, HLA was produced in the phenolic protein system at 24 hours into the reaction. Under the same lysine concentration, the Maillard theoretical pathway had the highest FLA content at the end of the reaction. In contrast, the phenolic protein system yielded the highest HLA and had the highest humic-to-fulvic acid ratio (DP). A comprehensive analysis indicated that the phenolic protein system had a more effective impact on the abiotic synthesis of humic acid compared to the Maillard system. This study revealed the influence of amino acid types and concentrations on the humification process of compost, providing theoretical support for further regulating the degree of compost humification and enhancing the synthesis of humic acid under the phenolic-protein theory.
近年来, 由于有机废弃物产量巨大, 废弃物资源化越来越受到重视。 好氧堆肥因其无害化处理效率高、 环境友好、 成本低等优势, 逐步发展成为有机废弃物堆肥的主要技术手段。 腐殖酸作为堆肥有机质稳定化的主要产物, 在改良土壤结构, 促进植物生长, 提高植物抗逆性等方面有重要作用。 腐殖质由土壤有机物质的主要成分胡敏酸(HA)、 富里酸(FA)、 和胡敏素组成, HA与FA活性较高, 常被统称为腐殖酸。 腐殖酸的腐殖化过程对土壤碳储存具有积极的影响, 腐殖酸具有的多种活性官能团如氨基、 羧基、 羟基、 酚基等, 可以与多种有机和无机污染物发生反应, 从而改变土壤中污染物的形态和活性[1]。 因此探究腐殖酸形成机制、 建立高效合成腐殖酸方法对开发腐殖酸类肥料产品具有重要意义。
腐殖酸的形成途径可以分为生物途径和非生物途径, 生物途径主要在微生物作用下, 蛋白质、 酚类和醌类通过自身的代谢活动或有机物的分解产生, 这些小分子缩聚形成腐殖酸[2]。 非生物途径主要理论糖胺缩合理论(又称美拉德反应)涉及糖和氨基酸之间的缩合反应, 酚-蛋白理论则认为腐殖酸核心一般是由芳香物质以及含氮物质组成, 它们通常以蛋白质或氨基酸的形式存在[3]。 相比于微生物主导的生物途径, 非生物腐殖化反应具有不受微生物生长条件限制、 反应条件可控、 产物可定向合成等优势而被关注。 研究表明, 非生物途径在腐殖化的过程中有重要作用, 前人研究发现利用非生物途径处理玉米秸秆, 其腐殖酸类物质的产量达到28 wt%[4]。 在非生物腐殖化途径中, 氨基酸、 糖类、 脂肪、 多酚等前体物质可以促进腐殖酸的形成, 在腐殖酸的形成阶段都要与氨基酸进行缩合, 从而形成大分子聚合物, 因此氨基酸对合成腐殖酸大分子具有重要意义[5]。 研究表明, 在堆肥过程中添加氨基酸可以显著提高腐殖酸的分子量。 在以往的研究中, 非生物途径和生物途径是分开研究的, 多集中于酚类物质的变化对腐殖化过程的影响。 氨基酸作为腐殖化过程的关键组分, 在堆肥过程中能够正向驱动腐殖化过程。 然而, 氨基酸在非生物腐殖化反应中所起的作用尚不完全清楚。 因此, 探索氨基酸对于腐殖酸非生物形成途径的影响, 揭示氨基酸与腐殖酸组成的关联性, 有助于探明氨基酸对不同腐殖酸非生物途径的贡献度, 为调控有机废弃物堆肥腐殖化进程提供理论支撑。
本研究通过纯培养体系, 选择邻苯二酚作为酚蛋白反应途径底物, 选择葡萄糖作为美拉德反应途径底物, 典型腐殖酸前体(谷氨酸、 色氨酸、 赖氨酸)构建以不同氨基酸为前体的非生物腐殖化体系, 优选腐殖酸合成效果好的氨基酸, 进一步探究其浓度变化对非生物腐殖化的影响, 利用紫外-可见光光谱、 三维荧光光谱结合区域体积积分法解析腐殖化过程, 考察氨基酸对非生物腐殖化反应的影响。 为深入了解氨基酸对非生物腐殖化过程的影响机制、 调控堆肥腐殖化过程提供参考。
葡萄糖、 邻苯二酚、 硫柳汞、 L-赖氨酸、 L-色氨酸、 D-谷氨酸、 去离子水、 盐酸、 氢氧化钠、 二氧化锰, 均为分析纯试剂分别采购自国药集团化学试剂有限公司、 阿拉丁试剂(上海)有限公司、 北京索莱宝科技有限公司、 上海源叶生物科技有限公司。
1.2.1 氨基酸对腐殖酸非生物形成途径的影响实验设计
本试验分为两部分, 不同类型氨基酸对非生物腐殖化影响试验设计如表1所示, 不同浓度赖氨酸对非生物腐殖化影响试验设计如表2所示, 根据不同腐殖酸形成机制添加不同的反应物, 酚-蛋白体系添加邻苯二酚, 美拉德体系添加葡萄糖, 所有体系加入100 mL 0.2 mol· L-1磷酸盐缓冲液(pH 8.00)维持反应环境稳定性, MnO2 1 g作为反应催化剂, 灭菌剂-硫柳汞添加量0.02 g· L-1, 硫柳汞在非常低的浓度下仍然有效, 在生物体内代谢为硫代水杨酸盐和乙基汞, 乙基汞阳离子通过与蛋白质结构中的硫醇基团结合来阻断酶的活性[6]。 这一特性表明硫柳汞主要通过影响微生物的代谢酶来发挥作用, 而不是直接参与或改变非生物腐殖化过程中的化学反应。 氨基酸与邻苯二酚或葡萄糖加入250 mL锥形瓶中。 所有反应体系重复三次进行。 在整个实验过程中保持无菌条件, 以保证腐殖化过程是非生物的。 将反应所需的玻璃器皿和超纯水在使用前在120 ℃高压灭菌20 min, 所有混合物在45 ℃控温振荡箱以150 r· min-1反应15 d。 分别在0、 24、 48、 72、 140、 360 h从每个处理取样, 在10 000 rpm下离心10 min, 测定腐殖酸含量以及紫外-可见吸收光谱检测。
| 表1 不同类型氨基酸参与腐殖酸非生物形成途径试验设计 Table 1 Experimental design of different types of amino acids involved in abiotic formation of humic acid |
| 表2 不同浓度赖氨酸参与腐殖酸非生物合成途径试验设计 Table 2 Experiment design of different concentrations of lysine involved in abiotic formation of humic acid |
用酶标仪对反应体系280~800 nm处的紫外-可见吸收光谱进行表征。 按照国际腐殖质协会(IHSS)推荐的方法对HA和FA分别进行提取和纯化, 该方法通过用NaOH水溶液进行碱萃取, 然后在低pH值下沉淀腐殖酸, 并进行涉及阳离子交换的脱盐步骤以获得黄腐酸。 使用Hitachi F-7000荧光分光光度计记录三维荧光(3D-EEM)图像, 发射波长200~600 nm, 步长10 nm; 激发波长200~600 nm, 步长1 nm, 扫描速度为1 000 nm· min-1。
使用SPSS19.0对试验数据进行统计分析。 使用MATLAB 2023b进行荧光区域积分对每个区域内的EEM下的体积积分, 归一化该区域内的投影激发发射面积, 产生标准化区域特定的EEM体积(Pi, n)。
荧光区域积分法相关公式为
第i个区域的体积积分
区域面积归一化
式(2)中, Si为第i块区域的面积, MFi称为倍增系数, 修正后第i块区域的体积积分
第i块区域的积分占总全区域的积分的比例
Origin 2023用于绘制图表。 绘制吸光度在可见光范围内对波长的对数, 利用光谱曲线的倾斜程度可以表征腐殖化过程的速率和程度, 选取400和600 nm波长对应的吸光度的对数的比值表示斜率[7]:
2.1.1 紫外光谱
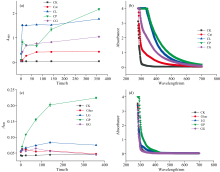
有色物质中官能团的相对丰度可以通过紫外-可见光光谱来表征。 引入400 nm处的吸光度作为检测有机聚合形成褐色物质的指标, 表明有机发色基团的生成[8, 9], 该处吸光度变化还可以显示氧化还原反应的进程, 有机物由多个共轭系统的苯环产生, 随着苯环化合物的不断增多其稳定性得到逐步加强, 从而作为腐殖化过程中有机聚合程度的一个指标。 如图1(a)所示为酚蛋白理论中不同氨基酸反应体系下的光谱变化。 CK处理400 nm处吸光度最弱, 且整个反应过程未观察到微生物生长迹象, 进一步验证了腐殖化反应液为无菌的非生物反应基质。 与培养0 h时的结果相比, 培养结束(360 h)时, CL、 CP、 CG处理的A400分别提高了1.42、 2.06、 0.99, 其中以CP处理的吸光度增幅最大, CL处理次之, 而对照的吸光度几乎没有增加。 相比之下, 对照组和仅有邻苯二酚的体系在整个反应过程中没有表现出显著的变化, 表明反应的缓冲溶液不干扰体系腐殖酸的产生。 所有添加氨基酸的处理暗化程度随着反应时间的推移而增加, 表明氨基酸在参与腐殖化的非生物形成途径中发挥着重要的作用, 能够促进邻苯二酚的腐殖化[10]。 图1(c)所示美拉德体系GP处理的A400在整个反应过程中呈逐步上升的趋势, 与0 h相比, 反应结束时(360 h)吸光度增长了0.17。 GP、 LG处理在整个反应过程中的A400均高于对照, 而GG处理在反应结束时与CK对照的A400较接近。 不同氨基酸参与的美拉德体系在反应前后A400增幅较小, 在45 ℃的恒温培养下, 酚-蛋白反应途径占主导地位, 酚类物质除了和含氮化合物聚合形成腐殖酸外, 还通过裂解环的方式与其他酚类化合物聚合形成腐殖酸, 其涵盖范围更广、 适用性更强。 色氨酸参与的反应体系腐殖化程度较高。 这是由于色氨酸本身具有芳香结构, 而芳香结构是腐殖酸结构的核心, 在腐殖化过程中, 氨基酸被纳入HA和FA的结构中[11]。 整体来看, 酚蛋白体系吸光度高于美拉德体系, 表明氨基酸在参与腐殖化的非生物形成途径中发挥着重要作用, 其能够促进邻苯二酚的腐殖化, 在两个体系中色氨酸均发挥作用显著。
2.1.2 腐殖酸含量
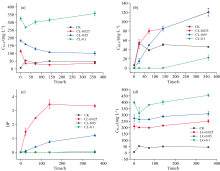
图2(a)所示酚蛋白体系中富里酸类物质(FLA)含量呈现先增加后减少最终趋于稳定的趋势, 这是因为FLA在MnO2的存在下转化为更稳定的胡敏酸类物质(HLA), 这导致了FLA的减少和HLA的增加。 在反应结束时, FLA含量几乎保持不变, 这表明反应体系已经达到了动态平衡, 在该平衡中, HLA产生和转化, 并且一部分不稳定的FLA被转化为二氧化碳[12]。 在培养结束(360 h)时, CL、 CP、 CG处理与CK组的cFLA相比分别比0 h降低了68.8%、 93.4%、 52.5%。 亲核加成反应可产生邻苯二酚和氨基酸的偶联产物, 如氨基酚和亚胺衍生物, 随后这些化合物通过氧化偶联聚合可能导致HLA的产生[8]。 图2(b)所示CP、 CG处理cHLA在前24 h呈上升趋势, 随后一直保持稳定至反应结束。 这可能是由于CP、 CG处理的在前24 h积累了一定量的cFLA, 促使cHLA的快速提高。 HLA分子量大且结构复杂缜密, 主要以芳香化合物为主, 芳香化程度高而解离程度小。 在酚蛋白体系下FLA分子量小且结构简单松散, 含有较多的羟基和羧基, 可通过环断裂与其他酚类化合物缩合形成腐殖酸, 作为腐殖酸核心骨架向分子量更大, 结构性质更稳定的HLA转化[13]。 而CL处理在反应的整个过程中, cHLA一直呈上升趋势, 因为赖氨酸作为碱性氨基酸使整个体系处在偏碱性的环境中, 而胡敏酸类物质易溶于碱, 增加了HLA的产量。 在培养结束(360 h)时, CL、 CP、 CG处理与CK组的cHLA相比分别比0 h提高了120.53、 72.87、 50.20 mg· L-1。
 | 图2 酚蛋白体系cFLA(a)、 cHLA(b)、 DP(c)与美拉德体系cFLA(d)、 cHLA(e)、 DP(f)变化Fig.2 The changes of cFLA, cHLA and DP in phenolic protein system(a, b, c) and Maillard system (d, e, f) |
图2(c)所示DP(胡富比)作为一个重要的参数, 被广泛用于描述腐殖质的缩合程度[14, 15]。 反应结束时, CL、 CP处理胡富比均为1.2, CG处理仅为0.38, 表明赖氨酸、 色氨酸参与的酚-蛋白理论体系生成的腐殖酸缩合度更高。 图2(d)所示美拉德体系GP、 GG反应体系在反应24 h时FLA含量出现了下降, 随后在24~72 h内快速上升, 之后呈缓慢增长趋势至反应结束, 这是由于在反应24 h时部分的FLA形成了短周期的中间体, 部分FLA形成不稳定物质, 可被氧气释放二氧化碳分解, 其余的FLA处于动态平衡[16]。 图2(e)所示GP体系HLA含量最高, 其他处理变化不明显, 表明在美拉德体系下色氨酸更有助于促进腐殖化进程。 与酚-蛋白体系的腐殖化进程相比, 在没有邻苯二酚存在的条件下, 仅GP处理的cFLA在反应过程中下降了, 表明该体系中FLA向HLA的转化程度更高, 这可能是因为色氨酸的芳香性结构导致它更容易向胡敏酸这类复杂大分子物质的转变。 美拉德体系下FLA含量较多, 向HLA的转变较慢, 仅有色氨酸促进了HLA的形成。 酚蛋白体系不同种类氨基酸均可促进FLA向HLA的转变, 其中赖氨酸处理的HLA产量最高。
2.1.3 腐殖化速率
通过绘制吸光度对可见光范围内波长的对数, 腐殖质的吸收光谱通常以直线的形式产生。 这种直线或曲线的斜率被作为区分腐殖质的特征, 腐殖质的颜色越浅, 光谱线的坡度就越陡, 而颜色越深, 光谱线就越趋于水平。 因此, 光谱曲线的倾斜程度可以转化为腐殖化过程的速率或程度。 Q4/6值越小, 腐殖化程度越大。 图3(a, b)所示酚蛋白体系中, 在三种氨基酸参与的酚-蛋白体系中CP处理Q4/6最小为-0.76。 表明色氨酸参与的酚-蛋白体系腐殖化速率显著高于赖氨酸、 谷氨酸参与的反应。 图3(c, d)所示在美拉德体系中, 色氨酸参与的反应体Q4/6值最小为0.46, 且在反应结束时获得的产物腐殖化程度最高。 赖氨酸反应体系Q4/6值为0.79, 谷氨酸反应体系Q4/6值0.94, 与色氨酸体系分别相差0.33、 0.48, 这表明色氨酸对美拉德体系腐殖化反应的发生具有重要的促进作用。 色氨酸结构中的吲哚环在美拉德反应中可以生成具有生物活性的化合物, 美拉德反应的中间阶段, 通过阿马多里重排和其他反应生成多种化合物, 将糖胺转化为酮糖胺, 随后的脱水和水解形成5-羟甲基糠醛, 进而生成醇醛或无氮聚合物, 这些过程可能对腐殖化过程提供帮助[17]。
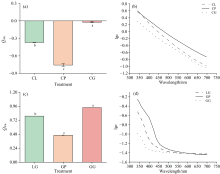 | 图3 360 h时酚蛋白体系Q4/6(a)、 吸收光谱斜率(b)与美拉德体系Q4/6(c), 吸收光谱斜率(d)Fig.3 Q4/6 values and absorption spectral slopes of phenolic protein system (a, b) and Maillard system (c, d)after reaction for 360 h |
2.1.4 三维荧光图谱与FRI分布
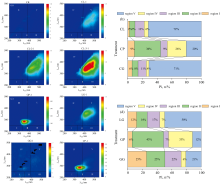
荧光是研究腐殖酸内部微结构域的敏感工具。 荧光区域Ⅰ (发射波长250~330 nm, 激发波长200~250 nm)和区域Ⅱ (发射波长330~380 nm, 激发波长200~250 nm)属于简单的芳香蛋白, 区域Ⅲ (发射波长380~550 nm, 激发波长200~250 nm)由富里酸类物质引起, 区域Ⅳ (发射波长250~380 nm, 激发波长250~500 nm)代表可溶性微生物副产物类物质, 区域Ⅴ (发射波长380~550 nm, 激发波长250~500 nm)属于胡敏酸类物质[18]。 应用百分比荧光响应(Pi, n)分析在反应360 h后不同种类氨基酸参与反应体系中DOM的变化。 荧光区域积分(FRI)将EEM光谱下的特定区域进行积分, 以代表具有相似特性的DOM的累积荧光响应[19]。 图4(b)所示酚蛋白体系中CP处理区域Ⅰ 、 区域Ⅱ 荧光区域积分与其他处理相比占比最大, 表明CP体系反应结束时的产物有较多的芳香蛋白, 这可能是由于体系中的色氨酸在反应过程中并未完全消耗完。 CL、 CP、 CG处理区域Ⅲ 占比分别为13%、 9%、 11%, 可见赖氨酸参与的酚-蛋白反缨体系反应结束时DOM中富里酸类组分含量最高, 色氨酸最低。 CL、 CP、 CG处理区域Ⅴ 的占比分别为72%、 20%、 71%, 由此可知赖氨酸参与的反应体系反应结束时DOM中胡敏酸类组分含量最高, 色氨酸体系最低并与赖氨酸体系相差52%。 图4(d)所示GP 处理区域Ⅰ 、 区域Ⅱ 占比之和为48%, GG处理区域Ⅰ 、 区域Ⅱ 占比之和为51%, 表明GP、 GG体系反应结束时有较多的芳香蛋白类物质。 LG、 GP、 GG处理区域Ⅲ 占比分别为7%、 33%、 6%, 表明色氨酸参与的美拉德反应体系结束时DOM中富里酸组分含量最高, 而赖氨酸和谷氨酸含量较低。 LG、 GP、 GG处理区域Ⅴ 占比分别为50%、 12%、 21%, 可知赖氨酸参与的反应体系结束时DOM中胡敏酸类组分含量最高, 这可能与其偏碱性的环境中胡敏酸类物质易溶有关。 色氨酸体系胡敏酸占比最低并与赖氨酸体系相差38%。 因此, 可以得出结论, 不同的前体经过美拉德途径所产生的腐殖酸结构有所差异, 以赖氨酸为前体的美拉德体系反应结束时产物中的胡敏酸组分含量最高, 表明该处理腐殖化程度较高。
2.2.1 紫外光谱
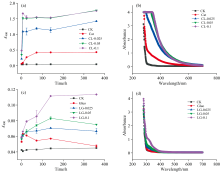
图5(a)所示在酚蛋白体系中, 随着赖氨酸浓度的提升, 反应过程中400 nm处的吸光度也随之增加, 与0 h相比, 360 h时CL-0.025、 CL-0.05、 CL-0.1处理400 nm处的吸光度分别增加了1.20、 1.42、 1.27, 其中CL-0.05、 CL-0.1处理在360 h处吸光度最高, 这是因为随着物料的反应, 各处理中腐殖化作用逐渐增强, 氨基酸含量的提升将加快氨基酸态氮向复杂态氮的转化, 体系暗色化程度加深。 图5(b)所示当赖氨酸浓度从0.025 mol· L-1提升至0.05 mol· L-1时, 体系在280~700 nm范围内的吸收强度也随之增加, 这表明提升酚蛋白理论中赖氨酸的浓度, 会在一定范围内促进有色物质的形成。 图5(c)所示在糖胺缩合体系中随着赖氨酸浓度的提升, 反应过程中400 nm处的吸光度也随之增加, 与0 h相比, 360 h时LG-0.025、 LG-0.05、 LG-0.1处理400 nm处的吸光度分别增加了0.008、 0.019、 0.055。 相比于酚蛋白体系, 美拉德体系的处理组在反应过程中 400 nm 处吸光度增幅较小。 图5(d)所示在反应15 d后, 随着赖氨酸浓度的提升, 体系在280~700 nm范围内的吸收强度也随之增加, 但增加幅度较小。 320 nm处有峰保留, 这表明参与美拉德体系的腐殖酸前体在过程中聚合是不完全的。
2.2.2 腐殖酸含量
随着赖氨酸浓度的提高, 酚-蛋白、 美拉德体系中的cFLA在0 h时也相应提升, 并在反应过程中波动较小。 FLA的关键结构是N— H和— COOH[20], 因此提升反应体系中赖氨酸的浓度, cFLA也随之提升。 在腐殖酸形成过程中, FLA会逐渐转化为HLA, 完成由简单结构向复杂结构的转化。 这种转化导致FLA和HLA含量的变化趋势相反。 图6(a、 b、 c)所示为酚蛋白体系下不同浓度赖氨酸对腐殖酸类物质的影响, 赖氨酸浓度为0.1 mol· L-1时, 培养反应结束时(360 h)cFLA最高, 但其cHLA最低, 这是因为赖氨酸本身呈碱性, pH较高时减慢了FLA向HLA的转变, 过高的反应物浓度导致的pH升高会促使该平衡系统向逆向转变来减少这种变化, 导致了胡敏酸类物质浓度的减少。 CL-0.025处理与CL-0.05处理在360 h时HLA浓度最高, 且它们的FLA浓度呈现下降趋势, 这是因为赖氨酸的氨基和羧基作为腐殖酸的核心骨架, 促进了FLA向HLA的转变, 使腐殖质向更加复杂稳定的方向转化。 但是随着赖氨酸浓度提升为0.1 mol· L-1时cHLA下降, 这表明最终反应的cHLA并不完全由赖氨酸浓度决定, 还由其他影响因素。 在不同处理中, 酚类化合物都是腐殖质的基本单体和骨架, 它对于提高腐殖化程度起重要作用, 赖氨酸浓度的提升, 使邻苯二酚占比降低, 达到一定比例后成为了试验中腐殖酸形成的限制因素, 从而导致了上述的试验结果。 CL-0.025处理在反应结束时DP最大, 添加0.025 mol· L-1赖氨酸的体系初始FLA含量较低, 富里酸的形成需要— COOH, 体系中的— COOH全部来源于赖氨酸, 因此FLA的浓度与赖氨酸的浓度呈正相关。 图6(d)所示美拉德体系中cFLA均呈上升趋势, 与0 h相比, 反应结束时(360 h)分别提升了40.7、 35.9和57.7 mg· L-1, 并且均没有生成HLA, 这可能是因为赖氨酸的Nα -和Nε -胺基都可以与葡萄糖反应, Nε 通道中的势垒低于Nα 通道中的势垒, 与后者相比, 通过前一个通道的反应速率更快, 这可能意味着在赖氨酸参与的美拉德反应中, Nε -胺基的反应限制了HLA的转变[21]。 温度是另一个影响美拉德反应的重要条件, 美拉德反应在30 ℃附近便可发生, 平均每提高10 ℃反应速率提高3~5倍。 数据表明在45 ℃的条件下, 美拉德反应体系中FLA向HLA的转化速率较慢, 因此温度成为限制反应的重要条件。
 | 图6 酚蛋白体系cFLA(a)、 cHLA(b)、 DP(c)与美拉德体系cFLA(d)的变化Fig.6 Changes of cFLA, cHLA, DP in Phenolic protein system (a, b, c) changes of cFLA in Maillard system (d) |
2.2.3 三维荧光图谱与FRI分布
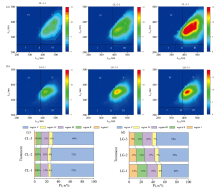
反应体系产生的DOM中含有大量的腐殖酸成分, 利用荧光信号表征不同体系中DOM组分的差异。 图7(a、 b)所示腐殖酸形成途径与浓度变化均会影响荧光强度, 提高各反应体系中氨基酸的浓度, 会促使氨基掺入腐殖酸结构中从而极大地改变了这些大分子的荧光性质。 图7(c)所示酚蛋白理论体系反应结束时DOM的 FRI 分布赖氨酸浓度为0.025、 0.05和0.1 mol· L-1 的处理区域Ⅲ 的占比相等为13%, 区域Ⅴ 的占比分别为72%、 72%、 69%, 这与通过测定富里酸、 胡敏酸浓度所得到的结果是一致的。 图7(d)所示美拉德体系反应结束时DOM的FRI分布随着赖氨酸浓度的提升, 各处理区域Ⅲ 的占比逐渐下降, 从16%下降到13%; 各处理区域Ⅴ 的占比从46%上升到54%, 说明美拉德体系中赖氨酸对腐殖化程度起一定的影响, 但反应较慢腐殖化速率不高。 赖氨酸在美拉德反应中可以刺激糖的降解、 聚合和褐变过程, 表明在美拉德体系下赖氨酸浓度的提高, 有利于大分子物质的形成, 但结合图6(d)美拉德体系仅检测到FLA的生成而未检测到HLA, 这可能是因为美拉德体系温度较低, 反应慢导致HLA含量较少, 同时Nε -胺基的反应是限制了HLA的积累。 在酚蛋白体系中, 多酚在碱性条件下容易氧化形成半醌自由基, 这些活性中间产物容易与赖氨酸亲核残基反应, 形成共价交联, 生成稳定的多酚复合物[22]。 总体来看酚蛋白体系对腐殖化贡献更大, 而提高赖氨酸浓度有利于HLA的生成。
(1)不同氨基酸对酚蛋白腐殖化途径和美拉德腐殖化途径均有贡献。 赖氨酸参与的酚蛋白体系胡敏酸类物质的浓度最高, 为120 mg· L-1。 赖氨酸参与的美拉德体系三维荧光光谱中代表HLA的Ⅴ 区占比最高为50%。 芳香族氨基酸-色氨酸由于其芳香结构的存在对于美拉德体系中HLA的直接产生有重要意义。
(2)在相同的赖氨酸浓度下, 酚-蛋白体系的HLA产量最高, 胡富比也最高, 腐殖化速率最快。 因此, 促进酚蛋白途径可用于未来强化堆肥腐殖化进程。 由于在堆肥中添加赖氨酸前体成本较高, 同时考虑到含有更多赖氨酸的蛋白质类废物的普遍存在, 如牲畜粪便或食品添加剂生产的废物(如味精和氨基酸), 可以将类蛋白质废弃物和类木质纤维素废物联合, 并在实际应用中验证得出反应物比例, 以提高堆肥腐殖化效率。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|