作者简介: 任丹丹,女, 2000年生,西北大学光子学与光子技术研究所硕士研究生 e-mail: rendandan2022@163.com
内窥镜作为临床常用的多学科交叉融合器械, 在重大恶性疾病筛查、 临床诊断、 术中检测与预后评估等方面发挥着重大作用。 相比于其他光学分析技术, 多光谱成像技术(MSI)作为一种图(图像)谱(光谱)结合的光学分析手段, 在临床内窥光学检测方面更具优势。 基于此, 我们以氙灯光源、 硬管内窥镜和成像CCD为核心, 研建了一套快速多光谱内窥成像系统, 并利用活体大鼠睾丸组织作为研究对象评估了其成像分析性能。 该系统在照明光源内部安装有一个步进电机驱动的分光装置, 并采用六个3通道窄带滤光片, 同时在蓝光(B: 415~490 nm)、 绿光(G: 500~595 nm)和红光(R: 615~760 nm)波段实现3个约15 nm窄带照明光的多谱带协同照明。 照明光经光波导光纤传输至硬管内窥镜后, 由CCD实时采集(每秒24个MSI数据集)每个滤光片所对应的窄带图像与视频信息。 利用自适应直方图均衡化(AHE)算法和CIELab色彩空间模型提高所获多光谱图像数据集与重构图像的对比度; 通过计算CCD光谱响应的校准系数矩阵, 并结合组织光学传输模型, 在重构分析组织多光谱图像与其反射光谱基础上, 进一步可视化呈现活体动物模型的生理特征图像(血液含量、 氧合指数、 散射体尺寸分布图像等)。 实验结果表明, 处理后的MSI图像显著增强了组织表层血管、 皮下微血管以及其他组织结构的可见度, 也更有利于观察组织结构纹理、 毛细血管分布情况; 重构的生理特征图像可视化呈现出组织不同部位间血容量分布差异; 通过分析组织反射光谱特征, 能够进一步量化评估组织内部血液含量差异。 本文所提出的内窥光学成像技术与其检测系统, 可在无标记可视化描述组织形态特征的前提下, 进一步定量分析组织内部生化构成信息, 有助于探索并形成满足临床癌变早期检测要求的新型内窥光学检测新技术。
Endoscope, a commonly used multi-disciplinary fusion instrument, is important in screening, clinical diagnosis, intraoperative detection, and prognosis assessment of major malignant diseases. Compared with other optical analysis techniques, Multispectral Imaging (MSI) provides both imaging and spectral information and has more advantages in clinical endoscopy optical detection. We developed a fast multi-spectral endoscopy imaging system with Xenon light source, hard tube endoscope, and imaging CCD. We evaluated its imaging performance using living rat testicular tissue as the study object. The system uses six 3-channel narrow-band filters as spectral splitting devices, which can simultaneously achieve three 15 nm narrow-band lighting (~ 15 nm bandwidth) in blue, green, and red wavelengths. After the illumination light is transmitted to the hard tube endoscope through the optical waveguide fiber, the CCD collects the narrowband image and video information corresponding to each filter in real-time (24 MSI data sets per second). The Adaptive Histogram Equalization (AHE) algorithm and CIELab color space model improve the contrast of the obtained multi-spectral images. Combined with the tissue optical transmission model, based on reconstructing tissue multispectral image information, physiological characteristics of living biological tissues (blood content, oxygenation index, scatterer size distribution images, etc.) are further visualized. The experimental results showed that processing MSI images significantly enhanced the visibility of surface tissue blood vessels, subcutaneous microvessels, and other tissue structures and was more conducive to observing tissue texture and capillary distribution. The reconstructed physiological features visualized the differences in blood volume distribution between different tissue parts. By analyzing tissue reflectance spectral characteristics, differences in blood content within tissues can be further quantitatively assessed. The MSI-based endoscopy technology and its detection system in this paper can further quantitatively analyze the biochemical composition information inside tissues on the premise of visually describing the morphological characteristics of tissues without labels, which is helpful to explore and form a new endoscopy optical detection technology that meets the requirements of early detection of clinical cancer.
内窥镜是光学、 电子学、 临床医学、 生物医学工程、 机电工程等高科技学科的有机结合体。 在临床实践中, 内窥镜既能筛查发现恶性病变及其隐匿病灶, 还能获取活检组织辅助病理学分析与治疗方案制定, 还可用于随访监测治疗效果[1, 2, 3]。 通过采集组织白光影像信息, 白光内窥成像技术(white light imaging, WLI)对组织形态改变具有较高检出率。 早期病变组织与其周围组织间的WLI图像差异尚不显著, 因此, WLI无法有效区分早期病灶与其周围正常组织, 检测灵敏度尚有较大提升空间[4]。 与WLI工作原理不同, 自发荧光内窥成像技术(autofluorescence imaging, AFI)利用组织/细胞自发荧光特征进行成像, 可显著提高早期诊断癌前病变的灵敏度[5]。 除WLI与AFI技术外, 窄带内窥成像技术(narrow band imaging, NBI)基于血红蛋白对不同波长光子吸收特征差异, 采用415 nm蓝光观察成像表面黏膜层毛细血管, 540 nm绿光观察黏膜下较粗大血管[6]。 将成像增强与人眼视觉感知特性相结合, NBI对黏膜表浅及深层毛细血管网具有很好的形态学成像能力, 有利于早期临床检测不典型增生及原位癌。 相比于单独使用WLI与AFI技术, NBI可显著提高临床恶性疾病检测特异性, 但其灵敏度仍不及AFI技术[7, 8], 并且联合应用AFI与NBI并不能显著提高内窥检查准确性[8, 9, 10]。 因此, 尚需运用多种光学成像原理, 探索满足临床早期癌变检测所需诊断准确度的新型内窥光学检测技术。
多光谱成像技术(mutispectral imaging, MSI)是一种图(图像)谱(光谱)结合的光学分析手段, 能够在二维图像检测阵列(CCD、 CMOS等)每个像素收集特征反射光谱, 形成含有空间和光谱信息的三维数据集(x-y-λ 维度)。 数据集内二维(xy维)图像反映样品形态信息, 所有二维图像上同一像素点的波长坐标值(λ )连续排列, 就可形成该像素反射光谱曲线[11]。 在生物医学研究中, MSI能够提供生物组织的3维数据立方体, 包含生物特征的空间信息和光谱信息, 从而准确鉴别不同的组织病理成分[12], 为病变组织器官的深层次分析研究提供了数据获取保障[13]。 相比于其他新型光学成像技术, 例如: 共聚焦成像技术、 近红外二区成像技术、 非线性光学成像技术等, 基于MSI技术的内窥光学检测手段更具有临床应用前景。 这是因为, 将MSI与现有临床内窥镜相结合, 仅需将高效分光方法融合于临床内窥镜照明结构, 而无需单独设计成像探头或改变内窥镜光学结构; 其次, 通过有效匹配分光效率、 成像视场与成像速率等参数, MSI可获得组织宏观无标记多光谱图像与视频信息, 这更有利于临床医生使用; 最后, 基于所获MSI图像数据集, 在可视化分析组织宏观形貌特征信息的基础上, 进一步结合光谱分析算法提取、 识别组织生化构成信息, 有利于提高临床内窥诊断特异性。
因此, 本工作提出以宽谱照明、 硬式内窥镜和成像CCD为核心, 研建快速多光谱内窥镜成像系统, 在无标记可视化呈现活体生物组织的形貌特征的同时, 结合生物光学基本原理, 重构组织生理参数(血液含量、 氧合指数、 散射体尺寸等)分布信息。 以活体大鼠动物模型, 对该内窥成像系统性能进行分析与评估。 这一研究工作在探索新型内窥光学检测方法与器械的基础上, 有望形成一种满足临床癌变早期检测准确度要求的内窥光学检测新技术。
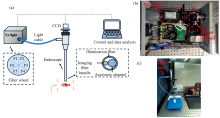
如图1(a)所示, 多光谱内窥成像系统主要由成像光源、 硬管内窥镜和成像CCD三个部分构成。 在图1(b)所示成像光源中, 该系统采用150W氙灯(PE150AFM, PerkinElmer)提供400~800 nm宽谱照明。 光源之后, 由一个步进电机驱动的, 安装有六个3通道窄带滤光片(F1— F6)的滤光片转轮, 作为分光装置。 每个滤光片可同时在蓝光(B: 415~490 nm)、 绿光(G: 500~595 nm)和红光(R: 615~760 nm)波段实现3个约15 nm窄带照明光(~15 nm带宽)输出。 如图1(c)所示, 照明光经液态光波导光纤(LLG3-8H, Thorlabs)传输至硬管内窥镜, 实现多谱带协同照明。 安装于硬管内窥镜顶端的彩色CCD(分辨率659(高)× 494(宽), 像素大小5.6 μ m× 5.6 μ m, 成像速度90帧· s-1, Sony ICX618AQA)作为成像器件, 用于实时采集在每个滤光片所对应的窄带图像与视频信息。 滤光片转轮每旋转一周, CCD共采集18个不同照明波段的光学图像, 构成多光谱图像数据集, 并存储于计算机内用于后续分析与信息提取。 利用CIE标准照明体D65在蓝光(B: 415~490 nm)、 绿光(G: 500~595 nm)和红光(R: 615~760 nm)波段的特征反射信息, 对多光谱图像数据集进行卷积运算后, 整合数据集信息, 得到视频级彩色图像。
上述多光谱内窥成像系统所涉及的图像校准和重构方法在本团队相关论文中已有介绍[14, 15]。 简单而言, 为了校准CCD对于不同波长信号光强的响应强度, 我们提出基于CCD光谱响应的校准系数矩阵, 用于补偿与校准每个窄带滤波片中三个检测通道的光谱重叠效应。 当CCD在RGB通道中检测到的滤波片F1信号光强分别为Ir1、 Ig1和Ib1, CCD中B通道输出值不仅取决于B通道灵敏度TBb1, 还取决于另外两个通道的灵敏度TBg1和TBr1, 用矩阵形式表示为
其中
为了校准滤光片的CCD对于波长响应光谱, 可通过在单独曝光中分别用Ib1、 Ig1和Ir1来照亮CCD, 获得校准矩阵TRGB1的系数。 对于每个单独的曝光, 使用功率计测量光强度Ib1、 Ig1、 Ir1, 并进行归一化处理。 单一光强的信号强度C可以从CCD通道的读数中得到。 因此, 通过式(1), 可以计算出TRGB1。 由于实验中使用了6个不同的3通道窄带滤波片, 因此需要对每个滤波器进行光谱响应校准, 以获得不同的TRGBn, 其中n=1, 2, …, 6(对应滤光片序号)。
为了减少仪器响应误差, 实际组织特征反射光谱Rdi(λ )可以通过式(5)求出
式(5)中, Rmi(λ )为测量所得反射光谱, Rstd(λ )为从标准漫反射板(WS-1, Ocean Optics)获得的参考反射光谱, Rdi(λ )为校准后所得组织反射光谱, ki是与波长无关的独立因子, 也称为几何校正因子。 在像素位置不影响成像效果的前提下, ki=k。
通过对上述校准与预处理后所得反射光谱进行分析, 可量化绘制生物组织血容量、 氧合指数、 散射体等参数的分布图像。 测量所得反射光谱Rm(λ )中得到吸收系数μ a(λ )与约化散射系数μ 's(λ )的比值, 即
式(6)中, γ (λ )为相对吸收光谱, μ 's=μ s(1-g), 并将其作为计算组织光学参数(μ a, μ s, g), 及其病理和结构参数(组织血容量B、 血氧饱和度S、 散射体尺寸分布参数κ )的唯一解。
理论上, 组织表面不同波长(λ )的反射光谱Rd(λ )可由福克定律(Fick's Law)给出[16]
式(7)中, ϕ 为组织内照明光能量密度, j为扩散通量, I0=[IbIgIr]-1为入射光强, 以及γ 为与组织光学特性有关的扩散常数。
根据组织生物结构和微血管相关的光学特性参数, 建立光学传输理论模型, 可推导出反射光谱与组织病理和结构特征参数之间的关系。 通过扩散近似理论计算得出光能量密度ϕ 的基础上, 连续平面光在组织内的光学能量密度按指数衰减, 可按扩散近似模型求出[16, 17]
其中,
为有效衰减系数, $R_s$为非偏振光的镜面反射率, E(z, ω ^)为入射准直光源项, $E_0$为初始辐照量, ω ^表示光传播方向的单位向量, z ^是垂直于介质表面指向内部的单位向量, 并与坐标轴z共线, f为光子前向散射概率, $g^* $表示散射扩散因子不对称度。 在一维散射近似模型下, 对Henyey-Greenstein相位方程进行求解, 可计算出f和$g^* $的值,
根据式(11), 我们可以直接从组织反射光谱Rd(λ )中计算出相对吸收光谱γ (λ )[18]
其中,
相对吸收光谱γ (λ )可以根据组织发色团和散射特性进一步建模如式(12)和式(13)
式(12)和式(13)中, B为血容量分数, S为血氧饱和度指数, W为水的体积分数, VS为有效散射体体积分数, κ 为与有效散射体尺寸大小相关的指数, B'是相对血容量分数, 大小为B'=B/Vs。 同时, μ α , oxy(λ ), μ α , deoxy(λ )以及μ α , water(λ )分别是氧血红蛋白、 脱氧血红蛋白和水的吸收系数。 将式(12)和式(13)合并成矩阵形式, 得到如式(14)线性矩阵反演公式, 用于量化组织血液供应情况
其中,
B'是相对血容量分数, 大小为B'=B/Vs。
为了提高多光谱图像数据集与重构图像的对比度, 我们利用基于自适应直方图均衡(adaptive histogram equalization, AHE)算法和CIELab色彩空间(commission international eclairage LAB color space)模型对不同波长下的二维灰度图像以及彩色图像(不同通道的RGB图像)进行处理。 AHE将图像分割成多个子区域, 为每个区域计算出一个对应的直方图, 然后根据各个区域的直方图重新调整该区域内像素的灰度分布。 在AHE算法中通过将图像分割成多个子块进行处理, 可以有效减轻原图像直方图过于尖锐的影响, 实现亮度调整和对比度增强的效果。 将原图像设定为I时, AHE表达式如式(15)[19]
式(15)中,
CIELab色彩空间是一种色彩模型, L通道定义为亮度分量, 值域为[0, 100], 表示从极黑到极白; a通道定义为颜色分量, 值域为[-128, 127], 表示从深绿色到灰色再到亮红色的变化; b通道是另一个颜色分量, 值域为[-128, 127], 表示从亮蓝色到灰色最后到黄色的颜色变化。 与RGB颜色空间相比, Lab色彩空间表示的颜色更加丰富, 且Lab色彩空间包含了人类视觉系统可以感知的所有颜色, 并且不受具体设备显示特性的影响。 亮度分量的L通道非常接近人类对光的感知度, 图像对比度的调整可以选择L通道, 因此在进行对比度增强时候, 只需要调整L通道即可。
选取8周龄体重200~250 g的成年Sprague-Dawley雄性大鼠2只, 使用7%水合氯醛(0.75 mL/100 g)腹腔内注射麻醉, 麻醉前12 h禁食不禁水。 麻醉成功后, 对大鼠腹部区域进行备皮, 随后碘伏消毒。 观察待大鼠进入麻醉状态后, 小心切开腹部位置, 暴露出膀胱和睾丸, 手术过程中随时纱布止血。 利用多光谱内窥成像系统, 通过调整内窥镜与样本表面之间的距离和角度, 获得清晰的大鼠样本的多光谱数据集。 活体动物实验由中国西安市西北大学动物伦理委员会批准, 并遵循科技部《关于善待实验动物的指导性意见》要求。
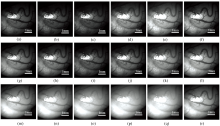
在调整成像参数之前, 先对内窥镜系统的顶端进行定位, 以获得CCD相机的最佳焦距和成像角度。 如图2所示, 该系统首先采集18个独立照明波长下的大鼠睾丸多光谱图像。 其中, 图2(a)— (g)所示中心波长在415、 435、 445、 460、 490、 475和510 nm的图像中, 大鼠睾丸表面的粗血管分布可以被清晰地观察到, 同时粗血管边缘较清晰, 但是微血管和毛细血管的分布较为模糊。 由于在525~580 nm波段, 血液对光线的吸收能力很强, 因此能够清晰地观察到血管、 周围微血管和毛细血管等细小结构, 如525、 540、 560和575 nm波长漫反射图像[图2(h)— (k)]所示。 在600~700 nm范围内, 血红蛋白的吸收系数较低, 因此在图2(l)— (q)中, 血管清晰度较差, 且细小血管缺失。 由于近红外光可以穿透的组织深度高于可见光, 所以在760 nm的光照下, 图2(r)中显示了更多的血管信息。
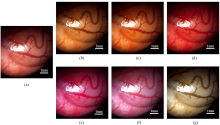
图3(a)为400~760 nm波段的反射光谱图像进行积分并与标准CIE光源进行卷积得到的内窥镜图像。 图3(b)、 (c)、 (d)、 (e)、 (f)和(g)分别是由不同滤光器生成的窄带RGB图像的简单叠加结果。 图3(b)是滤光片1生成的R(615 nm)、 G(510 nm)、 B(415 nm)图像叠加的结果, 图3(c)是滤光片2生成的R(625 nm)、 G(525 nm)、 B(435 nm)图像叠加的结果, 图3(d)是滤光片3生成的R(645 nm)、 G(540 nm)、 B(445 nm)图像叠加的结果, 图3(e)是滤光片4生成的R(665 nm)、 G(560 nm)、 B(460 nm)图像叠加的结果, 图3(f)是盟光片5生成的R(690 nm)、 G(575 nm)、 B(475 nm)图像叠加的结果, 图3(g)是滤光片6生成的R(760 nm)、 G(595 nm)、 B(490 nm)图像叠加的结果。 由于每个滤波器产生的窄带不同, 叠加后的图像颜色以及组织层次深度也不同。 将单通道彩色图像与内窥镜图像进行比较后, 可以观察到内窥镜图像具有更佳的视觉效果, 且具有更丰富的组织微观结构信息。
图4为大鼠睾丸部位的生理学参数, 图4(b)、 (c)和(d)中分别为血容量、 氧合指数、 散射体尺寸分布图。 大鼠的睾丸组织中存在大量的血液, 导致血红蛋白和脱氧血红蛋白对光的强烈吸收, 可以通过图4(b)中像素值的散射来定性描述血液含量分布, 颜色越深表示血容量越大, 血红蛋白对光的吸收越强。 同样地, 在图4(c)和(d)中, 较深的颜色表示氧合指数和散射体尺寸分布参数越大。 通过采集的图像可以观察到不同部位之间血容量存在显著差异。 然而, 由于我们所研究的是健康大鼠模型, 组织氧合指数和散射尺寸分布参数几乎没有明显的变化。 图4(b)、 (c)和(d)中部分区域的灰度值与周围区域的灰度值存在显著差异, 由成像过程中组织表面镜面反射造成。
从大鼠睾丸内窥镜图像中选取A、 B、 C三点, 如图4(a)所示, 点A来自微粗血管周围的实质区域, 点B来自粗血管, 点C来自微血管分布区。 图4(e)为A、 B、 C 三点在波长435~690 nm 范围内校准后的组织反射光谱, 可以观察到在整个光谱范围内B点组织反射光谱低于A、 C两点。 A、 B、 C三点均在525和575 nm 处存在血红蛋白和氧合血红蛋白的吸收峰, 由于B点的血液含量较高, 对光线的吸收更强烈, 因此B点的吸收峰更明显。 图4(f)显示了A、 B、 C三点血容量估计值, B点血液含量最多, C点次之, A点最少, 这主要是由于粘膜不同位置粗血管和微血管分布不同。 综合以上结果, 多光谱图像相比于人工视觉分析或传统的白光成像, 通过重构的生理特征图像和反射光谱特征, 更有助于观察组织结构与组成差异信息, 评估组织病变信息, 有望实现早期病变的活体无标记量化检测。
结合多光谱成像原理, 以氙灯光源、 硬管内窥镜和成像CCD为核心, 我们研建了一套快速多光谱内窥成像系统。 该系统利用六个3通道窄带滤光片作为分光装置与快速成像CCD, 可同时在(B: 415~490 nm)、 绿光(G: 500~595 nm)和红光(R: 615~760 nm)波段, 以每秒24个多光谱图像数据集的速度, 无标记实时采集活体生物组织的多光谱图像信息。 通过构建校准系数矩阵和组织光学模型, 可重建生物组织血容量、 氧合指数、 散射体等生理参数量化分布图像; 并且采用AHE算法与CIELab模型对组织多光谱图像信息增强图像对比度。 结合活体大鼠动物模型可以看出, 该系统显著增强了组织表层血管、 皮下微血管以及其他组织结构MSI图像的可见度, 也更有利于观察组织结构纹理、 毛细血管分布情况; 重构的生理特征图像可视化呈现出组织不同部位间血容量分布差异; 通过分析组织反射光谱特征, 能够进一步量化评估组织内部血液含量差异。 研究结果表明, 所搭建的内窥光学成像系统, 能够以图(图像)谱(谱)结合的方式, 无标记可视化描述组织形态特征, 定量分析组织内部生化构成信息, 有助于探索并形成满足临床癌变早期检测要求的新型内窥光学检测新技术。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|