作者简介: 张小玲,女, 1989年生,安徽大学讲师 e-mail: xlzhang@ahu.edu.cn
浮游藻类是海洋生态系统中最重要的生产者。 离散三维荧光光谱法解决了连续三维荧光光谱仪运行条件要求高的问题, 能够满足浮游藻类的在线与原位监测需求。 但活体荧光不稳定性以及色素组成相似性导致的不同藻类光谱之间离散三维荧光光谱差异降低的问题, 限制了浮游藻离散三维荧光光谱法的实际应用。 本工作研究了不同生境条件下硅藻和甲藻三维荧光光谱特征, 分析了常见的浓度归一化平均值(以下称平均法)规范光谱库构建方式的局限性, 在此基础上提出了一种基于均匀插值的规范光谱库构建方法。 通过实验分别研究了浮游藻类规范光谱库的最佳插值范围和最优插值数目, 结果表明, M±2 S范围的平均覆盖率达88%, 平均相关系数达0.98, 是光谱库的最优插值的范围。 当插值数目为10条时, 测量准确性比平均法提高了近13%, 运算时间为0.494 8 s, 是兼顾准确性和运算效率的最优插值数目。 基于此, 构建基于均匀插值的硅藻和甲藻类规范光谱库, 结合最小二乘多元线性回归分析, 对实验室配置的浓度已知藻类样品进行三维荧光光谱解析, 并与平均值法解析结果进行比较。 结果表明, 采用均匀插值法构建的规范光谱库, 对5种不同浓度梯度藻样本的测量值与标准叶绿素a浓度之间的相关系数( k值)范围为0.828~1.149, 决定系数( R2)在0.616~0.953之间。 对硅藻门识别失败的样本数量从平均值法的21个显著减少至仅2个, 对硅藻和甲藻的解析相对误差平均值分别为36.9%和30.7%, 较平均值法分别降低了20.6%和19.0%, 表明基于均匀插值的规范光谱库构建方法非常有效地提高了硅藻和甲藻的定量解析精度。 将此建库方式分别扩展至蓝藻、 绿藻和隐藻, 并应用于海水叶绿素原位监测仪(AFA)的南海试验。 本研究为浮游藻类快速准确测量提供了一种有效的技术方法, 也为未来海洋生态监测和环境保护提供了有力的科学支撑。
Phytoplankton are crucial producers in marine ecosystems. The discrete three-dimensional fluorescence spectroscopy method addresses the high operational requirements of continuous three-dimensional fluorescence spectrophotometers, thus meeting the needs for online and in-situ phytoplankton monitoring. However, challenges persist due to the instability of living fluorescence and the similarity in pigment composition among different algal species. This reduces the spectral differentiation between algal groups in discrete three-dimensional fluorescence spectroscopy and limits its practical application. This study investigates the three-dimensional fluorescence spectral characteristics of Bacillariophyta and Dinophyta under various environmental conditions. It analyzes the limitations of the commonly used average concentration-normalized standardized spectral library construction methods (hereinafter referred to as the “average method”). Based on this, a standardized phytoplankton spectral library construction method is proposed using uniform interpolation (hereinafter referred to as the “interpolation method”). The optimal interpolation range and number of interpolations for the phytoplankton standardized spectral library were determined through experiments. The results show that an average coverage rate of 88% and an average correlation coefficient of 0.98 are achieved within the range of M±2 S, which is identified as the optimal interpolation range. With 10 interpolations, measurement accuracy improves by nearly 13% compared to the average method, and the computation time is only 0.494 8 seconds, marking it as the optimal number of interpolations considering both accuracy and computational efficiency. Accordingly, a standardized spectral library for Bacillariophyta and Dinophyta was constructed based on uniform interpolation. Combined with non-negative least squares linear regression analysis, this method was used to interpret the three-dimensional fluorescence spectra of a series of algal samples with known concentrations, and the interpretation results were compared with those obtained using the average method. The results indicated that the interpolation method showed a correlation coefficient ( k value) ranging from 0.828 to 1.149 and a determination coefficient ( R2) ranging from 0.616 to 0.953 for five pure algal samples. The number of Bacillariophyta samples that failed to be identified decreased significantly from 21 (with the average method) to only 2, and the average absolute relative errors in the analysis of Bacillariophyta and Dinophyta were 36.9% and 30.7%, respectively, representing reductions of 20.6% and 19.0% compared to the average method. These results indicate the effectiveness of the uniform interpolation-based method in improving the accuracy of quantitative analysis of Bacillariophyta and Dinophyta. After validating the method's effectiveness in the laboratory, this uniform interpolation-based standardized spectral library construction method was extended to Cyanophyta, Chlorophyta, and Cryptophyta and applied to AFA during a cruise in the South China Sea. This research provides an effective technical method for the rapid and accurate classification and measurement of phytoplankton, offering strong scientific support for future marine ecological monitoring and environmental protection.
浮游藻类是水域生态系统中最重要的初级生产者, 其生物量浓度和群落结构在全球生物链系统中起着至关重要的作用[1]。 目前能实现浮游藻类分类的检测方法主要包括: 分子探针法[2]、 显微镜检法[3]、 基于机器学习的图像识别方法[4]和荧光光谱法。 分子探针法、 显微镜检法和基于机器学习的图像识别方法一般能够在属种层面给予识别分析, 但目前还都不能充分满足现场实时快速监测需要。 荧光法是通过测量活体藻类的指纹荧光光谱来反演不同种类藻类浓度的方法, 具有测量速度快、 无需预处理、 无需破碎细胞等特点, 因而在淡水湖库、 海洋等大面积自然水域浮游藻类现场快速监测方面得到了极大发展[5, 6, 7]。
基于科学研究及行业应用等需求, 国内外已开发了系列活体荧光法藻类测量商品化仪器。 其中, 国外先进藻类荧光分析仪器是基于激发荧光谱方法[8]原理, 能够实现四个光谱藻类群叶绿素的分类定量分析测量, 但无法区分硅甲藻。 随着研究的深入, 基于三维荧光光谱的浮游藻类定量分析方法能够在更细层次上区分浮游藻类, 但存在测量仪器体积大、 功耗高、 耗时长等问题。 离散三维荧光光谱法[9]是根据被分析物的荧光光谱特征, 选择性地测量特定激发波长与发射波长下的荧光信息, 以最优化的结果代替连续三维荧光光谱测量, 解决了连续三维荧光光谱仪运行条件要求高的问题, 从而有效满足浮游藻类的在线与原位监测需求。 然而, 部分门类藻类色素组成上的高度相似性[10, 11]以及活体荧光光谱的不稳定性[12]共同作用导致了离散三维荧光光谱法在减少冗余光谱数据时, 可能会降低不同藻类的光谱组之间的差异, 影响浮游藻类的分类测量精度, 进而影响了浮游藻类叶绿素a浓度的测量精度。 为应对这一挑战, 科研工作者探索了多种方法来降低高相似度光谱对分类测量效果的负面影响。 如苏荣国[13, 14, 15]等研究了不同海洋硅藻和甲藻的特征荧光光谱, 并通过结合主成分分析法(PCA)、 Fisher判别法和Db7小波分析法等, 在一定程度上提高了对单一藻类识别的准确性。 然而, 目前主流的规范光谱库构建方式是以浓度归一化光谱平均值[9, 16]作为该门类藻类的规范光谱, 能够在一定程度上实现不同门类藻类的分类, 但并不能充分表征不同生境条件下的浮游藻类活体荧光不稳定性和光谱特征[17, 18], 是影响浮游藻类叶绿素a浓度准确分类测量的另一个重要误差来源。 构建适用于不同藻类的规范光谱库, 也是克服活体荧光光谱的不稳定性、 实现浮游藻类的精确分类与定量分析的关键途径。
此外, 海洋硅藻和甲藻的准确分类测量对海洋水生态环境监测具有重要意义。 一方面, 硅藻和甲藻是海洋中的优势藻种[19], 海洋多数甲藻在生长代谢的过程中会释放对人类健康有害的贝类生物毒剂[20], 另一方面, 硅藻作为水体富营养化水平的生物指标剂, 在湖泊营养演化指示[21]方面重要性已被古湖沼学研究结果证实。 同时, 硅藻也是生源无定形硅的重要来源, 对水体生物硅的生物地球化学过程[22]、 海洋碳循环[23]等研究至关重要。 但海洋硅藻和甲藻的色素组成较为相似, 其活体荧光光谱特征非常相似, 基于浓度归一化光谱平均值构建规范光谱库的方法在硅甲藻分类方面面临着更大的分类精度难题。
基于此, 本文拟以常见硅藻和甲藻为研究对象, 在获得藻类活体三维荧光光谱的基础上, 分析不同生境条件下硅藻和甲藻的活体三维荧光光谱特征, 研究基于均匀插值法的规范光谱库构建方法, 以期为浮游藻类准确定量和水生态环境监测和保护提供科学方法支撑。
选取我国近海和淡水水域常见硅甲藻藻种为研究对象见表1, 藻种样品分别购于中国科学院淡水藻种库和上海光语生物科技有限公司。 根据规范[25]培养, 培养容器为统一规格的无菌三角细胞培养瓶, 光照3 000~5 000 lux, 温度20~25 ℃, 光暗周期12 h∶ 12 h。
| 表1 实验所用浮游藻类 Table 1 List of experimental planktonic algae samples |
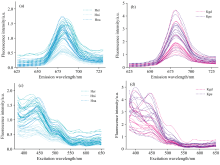
取处于对数增长期实验藻种, 以对应的灭菌培养基稀释接种。 在不同生长期取适量藻类样品母液, 按照一定体积比稀释后以荧光分光光度计(F7000, 日立)测量样品活体三维荧光光谱, 同时参考国家标准方法[26]测量藻类样品的标准叶绿素a浓度。 应用Delaunay三角插值法扣除藻类样品光谱的瑞利散射和拉曼散射。 不同种类硅藻和甲藻活体三维荧光光谱如图1所示。
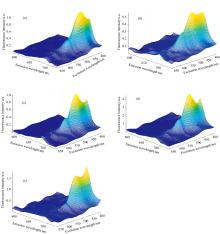 | 图1 不同种类硅甲藻活体三维荧光光谱 (a): Her; (b): Hni; (c): Hna; (d): Kgd; (e): KpeFig.1 Three-dimensional fluorescence spectra of Bacillariophyta and Dinophyte in vivo (a): Her; (b): Hni; (c): Hna; (d): Kgd; (e): Kpe |
图1表明不同种类硅藻和甲藻浮游藻三维荧光光谱具有相似的特征峰范围和双峰结构, 特征荧光峰主要集中在激发波长(λ ex)380~550 nm, 发射波长(λ em)650~700 nm之间。 硅藻门主荧光峰位于450 nm/680 nm附近, 次荧光峰位于380 nm/680 nm附近。 甲藻门藻类虽然具有与硅藻门相似的特征荧光范围和双峰结构, 但甲藻门主特征荧光峰并非总是在450 nm/680 nm附近(Kpe)。 为了进一步研究不同条件硅藻和甲藻的荧光光谱特征及活体荧光不稳定性, 将浮游藻活体三维荧光光谱与采用标准测定方法得到的叶绿素a的浓度相除, 从而获得了在不同生境条件下藻类浓度归一化的三维荧光光谱。 图2分别表示不同生境条件下硅甲藻的激发光谱(测量发射光波长λ em为680 nm)和发射光谱(激发光波长λ ex为450 nm)。
图2表明硅甲藻的浓度归一化荧光光谱特征具有一定的相似的, 但也有差异。 如硅藻门荧光主峰激发波长都在450 nm附近, 而甲藻门荧光主峰激发波长则不稳定, 这些特征与上述三维荧光光谱特征一致, 在此不再赘述。 更重要的是, 除荧光峰的位置偏移外, 不同生境条件下的浓度归一化荧光光谱荧光强度有很大的差异。 如硅藻门浓度归一化光谱荧光强度最大值变化范围0.46~1.75 a.u., 甲藻门变化范围0.94~4.47 a.u., 表明不同生境条件下藻类浓度归一化光谱的荧光最大值有约4.6倍变化。 因而, 传统基于浓度归一化光谱平均值的规范光谱库构建方法可能会在浮游藻浓度测量中引入显著的测量误差。
考虑在特定藻类浓度归一化光谱变化范围内进行一定数目的均匀插值, 扩展若干条均匀分布的三维荧光光谱规范光谱库。 此方法的关键在于对规范光谱库的插值范围及最佳插值数目进行精确研究, 以确保构建的藻类荧光规范光谱库的科学性和实用性。
1.2.1 最佳插值范围研究
研究表明藻种种类、 生长周期等都会导致藻类荧光光谱不稳定性, 不同生境条件对不稳定性的贡献可体现为标准偏差[16], 为了获得合适的规范光谱库插值范围, 本节参考统计学规律, 引入藻类浓度归一化光谱标准偏差的不同倍数, 尝试建立不同差值范围如图3所示。 图中M表示特定门类藻类浓度归一化光谱平均值, S表示特定门类藻类浓度归一化光谱标准偏差。
图3表明浓度归一化光谱的平均值一般都处于特定门类藻类光谱变化范围中心, 在一定程度上表征了该门类浮游藻光谱特征, 但无法体现藻类的荧光不稳定性。 M± S(± 1倍标准偏差变化范围)内包含了一部分浓度归一化实测光谱, 还有大量的实测光谱在范围之外。 M± 2S范围内包含了特定门类藻类的绝大部分的归一化光谱变化区域。 M± 3S范围内虽然包含了所有的藻类的归一化光谱, 但存在明显的范围冗余, 且插值范围的上下限的形变严重, 这种情况很可能会在浮游藻荧光光谱解析时引入新的解析误差。 为了精确研究的规范光谱库最佳插值范围, 定义参数光谱范围覆盖率C和相关系数ρ 来比较不同倍数标准偏差插值范围的优劣。
$\rho=\frac{\sum_{i=1}^{ \ n} \ \left(x_{i}-\bar{x}\right)\left(y_{i}-\bar{y}\right) \ }{\sqrt{\sum_{i=1}^{ \ n}\left(x_{i}-\bar{x}\right)^{ \ 2} \sum_{i=1}^{ \ n} \ \left(y_{i}-\bar{y}\right)^{2}}}$(2)
覆盖率C表示特定门类藻类浓度归一化光谱完全处于给定上下限范围内的光谱条数CN与总光谱条数N的比例。 比值C越接近1, 表明给定上下限范围的光谱覆盖率越高。 ρ 表示给定插值范围上下限与均值谱M的Spearman系数的均值, ρ 值越接近1, 说明上下限与均值相关性越高, 插值光谱的形变程度越低; ρ 值越接近0, 表明给定插值范围的上下限形变越严重, 对藻类光谱的准确解析越不利。 计算得到特定门类藻类在给定不同插值上下限范围内覆盖率C和相关系数ρ 值如表2所示。
| 表2 硅藻和甲藻不同插值范围的覆盖率和相关性参数值 Table 2 Coverage and correlation values for different interpolation ranges of bacillariophyta and dinophyta |
表2表明相较于M± S, M± 2S范围内硅藻和甲藻的覆盖率C提升至约88%, 提升了约60%; 相较于M± 2S, M± 3S范围覆盖率提升了2%~10%, 但相关系数ρ 却由约0.98下降至约0.6左右。 表明扩大插值光谱范围可显著提高光谱覆盖率, 但过宽的插值范围又可能会造成插值光谱的明显形变。 综合来看, M± 2S范围的平均覆盖率达88%, 平均相关系数达0.98, 能够非常好地兼顾给定门类藻类活体荧光光谱的相似性和不稳定性特征, 是规范光谱库的最优插值的范围。
1.2.2 最佳插值数研究
将实验获得的已知浓度的硅藻和甲藻三维荧光光谱随机分为两个集合, 其中70%作为不同门类藻类的光谱插值范围训练集, 30%作为测试集。 在M± 2S范围内分别以插值数1(浓度归一化光谱均值, 以下简称平均法)、 5、 10、 20、 30、 40、 50和60进行均匀插值。 结合非负加权最小二乘多元线性回归分析方法, 输出插值光谱库遍历结果中的残差最小解析结果。 分别以解析结果与样本标准叶绿素a浓度之间的相对误差的绝对值(absolute value of relative error, ABE)和光谱解析平均运算时间为评价依据, 研究M± 2S范围内规范光谱库的最佳插值数目。 不同插值数目条件下, 测试集17个样本解析结果如表3所示。
| 表3 不同插值数条件下测试集样本浓度解析结果对比 Table 3 Comparison of analysis results for test samples under different interpolation numbers |
表3表明, 当采用平均法规范光谱库对测试集样本进行解析时, 测量误差较小(平均ARE小于30%)的样本数量仅为6个。 当插值数分别增加至5和10时, 这个数量分别提升至10和11个。 进一步增加插值数量至20、 30、 40和50条时, 测量误差较小样本数量并未继续增加。 值得注意的是, 当插值数量增至60条时, 测量误差较小的样本数量反而下降至10个。 这个结果表明, 在插值范围内, 插值数量的增加并非总能带来更优的分析结果。
鉴于当待分析浮游藻的门类数量增加时, 解析计算量会随插值数的增大而级数级增加。 因此, 在确保分析结果准确性的同时, 还需兼顾计算效率。 不同插值数量下, 测试集实验样本解析结果的平均相对误差和运算时间如图4所示。
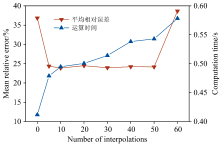 | 图4 不同插值数条件下样本平均相对误差与运算时间比较Fig.4 The average accuracy and computation time for various interpolation values |
图4表明, 当采用平均法规范光谱库对测试集样本进行解析时, 解析结果的平均ARE为36.8%。 当增加插值数量至5和10条光谱时, ARE分别下降至24.4%和23.9%, 测量结果的准确性提高了约13%。 当插值数量增至20、 30、 40和50条时, ARE继续降低趋势不明显。 但进一步增加插值数至60条时, ARE反而升高至38.65%。 就运算效率而言, 平均法的运算时间最短, 仅需0.411 8 s。 插值数量为5和10时, 运算时间分别增至0.478 8和0.494 8 s。 此后随着插值数目的增加至60条, 运算时间近似均匀地增加至0.578 2 s。 本研究认为, 综合考虑解析准确性和运算效率, 在插值范围内均匀插值10条光谱为规范光谱库构建的最优插值方案。
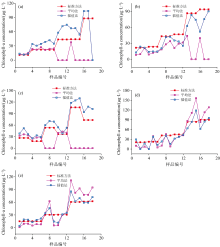
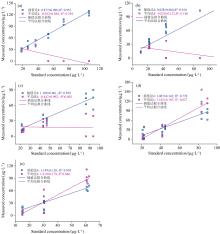
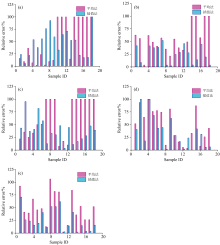
为了进一步验证基于均匀插值的规范光谱库构建方法(以下简称: 插值法)的有效性, 以实验室培养的硅藻和甲藻按照一定体积比稀释, 分别配置为一系列浓度已知的藻类样品, 采用荧光分光光度计测量样品荧光光谱, 每个样本测量3次。 根据上述分别构建硅藻门和甲藻门均匀插值光谱库, 结合光谱解析方法对90个藻类光谱进行解析, 并将解析结果与国家标准方法测量结果和平均法的解析结果进行对比, 结果如图5和图6所示。
图5表明, 与平均法解析结果相比, 插值法对测试样品集藻类的解析结果与标准浓度之间具有更一致的变化趋势。 图6相关性分析结果表明, 采用均匀构建的规范光谱库, 对5种纯种藻样本的叶绿素a浓度测量值与标准浓度之间的相关系数k值范围为0.828~1.149, 决定系数R2在0.616~0.953之间。 而采用平均法构建的规范光谱库, 其对样本浓度的测量值与标准浓度之间的相关系数k值范围为-0.447~1.819, R2在0.002~0.866之间。 对比可知, 均匀插值法对样本解析结果与标准浓度之间的相关性分析k值和R2都更接近于1。 表明相较于主流的平均法, 基于均匀插值的浮游藻规范光谱库构建方法能更准确、 更稳定地反演样本叶绿素a浓度。
图7表明, 从统计角度来看, 无论是硅藻还是甲藻, 插值法对藻类样本的测量误差均显著低于平均法的解析结果。 例如, 插值法对硅藻门样本的误识别(相对误差100%, 种类识别错误)个数由平均法的21个显著减少至仅2个, 识别准确率得到了显著提高。 插值法对硅藻和甲藻的解析相对误差平均值分别为36.9%和30.7%, 较平均法分别降低了20.6%和19.0%, 测量准确性也得到了显著提升。 表明基于均匀插值的浮游藻规范光谱库构建方法能够非常有效地提高浮游藻类的定量解析精度。
在实验室验证了基于均匀插值的规范光谱库构建方法有效性的基础上, 将该方法分别扩展至蓝藻门、 绿藻门和隐藻门, 并应用于由中国科学院安徽光学精密机械研究所研制的海水叶绿素原位监测仪(AFA)[9]中。 在2023年9月9日至9月26日期间, 搭载中国科学院南海海洋研究所发起的2023年秋季共享综合航次, 在南海南沙群岛岛礁附近海域进行了连续走航试验, 试验由“ 实验三号” 科考船完成, 航行轨迹及现场测试图片如图8所示。
本次外场试验同时按照国家标准方法采集并保存实验样本共63个, 带回实验室后测量样品的标准叶绿素a浓度。 得到样本有效对比数据如图9所示。 根据统计原理, 叶绿素a浓度测量值与标准方法测量值之间的误差服从或近似正态分布, 构建双边统计量: $t=\left|\sqrt{n}\left(\bar{x}-\mu_{0}\right) / s\right|$, 则t~t(n-1)。 其中: $\bar{x}$为叶绿素a浓度测量值与标准浓度之间的误差; μ0=0是误差的理想均值; s为样本标准偏差; n为样本容量。
 | 图9 叶绿素a浓度测量结果对比及误差分布Fig.9 Comparison of chlorophyll a concentration measurements and error distribution |
图9表明叶绿素a 浓度测量值与标准浓度之间误差均值为-0.007 5 μ g· L-1, 标准偏差 $\bar{x}$为0.699 4 μ g· L-1。 在显著性水平α =0.05时, 双边统计量t的数值为0.084 7< 1.999=t0.05/2(62)。 因此t检验结果表明, 仪器叶绿素a浓度测量值与样本标准浓度之间不存在显著性差异(α =0.05)。
获取南海海洋浮游藻类叶绿素a浓度和群落结构走航监测结果如图10示。
 | 图10 海洋浮游藻类在线监测结果 (a): 叶绿素a浓度; (b): 群落结构Fig.10 Online monitoring results of marine phytoplankton in south China sea (a): Chlorophyll a concentration; (b): Community structure |
图10中表明, 在9月11日— 23日期间, 航行路线集中在远海区域, 测得叶绿素浓度在0.01~4.90 μ g· L-1范围内波动, 平均值为0.37 μ g· L-1。 9月9日— 11日和9月23日— 26日期间, 航行路线集中在近海区域, 叶绿素浓度整体偏高, 变化范围为0.96~20.77 μ g· L-1, 平均叶绿素浓度为4.31 μ g· L-1。 在9月10日— 11日近海区域藻类群落以硅藻, 甲藻和蓝藻为主, 绿藻和隐藻也有少量检出。 在9月25日— 26日返航的近海区域主要以甲藻, 硅藻和绿藻为主, 与出航时的群落结构大致相似。 在9月12日— 23日的远海航行区域内以甲藻和隐藻为优势藻种, 其他门类藻种均有检出。
根据航行轨迹, 分别选择9月20日以及9月25日的走航数据进行近海与远海海域叶绿素浓度及藻类群落分布对比。 图中表明, 在航行一天内, 近海海域的叶绿素浓度在1.43~13.69 μ g· L-1范围内波动, 平均浓度达5.11 μ g· L-1, 其中9:00— 15:00时段叶绿素浓度较高。 远海海域叶绿素浓度一天内相对稳定, 在0.11~0.34 μ g· L-1范围内变化, 均值0.20 μ g· L-1, 明显低于近海海域的叶绿素浓度。 近海远海海域均以甲藻和绿藻为优势藻种, 其他门类藻类也有少量检出。
提出了一种基于均匀插值的浮游藻类规范光谱库构建方法, 该方法对于具有高相似性和活体荧光不稳定性的硅藻和甲藻等藻类的测量精度有显著提升。 在实验室验证了方法有效性的基础上, 进一步将该方法扩展至蓝藻、 绿藻和隐藻门, 并应用于中国南海实际海洋水环境的监测中。 此项研究不仅为浮游藻类叶绿素及群落结构的快速评估提供了一种有效的技术方法, 也为未来的海洋水生态环境监测和建设提供了基础。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|