作者简介: 姜 恒, 1998年生,哈尔滨医科大学公共卫生学院硕士研究生 e-mail: jiang0622hrb@163.com;吕紫薇,女, 1998年生,哈尔滨医科大学公共卫生学院硕士研究生 e-mail: lvziwei163@163.com;姜 恒,吕紫薇:并列第一作者
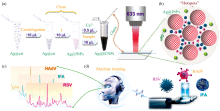
快速准确地检测引发急性呼吸道感染(ARI)的常见病毒, 对于公共卫生防控至关重要。 尽管传统的病毒检测方法在一定程度上满足了临床需求, 但其往往存在耗时较长、 成本较高或灵敏度有限等局限性, 亟需更为快速和高效的检测手段。 表面增强拉曼光谱(SERS)技术因其高灵敏度和特异性, 逐渐成为病毒检测领域的研究热点。 研究旨在开发一种结合SERS技术与机器学习方法的新型高效检测策略, 以实现对呼吸道合胞病毒(RSV)、 甲型流感病毒(IFA)和人腺病毒(HAdV)的精准检测。 采用柠檬酸盐制备银纳米颗粒(Ag@cit), 将碘离子孵育和钙离子聚集的银纳米颗粒(Ag@ICNPs)作为SERS基底。 Ag@ICNPs具有适合病毒检测的优质“热点”, 能够超快速、 高灵敏、 无标记地捕获呼吸道病毒的特征指纹图谱。 为了进一步提高检测的效率和准确性, 将机器学习方法引入到SERS技术中, 通过对多种机器学习算法的改进, 成功建立了病毒分类器, 能够在3 min内对检测限低至1.0×102 copies·mL-1的三种病毒进行快速鉴定, 且准确率高达100%。 此外, 利用病毒浓度与特征峰强度间关系所构建的浓度依赖性曲线, 具有良好的线性关系( R2均大于0.998), 为量化样本中病毒含量提供了可能性, 这对于临床通过病毒负荷的变化监测治疗效果和病情进展具有重要意义。 该研究揭示了“SERS@机器学习”联合应用在呼吸道病毒快速精准检测中的显著优势, 并为ARI临床诊断提供了一种具有潜在应用价值的新途径, 有望在未来成为临床诊断和公共卫生防控中的重要工具。
Author: JIANG Heng and LÜ Zi-wei: joint first authors
Rapid and accurate detection of common viruses causing acute respiratory infections (ARI) is crucial for public health prevention and control. Although traditional viral detection methods have partially met clinical needs, they often have limitations such as long detection times, high costs, or limited sensitivity. There is an urgent need for faster and more efficient detection methods. Surface-Enhanced Raman Spectroscopy (SERS) has become a research hotspot in viral detection due to its high sensitivity and specificity. This study aims to develop a novel and efficient detection strategy combining SERS technology with machine learning methods to achieve precise detection of Respiratory Syncytial Virus (RSV), Influenza A Virus (IFA), and Human Adenovirus (HAdV). The study employs citrate-stabilized silver nanoparticles (Ag@cit) and uses iodine ion incubation and calcium ion aggregation to prepare silver nanoparticles (Ag@ICNPs) as the SERS substrate. Ag@ICNPs have high-quality “hotspots” suitable for virus detection, enabling ultra-fast, highly sensitive, and label-free capture of characteristic fingerprint spectra of respiratory viruses. This study integrates machine learning methods with SERS technology to further improve detection efficiency and accuracy. By improving various machine learning algorithms, a virus classifier was successfully established, which can rapidly identify the three viruses within 3 minutes with a detection limit as low as 1.0×102 copies·mL-1and an accuracy rate of 100%. Additionally, the concentration-dependent curves constructed based on the relationship between viral concentration and characteristic peak intensity showed good linearity ( R2 greater than 0.998), providing the possibility for quantifying virus content in samples. This is important for monitoring treatment efficacy and disease progression through changes in viral load in clinical settings. This study reveals the significant advantages of the combined application of “SERS@machine learning” in rapidly and precisely detecting respiratory viruses, offering a potentially valuable new approach for ARI clinical diagnosis. It is expected to become an important tool in future clinical diagnosis and public health prevention and control.
急性呼吸道感染(acute respiratory infections, ARI)是全球范围内的重大公共卫生问题, 对儿童、 老年人和免疫功能低下者尤具威胁[1]。 ARI不仅直接导致较高的病死率, 还可能引发急性呼吸窘迫综合征、 脑膜炎和心肌炎等严重并发症。 在众多致病病原体中, 呼吸道合胞病毒(respiratory syncytial virus, RSV)、 甲型流感病毒(influenza A virus, IFA)和人腺病毒(human adenovirus, HAdV)是最常见且具有代表性的三种病毒[1]。 RSV常引起婴幼儿支气管炎和肺炎, 并易与其他呼吸道病毒共同感染[2]。 IFA是全年龄段ARI的主要病原体, 其高变异性增加了防控难度, 使疫苗的有效性面临挑战[3]。 HAdV可引发从普通感冒到严重肺炎甚至多器官衰竭的症状, 多数感染病例为儿童患者, 但成人中的群体性爆发事件亦时有发生, 特别是在军队和学校等集体环境中[4]。
传统的呼吸道病毒检测方法包括病毒培养、 核酸检测、 抗原检测和抗体检测。 病毒培养是检测活性复制病毒和评估其感染潜力的“ 金标准” , 但该方法操作复杂且耗时[5]。 核酸检测方法主要有实时荧光定量PCR(qPCR)、 逆转录PCR(RT-PCR)、 数字PCR(dPCR)和下一代测序(NGS)等。 Abdel-Moneim等[6]基于RSV的F基因开发了一种新的qPCR检测方法, 能在临床样本中对RSV进行高度灵敏和特异性检测, 检出限低至1.0× 102 copies· mL-1。 然而, qPCR方法对特定病毒的引物和探针要求严格, 对未知病毒或变异病毒的敏感性有限。 RT-PCR在检测RNA病毒中具有极高的灵敏度和特异性, 尤其适用于如RSV、 IFA、 人冠状病毒(human coronaviruses, HCoV, 如SARS-CoV-2)和人偏肺病毒(human metapneumovirus, HMPV)等病毒的检测。 但其逆转录步骤使操作过程较为复杂, 同时高灵敏度特性也使其易受实验环境中核酸的污染[7]。 Chen等[8]开发的多重dPCR方法能够高灵敏度地检测五种呼吸道病原体且无交叉反应, 但其设备和试剂成本较高。 NGS可以同时检测和鉴定多种已知和未知病毒, 但其复杂数据分析和较长检测时间限制了其在常规检测中的应用[9]。 抗原检测简便快速, 但灵敏度和特异性相对较低, 可能导致假阴性或假阳性结果[10]。 抗体检测受时间滞后性限制, 无法实现即时检测[11]。 传统方法在ARI的快速诊断和大范围筛查中存在一定的局限性, 亟需一种兼具操作简单、 即时性和高灵敏度的新型检测技术。
表面增强拉曼光谱(surface-enhanced Raman spectroscopy, SERS)在呼吸道病毒检测中展现出显著优势[12]。 首先, SERS基于电磁和化学增强机制[13], 可显著提升病毒分子的拉曼散射信号, 甚至达到单分子检测水平, 这对于早期检测和低病毒载量感染的识别尤为关键。 其次, SERS根据每种病毒独特的蛋白质和核酸结构生成的“ 指纹” 光谱, 其高特异性使得SERS在复杂临床样本中也能有效区分和诊断多病原体感染[14]。 此外, SERS检测流程简便快速, 可在几分钟内获得结果, 这对于流感爆发或新型呼吸道病毒的紧急筛查具有重要应用价值。 然而, SERS检测产生的数据高维且复杂, 人工分析效率低且易出错。 因此, 机器学习成为关键方法, 其强大的数据处理和预测能力可以从复杂数据中识别病毒特征, 降低人工成本并显著提高检测准确性和可靠性[15]。
针对传统病毒检测方法的技术瓶颈, 我们创新性地将SERS技术与机器学习相结合, 试图建立一种高效的呼吸道病毒检测方法。 采用柠檬酸钠还原银纳米颗粒, 并利用钙离子作为聚集剂, 形成高质量的检测热点。 该方法预期在3 min内, 于最低检测限(1.0× 102 copies· mL-1)下精准识别不同类型的呼吸道病毒, 从而促进高通量病毒检测体系的构建与完善。 本方法不仅有助于提高临床诊断的效率与准确性, 还为疾病的预防与控制提供了有力的工具。
甲醛灭活的RSV、 IFA和HAdV保存于哈尔滨医科大学公共卫生学院卫生微生物学实验室。 样品于-80 ℃保存, 其中RSV的分装浓度为1.3× 104 copies· mL-1, IFA为2.0× 104 copies· mL-1, HAdV为1.5× 104 copies· mL-1。
实验过程如图1所示。 将12 mL 1%浓度的柠檬酸钠溶液加入400 mL硝酸银溶液(0.17 mg· mL-1)中, 利用恒温磁力搅拌器在97 ℃下制备银纳米颗粒(Ag@cit)。 再取5 mL Ag@cit(6 500 r· min-1, 20 min, 20 ℃)离心, 去除上清液后, 制备碘离子(1 mmol· L-1)孵育的银纳米颗粒(Ag@INPs)。 然后, 在混合物中加入钙离子(0.01MCaCl2· 2H2O)制备SERS基底(Ag@ICNPs)。
充分混匀Ag@ICNPs与样品溶液后进行SERS检测, 所用仪器是WITec Alpha 300 RA(Ulm, 德国), 激光波长为633 nm, 扫描时间为20 s, 激光功率为25 mW, 累计检测次数为1次。
在相同浓度(1.0× 103 copies· mL-1)下, 通过多次独立制备和检测, 获得了每种呼吸道病毒的1 000组SERS光谱。 为确保数据的多样性和代表性, 在不同的实验批次、 不同的光谱采集条件(激光功率, 扫描时间)下进行数据采集。 采用LabSpec 6对所有光谱进行基线校正和标准化, 每组1 500拉曼位移(300~1 800 cm-1)作为机器学习的变量。 机器学习LDA、 NB、 Tree、 KNN、 SVM、 RF、 CNN分别使用R语言中的“ MASS” 、 “ klaR” 、 “ rpart” 、 “ kknn” 、 “ e1071” 、 “ randomForest” 、 “ torch” 包完成。
无标记SERS检测无需使用特异性抗体或序列标签, 同时具有灵敏性和信号稳定性。 然而, 在病毒检测中, 该技术仍需解决由于“ 热点” 与病毒大小差异导致的信号捕获困难和普适性差的问题[12, 16]。 本研究通过修饰银纳米颗粒以形成高质量检测“ 热点” 来应对这些挑战。 在图2(a)中, 橙色线显示了RSV在1.0× 103 copies· mL-1浓度下的拉曼光谱, 未能捕获病毒信号; 蓝色线则显示了添加Ag@INPs后的SERS光谱, 虽然有病毒信号, 但信噪比差, 难以区分RSV信号与杂质信号。 为了获得高质量的病毒信号, 本研究将钙离子作为聚集剂, 加入到Ag@INPs中形成Ag@ICNPs进行SERS检测。 钙离子通过与柠檬酸盐形成稳定络合物, 使柠檬酸盐从银纳米颗粒表面脱离, 从而降低柠檬酸盐的SERS信号对病毒检测的干扰。 此外, 钙离子的正电荷能够诱导银纳米粒子聚集, 形成适合于病毒检测的高质量“ 热点” , 增强待测病毒分子的信号。 图2(a)中的粉色线展示了以Ag@ICNPs为增强基底获得的RSV SERS图谱, 与不加钙离子聚集剂相比, 病毒的信号增强较为明显, 杂峰较少, 信噪比显著提高。 对于IFA和HAdV, 我们采用相同的方法观察了其SERS特征图[图2(b, c)]。
增强基底的表征如图3所示。 相同尺度下Ag@INPs和Ag@ICNPs的扫描电子显微镜(scanning electron microscopy, SEM)图像显示, Ag@INPs在系统中均匀分布, 加入钙离子后的Ag@ICNPs明显聚集。 动态光散射(dynamic light scattering, DLS)结果表明, Ag@INPs与Ag@ICNPs的平均粒径分别为27.6和59.2 nm, 与SEM结果一致。 通过zeta电位测量, 观察到银纳米颗粒的zeta电位从-32.2 mV变为-22.9 mV, 这是由于带负电荷的银纳米颗粒与带正电荷的钙离子相互吸引从而中和了表面电荷, 电位有所下降但是依然保持良好的稳定性。
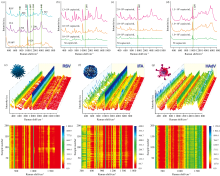
运用当前方法成功捕获了RSV、 IFA和HAdV病毒颗粒的指纹图谱, 从图4(a)可以看出, 光谱中蛋白质结构(1 002 cm-1)和核酸结构(746、 799 cm-1)的信号峰明显, 具体峰位归属如表1所示。 RSV与IFA的SERS图谱在各峰位上相似, 但峰强度差异显著, 而HAdV的图谱与前两者差异明显。 这可能源于其结构差异。 RSV和IFA作为RNA病毒, 具有相似的糖蛋白和脂质双层结构, 导致其SERS光谱相似; 而HAdV是DNA病毒, 缺乏脂质包膜, 主要由蛋白质衣壳构成, 表面结构显著不同。 这些结构差异影响了病毒在SERS基底上的吸附状态和光谱特征, 进而导致SERS图谱的明显差异。
| 表1 病毒SERS光谱的峰位归属 Table 1 Assignment of peaks in the viral SERS spectra |
图4(b、 c、 d)分别展示了RSV、 IFA和HAdV的浓度依赖性SERS光谱。 即使检测浓度低至1.0× 102 copies· mL-1, RSV、 IFA和HAdV分别在1 097、 1 002和1 029 cm-1处的特征峰依旧明显(S/N> 3), 因此本方法的检测限低于1.0× 102 copies· mL-1。 这一结果表明, 本方法具有较高的灵敏度, 与被称为金标准的实时荧光定量PCR方法的灵敏度水平相当[17]。 图4(e、 f、 g)分别为利用不同批次制备的病毒样品及增强基底捕获的RSV、 IFA和HAdV的200组随机SERS图谱和色彩编码强度图, 结果显示RSV、 IFA和HAdV的SERS特征峰强度的相对标准偏差(RSD)值分别为1.00%、 0.53%、 0.64%。 为了进一步评估本方法在病毒检测中的一致性, 利用色彩编码强度图对每种病毒的200组光谱数据进行可视化处理。 从色彩编码强度图中可以清晰地看到, 绝大多数检测点的颜色变化较小, 检测结果表现出高度一致的光谱特征, 表明本方法在不同的病毒检测中都具有显著的重现性和稳定性。 此外, 色彩编码强度图中局部微弱的颜色变化可能反映了实验过程中的微小波动, 但并未对整体趋势产生显著影响, 进一步支持了本方法的一致性。
采用乙腈(acetonitrile, ACN)作为内标, 分析了三种病毒的浓度与SERS峰强度的线性关系。 图5(a、 b和c)分别为RSV、 IFA以及HAdV的浓度依赖性SERS图谱。 利用ACN在924 cm-1处的特征峰进行归一化, 评估病毒浓度变化对病毒在特征峰位处(1 002 cm-1)峰值强度的影响。 结果表明, 随着浓度升高, 特征峰值强度呈上升趋势, RSV[图5(d)]、 IFA[图5(e)]以及HAdV[图5(f)]的浓度均与SERS光谱强度呈良好的正相关关系, 证明了本方法在病毒定量鉴定中的可靠性和稳定性。 该方法在其他呼吸道病毒的定量分析中也显示出广阔的临床应用前景。
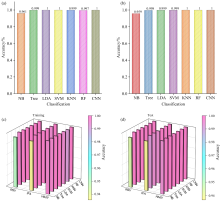
传统分析方法由于样本复杂性和数据噪声, 可能难以区分高相似度的SERS光谱。 机器学习方法能够处理高维数据, 自动提取和选择关键特征, 发现数据中隐藏的微小差异, 有助于实现呼吸道病毒的高精度鉴别和高通量检测。 将SERS与机器学习方法相结合, 对三种病毒进行精准分类和预测。 在1.0× 103 copies· mL-1的浓度条件下, 获得每种病毒1 000组SERS光谱, 并将数据随机分为训练集和测试集(7∶ 3)。 研究了朴素贝叶斯(NB)、 决策树(Tree)、 线性判别分析(LDA)、 支持向量机(SVM)、 k近邻(KNN)、 随机森林(RF)和卷积神经网络(CNN)七种机器学习方法, 比较了其对三种病毒的识别效果。 除NB算法外, 其余六种算法在训练集和测试集上的准确率均超过99%[图6(a, b)]。 此外, CNN凭借其复杂的卷积和池化过程, 在训练集和测试集中鉴定三种病毒的准确率均高达100%[图6(c, d)]。 综上所述, “ SERS@机器学习” 技术能够高效准确地区分和预测三种病毒。
基于SERS技术与机器学习方法, 提出了一种用于ARI病毒检测的新策略。 该策略创新性地将钙离子作为聚集剂引入SERS检测体系。 钙离子通过与柠檬酸盐形成稳定络合物, 既减少了杂质信号干扰, 又因其正电性诱导银纳米颗粒聚集, 形成适合病毒检测的“ 热点” , 显著增强病毒分子的SERS信号, 从而能够超快速、 高灵敏、 无标记地捕获到RSV、 IFA以及HAdV的特征指纹图谱。 研究采用乙腈作为内标, 证实了病毒浓度与SERS光谱的线性关系, 并验证了检测方法的稳定性。 此外, 该方法具有以下优势: (1)可在3 min内检测浓度低至1.0× 102 copies· mL-1的病毒, 灵敏度与PCR方法接近, 但检测时间更短; (2)病毒浓度与特征峰强度间具有良好的线性关系, 显示出在三种呼吸道病毒乃至更多病毒种类的定量检测中的巨大潜力; (3)引入机器学习显著提升了SERS光谱数据的解析和分类能力, 对三种病毒的鉴别准确率达到了100%。 此外, 机器学习的自适应优化和持续改进不仅增强了检测的精度和鲁棒性, 还能适应病毒变异和不同类型的临床样本, 从而提高了系统的长期稳定性和可扩展性。
综上所述, 本方法显著提升了呼吸道病毒检测的精度、 速度和可靠性, 有助于快速识别和隔离感染者, 遏制病毒传播。 同时, 准确的检测结果还能帮助医生制定针对性治疗方案, 从而提高整体治疗效果。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|