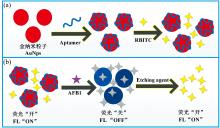
作者简介: 朱明明, 1981年生, 郑州海关技术中心硕士研究生 e-mail: zhumingming@customs.gov.cn
食源性感染可能会引起新疾病产生和原有传染病再次出现, 是发达国家和发展中国家疾病和死亡的主要原因之一, 严重影响人类的公共卫生安全。 黄曲霉毒素B1(Aflatoxin B1, AFB1)是食源性霉菌毒素中毒性最大的一种, 它可能通过受污染的谷类食品对人体和动物健康造成严重危害。 AFB1在食品中的普遍污染, 加之人们对食品安全的日益重视, 决定AFB1快速准确的检测方法发展具有越来越重要的意义。 光学生物传感器将生物特异性识别元件和生物材料组合起来, 将生物反应转化为可测量的信号, 由于检测快速、 灵敏度高、 前处理简单等优点, 光学生物传感器在生物检测传感领域有着广阔应用前景。 本文利用金纳米球粒子(AuNPs)的局域表面等离子共振(LSPR)特性和荧光抑制性, 构建以适配体(Aptamer, Apt)保护的金纳米粒子为信号探针的LSPR/荧光双信号输出适配体传感器, 用于AFB1的定量检测。 Apt保护的AuNPs在荧光分子罗丹明异硫氰酸酯(RBITC)存在的情况下分散良好, 金纳米粒子的LSPR性能稳定, 且RBITC荧光强度明显; 由于AFB1与Apt之间的特异性, 在目标物AFB1竞争作用下, AuNPs失去Apt保护, 迅速被阳离子溶液RBITC分子吸附, 造成金纳米粒子团聚, 溶液颜色和LSPR性能发生改变, 且RBITC分子的荧光基团在金纳米粒子作用下发生荧光猝灭; 随后, 在铁氰化钾(K3[Fe(CN)6])和碘化钾(KI)组成的刻蚀剂溶液作用下, 金纳米粒子被氧化刻蚀消失, RBITC分子从金纳米粒子上脱落, 荧光性能得到恢复, 由此建立AFB1浓度与AuNPs的LSPR性能改变前后吸光度比值及RBITC分子荧光强度之间的定量关系。 构建的双信号输出适配体传感器能够在0.000 1~1 ng·mL-1浓度范围内实现AFB1的定量检测, 在真实样品检测中, LSPR实验回收率可达95.6%~105%, 荧光光谱检测回收率为92.3%~118%。 本文将纳米技术、 生物技术、 适配体技术、 霉菌毒素检测技术结合起来构建的基于LSPR/荧光双信号适配体传感器是一种很有潜力且有望用于AFB1现场快速检测的技术。
Foodborne infections pose a substantial hazard to public health worldwide because they play a significant role in establishing and reemerging infectious illnesses. Aflatoxin B1 (AFB1) is a very toxic mycotoxin mainly present in contaminated cereal and poses a risk to human and animal health. With the widespread contamination of AFB1 in food and people's increasing attention to food safety, a quick, accurate, and trustworthy technique for detecting AFB1 in food products is desperately needed. Optical biosensors combine biological-specific recognition elements and biological materials to convert biological reactions into measurable signals. Due to the advantages of fast detection, high sensitivity, and simple pre-processing, optical biosensors have broad application prospects in biological detection sensing. Therefore, in this work, we designed a dual-signal output aptamer sensor for quantitatively detecting AFB1 based on the fluorescence quenching capabilities of gold nanoparticles (AuNPs) and Localized Surface Plasmon Resonance (LSPR). The sensor design used auNPs shielded by AFB1-specific aptamers as signal probes. The competitive binding of AFB1 was subjected to cause the aptamers to separate from the AuNPs, allowing the exposed AuNPs to adsorb Rhodamine B Isothiocyanate (RBITC) quickly. Furthermore, the AuNPs aggregation and quenching of the fluorescence of RBITC were exploited to measure the optical index. The fluorescence of RBITC was restored by further oxidation and etching of the AuNPs using potassium ferricyanide (K[Fe(CN)6]) and potassium iodide (KI) solution, allowing for precise quantification of AFB1. The results revealed high precision as the developed sensor exhibited a wide detection range for AFB1, ranging from 0.000 1 to 1 ng·mL-1. During actual sample testing, recovery rates from the LSPR-based approach ranged from 95.6% to 105%, whereas recovery rates from fluorescence-based detection were between 92.3% and 118%. Using this novel approach for mycotoxin detection, the LSPR/fluorescence dual-signal aptamer sensor holds tremendous potential for the quick and on-site detection of AFB1, providing a useful instrument to improve food safety.
黄曲霉毒素B1(Aflatoxin B1, AFB1)是由黄曲霉菌产生的能够对动物肝脏产生巨大损伤的有毒物质, 广泛存在于人类赖以生存的各类粮食和坚果中[1, 2]。 AFB1中毒没有良好解毒药, 且具有致癌性, 包括肝癌、 雌激素问题、 免疫力下降和肾脏问题, 对人类生命安全产生巨大威胁, 因此AFB1被国际研究机构归类为I类致癌物[3, 4, 5]。 根据联合国粮食及农业组织(Food and Agriculture Organization of the United Nations, FAO)的数据, 全球估计有25%的谷物被AFB1污染[6]。 然而, 这一数字可能被大大低估, 据报道, 由于分析技术的灵敏度提高和气候变化的影响, 全球谷物被AFB1污染的真实值有可能约为60%~80%[7]。 食品和饲料快速警报系统(rapid alert system for food and feed, RASFF)也报告说, AFB1对粮食影响的直接结果是每年损失约10亿吨食品和饲料产品, 这些有毒的粮食和饲料最终对人类和动物健康产生有害影响。 迄今为止, 各种分析技术已用于AFB1的检测, 如高效液相色谱法(high performance liquid, HPLC)、 气相色谱/质谱(gas chromatography/mass spectrometry, GC/MS)、 薄层色谱法(thin layer chromatography, TLC)、 酶联免疫吸附法(enzyme linked immunosorbent assay, ELISA)等[8, 9, 10]。 虽然这些方法足够准确, 但它们存在样品预处理繁琐、 检测成本高、 试剂消耗大、 对专业操作人员要求高等缺点[11]。 因此, 有必要开发出简单、 高灵敏度的食品样品中AFB1微量检测方法。
生物传感技术将生物特异性识别元件和生物材料组合起来, 将生物反应转化为可测量的信号。 与常规检测方法相比, 荧光检测法是一种很有前景的生物传感技术, 它具有高灵敏度、 样品预处理简单和无损检测等优点, 因此荧光检测法在生物检测领域应用非常广泛[12]。 荧光检测法结合其他光学方法如局域表面等离子共振(local surface plasmon resonance, LSPR)形成的双信号输出法, 两种输出结果相互验证, 检测结果更加有说服力[13]。 如Adegoke等报道了利用ZnSSe合金量子点(QDs)金纳米颗粒(AuNP)纳米杂化物的等离子体金属增强荧光技术, 构建唾液溶菌酶适配体荧光生物传感器平台, 利用适配体和目标物溶菌酶之间相互结合作用, 诱导金纳米球粒子(Au nanosphere particles, AuNPs)局部表面等离子体共振(LSPR) 效应, 放大溶菌酶识别QD的荧光信号。 该生物传感平台以唾液溶菌酶作为分析物, 实现人类唾液的真实检测[14]。
本文合成了金纳米粒子, 在金纳米粒子上修饰AFB1适配体构建信号探针, 利用AFB1与适配体之间的特异性及金纳米粒子对荧光信号分子异硫氰酸酯(Rhodamine Isothiocyanate, RBITC)的荧光抑制性, 构建LSPR/荧光双信号输出的适配体传感器用于黄曲霉毒素AFB1的定量检测[15]。 本文的研究可为食品样品中其他毒素和污染物的检测研究奠定了理论和实验基础。
氯金酸(AuCl3· HCl· 4H2O), 柠檬酸三钠(C6H5Na3O7· 2H2O), 罗丹明异硫氰酸酯(Rhodamine B Isothiocyanate, RBITC)购买于Sigma-Aldrich (USA), 分析纯。 铁氰化钾(Potassium ferricyanide, K3FeC6N6, AR, ≧ 99.5%), 碘化钾(Potassium iodide, KI, AR, ≧ 99%)购买于上海麦克林生物化学有限公司(中国, 上海)。 金纳米粒子合成实验之前使用王水浸泡玻璃器皿及搅拌子, 使用1 mL, 1%柠檬酸三钠还原50 mL, 0.01%的氯金酸溶液, 得到大小为30 nm金纳米粒子, 详细合成方法见参考文献[16]。 金纳米粒子性能使用透射电镜(JEOL-2100, 日本电子株式会社)和紫外分光光度计(G9, 南京菲勒仪器有限公司)进行表征; 荧光光谱采集使用荧光光谱仪(HORIBA, 美国)。 黄曲霉毒素适配体序列为: GTTGG GCA CGT GTT GTC TCT CTG TGT CTC GTG CCC TTC GCT AGG CCC, 来自文献[17], 由生工生物工程有限公司合成, 适配体使用之前需要活化, 95 ℃加热5 min后迅速在冰水中冷却, 然后将其稀释至使用浓度, 并活保存在冰箱中待用。
首先, 利用柠檬酸三钠还原氯金酸法制备金纳米粒子, 合成的金纳米粒子带负电; 然后, 在金纳米颗粒上修饰AFB1适配体作为信号探针, 适配体通过碱基氮原子与金原子之间形成较强的配位键吸附在AuNPs表面, 将金纳米粒子包裹保护起来; 最后, 在信号探针中加入荧光染料分子RBITC构建成传感器溶液, 由于受到适配体保护, 此时传感器溶液表现出稳定的LSPR及强荧光性能。 由于AFB1与其适配体之间的特异性吸附作用, 当不同浓度目标物AFB1加入传感器溶液中时, 目标物AFB1会识别竞争走传感器溶液中金纳米粒子表面的适配体, 致使适配体从金纳米粒子上脱落, 造成金纳米粒子裸露; 裸露的金纳米粒子在阳离子溶液RBITC作用下迅速聚集, 引起传感器溶液的LSPR性能变化, 同时RBITC在金纳米粒子作用下荧光受到抑制[18]; 将离心再分散后的传感器溶液中加入由铁氰化钾和碘化钾组成的刻蚀剂将金纳米粒子刻蚀消失, 失去金纳米粒子荧光抑制作用的RBITC分子荧光强度得到恢复[19]。 本文利用AFB1引起传感器溶液LSPR变化与刻蚀后传感器溶液的荧光强度大小, 定量检测黄曲霉毒素AFB1。
将不同浓度的AFB1溶液与传感器溶液混合均匀后, AFB1会优先结合其适配体, 造成适配体从金纳米颗粒上脱落, 导致金纳米颗粒裸露; 失去保护的金纳米粒子在RBITC作用下发生聚集, LSPR性能发生变化; AFB1溶液浓度不同, 竞争走的适配体的量不同, 致使金纳米颗粒裸露程度不同, 在RBITC作用下团聚程度也不同, 进而在金纳米颗粒被刻蚀的情况下, RBITC的荧光强度恢复程度也不同。 因此, 论文建立目标物AFB1浓度与LSPR变化情况与RBITC荧光强度之间的线性关系。
AFB1真实样品检测使用来自于当地超市购买的花生油加标后替代AFB1标准样品, 利用所构建的传感器进行回收率实验。
荧光/LSPR双信号生物传感器检测原理如图1所示。 含柠檬酸根的金纳米粒子带负电[20], 在含荧光特性的RBITC阳离子溶液作用下, 迅速发生聚沉, 金纳米粒子溶液颜色迅速由红色变为蓝色, 其LSPR特性发生改变[21]; 同时RBITC与金纳米粒子之间通过共价键相连, RBITC的荧光特性在金纳米粒子作用下受到抑制; 然而, 被适配体保护的金纳米粒子却在RBITC分子存在情况下分散良好, 若此时在溶液中加入目标物AFB1, AFB1与适配体之间的特异性吸附导致AFB1竞争走金纳米粒子表面的适配体, 导致金纳米粒子表面发生裸露, 在RBITC作用下发生聚集, 其LSPR性能改变; 继续加入能够使金纳米粒子氧化消失的刻蚀剂, 金纳米粒子被刻蚀消失, RBITC分子从金纳米粒子上脱落, 此时荧光信号分子荧光恢复。 本文构建的双功能适配体传感器, 目标物AFB1浓度与金纳米粒子的吸光度变化量及刻蚀后信号分子RBITC的荧光强度成正比例关系。
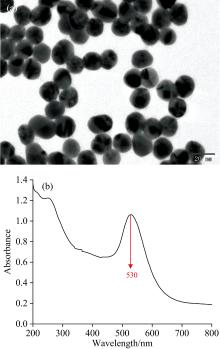
合成的金纳米粒子颜色透亮且呈紫红色。 图2对合成的金纳米颗粒进行表征, 图2(a)为金纳米粒子的TEM图像, 能够说明合成的纳米颗粒形貌规则且呈圆形, 粒径大小为30 nm; 对其进行紫外可见光谱检测, 其SPR峰位于530 nm, 如图2(b)所示。
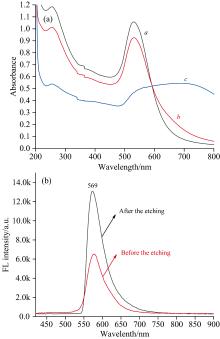
荧光/LSPR双信号适配体传感器可行性实验包括适配体保护的金纳米粒子在RBITC作用下紫外可见吸收光谱变化情况, 以及RBITC与金纳米粒子结合前后荧光强度变化情况。 如图3(a)所示, 适配体保护的金纳米粒子仍然表现出金的LSPR峰不变, 相比较与单独的金纳米颗粒(曲线a)吸光度只有轻微下降(曲线b); 而没有适配体保护的金纳米粒子却在RBITC作用下发生团聚, 530 nm吸收峰急剧减小, 650 nm处LSPR峰突出(曲线c)。
图3(b)所示RBITC溶液表现出强的荧光性(黑色曲线), 在与金纳米粒子结合后荧光强度受到抑制(红色曲线)。 图3说明了所构建传感器的可行性, 据此构建目标物AFB1浓度与吸光度比值LSFR650/LSPR530和金纳米粒子被刻蚀前后RBITC荧光强度大小之间的线性关系。
在双信号适配体传感器检测体系(AuNPs+Apt+RBITC+AFB1+刻蚀剂)构建的过程中, 一些因素不可避免地影响传感器的性能, 这些因素包括: 金纳米颗粒的大小、 修饰在金纳米颗粒上适配体的量、 金纳米与适配体结合的时间以及荧光信号分子RBITC的量, 文章分别对这些影响因素进行实验研究, 并优化出合适的实验条件。
将不同剂量1%柠檬酸三钠(1、 1.2、 1.4和1.6 mL)添加至100 mL沸腾的0.01% HAuCl4· 4H2O水溶液中制备AuNPs。 随着浓度为1%柠檬酸三钠用量从1 mL增加到1.2、 1.4和1.6 mL, AuNPs呈球形, 平均直径分别从55 nm左右减少到37、 30和18 nm, 所得金纳米粒子形貌均匀, 分散性好。 一方面, 较大纳米粒子在激光激发下可以产生更强的增强电场, 有利于荧光信号分子信号的捕捉, 另一方面, 随着金属纳米颗粒尺寸增大, 辐射衰减变得越发严重, 纳米粒子性能变得不太稳定, 文章在结合文献研究且实验的基础上选择30 nm大小的金纳米颗粒作为检测系统实验基础。
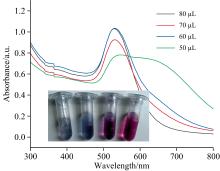
修饰在金纳米粒子上适配体的量也经过优化, 太少的适配体无法将纳米粒子表面包裹完整, 在荧光信号分子的作用下会使纳米颗粒团聚; 过量的适配体会竞争走后期检测过程中AFB1的量, 造成传感器检测不准确。 如图4所示, 当修饰在金纳米颗粒上的Apt溶液为50 μ L时, 在荧光染料RBITC作用下, 金纳米粒子迅速变色, 530 nm处的吸收峰迅速降低, 而650 nm处的吸收峰迅速凸显, 随着Apt添加量的增多, 金纳米颗粒在RBITC作用下逐渐稳定, 优化后, 本研究添加的适配体的量为80 μ L, 1 μ mol· L-1。
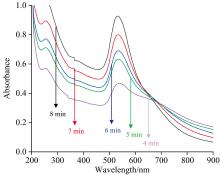
分别将相同检测体系1 mL 30 nm AuNPs++80 μ L 1 μ mol· L-1 Apt+120 μ L H2O室温孵育4、 5、 6、 7和8 min后加入100 μ L 0.8μ mol· L-1 RBITC溶液, 观察体系溶液的变色情况, 并检测体系紫外可见光谱, 确认此时适配体是否已经完全包裹在金纳米颗粒上。 当反应时间为6 min以下时, 加入RBITC后溶液的颜色迅速变成蓝灰, 且在紫外检测中金紫外峰明显下降, 说明适配体还没有将金纳米颗粒包裹完成; 随着反应孵育时间增长, 反应体系在加入RBITC后变色逐渐不明显, 且金紫外峰下降程度减小; 当反应时间为8 min时, 体系的紫外光谱与反应时间在7 min时的情况几乎一样, 说明金纳米颗粒与适配体的结合时间大约为7 min。 因此, 后期的研究中, 适配体与金纳米颗粒的结合时间定为7 min。
荧光信号分子RBITC添加量也会影响检测系统的敏感性, 少量的信号分子不足以引起荧光信号的明显变化及金纳米粒子的迅速团聚, 过量的荧光信号分子也会引起检测系统的不稳定。 1 mL AuNPs+80 μ L 1 μ mol· L-1 Apt+120 μ L H2O振荡混匀孵育7 min后, 加入不同剂量RBITC信号分子溶液, 信号分子浓度越高, 荧光强度越强; 然而, 后期在AFB1的检测中, AFB1分子竞争适配体之后, 金纳米粒子对信号分子荧光猝灭, 过量的RBITC分子会使得系统荧光信号变化不够明显, 影响传感器的灵敏性。 因此, 本文构建的双信号传感器中添加的信号分子量为100 μ L 0.8 μ mol· L-1 RBITC。 双信号传感器检测系统最终优化为1 mL 30 nm AuNPs+100 μ L 0.8 μ mol· L-1 RBITC+80 μ L 1 μ mol· L-1 Apt+120 μ L H2O+100 μ L不同浓度AFB1溶液。
将不同浓度AFB1标准溶液(1× 10-4、 1× 10-3、 1× 10-2、 1× 10-1和1 ng· mL-1)添加至检测系统, 利用构建的双信号输出适配体传感器对AFB1标准溶液进行检测, 图6(a)为AFB1浓度对数与吸光度比值LSPR650/LSPR530之间的线性关系, 其中线性方程为y=0.248 9x+1.366 9, 相关系数R2=0.993; 图6(b)AFB1浓度对数与金纳米粒子刻蚀后RBITC的荧光恢复强度之间的线性关系, 其中线性方程为y=2 432x+15 710, 相关系数R2=0.995。 对AFB1标准溶液的检测说明: 所构建的双信号输出适配体传感器可以用于黄曲霉毒素溶液检测。
为验证所构建荧光/LSPR双信号输出适配体传感器在真实样品中实际应用能力, 将购买的花生油分别加入AFB1标准溶液, 使得真实样品的最终浓度为0.10、 1.00和10.0 ng· mL-1。 实际样品实验结果如表1所示, 利用LSPR检测回收率为95.6%~105%, RSD值为8.46%~12.9%; 利用荧光光谱检测回收率为92.3%~118%, RSD值为7.56%~12.5%; 真实样品实验表明: 基于LSPR/荧光双信号输出适配体传感器是一种很有潜力的检测AFB1残留量的技术。
| 表1 花生油真实样本中AFB1检测 Table 1 AFB1 detection in real samples of peanut oil |
合成了AuNPs, 在AuNPs上修饰AFB1适配体作为传感器信号探针, 在信号探针中加入荧光分子RBITC构建荧光/LSPR双信号传感器溶液。 利用目标分析物AFB1与适配体之间的特异性及AuNPs对RBITC的荧光抑制性, 在传感器溶液中加入不同浓度AFB1后, 采用紫外可见分光光度计扫描获取AuNPs表面等离子共振吸收光谱特性; 在传感器溶液中加入刻蚀剂后, 利用荧光光谱仪获取AuNPs刻蚀后信号分子RBITC的荧光强度, 建立了分析物AFB1浓度与AuNPs的LSPR650/LSPR530值及荧光强度值之间变化关系的双信号输出快速检测黄曲霉毒素方法。 利用构建的荧光/LSPR适配体生物传感器对AFB1进行定量检测, AFB1浓度在0.000 1~1 ng· mL-1范围时, 吸光度比值及信号分子荧光强度都与样品浓度具有较好的线性关系, 其线性相关系数分别为0.993和0.995, 且该传感器在真实的样本中也能实现快速检测。 基于金纳米粒子表面等离子共振吸收光谱特性及荧光抑制性为AFB1快速定量检测提供了一条有效的途径。 未来需要进行的实验工作将评估双信号适配体生物传感器的适用性, 用于复杂的食物类型, 需要在不同的基质和复杂的样本上检测AFB1。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|