作者简介: 王树栋, 1985年生,贵州警察学院实验中心博士 e-mail: wsd@gzpc.edu.cn
氯胺酮是一种常见的新型毒品, 根据与2-邻氯苯基相连C原子手性, 氯胺酮存在R-氯胺酮和S-氯胺酮手性异构体, 两种异构体理化性质相似, 传统的色谱方法难以对其区分。 为了揭示氯胺酮手性异构体性质差异, 实现氯胺酮快速识别鉴定, 采用实验结合理论计算的方法对其进行研究。 在B3LYP/6-311++G(d, p)水平对氯胺酮R, S手性异构体进行结构优化, 在MP2/aug-cc-pVTZ水平计算了单点能, 证明两种异构体都能稳定存在。 表面静电势和分子极化率计算表明, 氯胺酮两种异构体电子结构存在明显特异性, 导致其拉曼性质不同。 使用标准样品, 实验得到了氯胺酮拉曼光谱, 确定氯胺酮的特征峰为1 044、 654和1 590 cm-1, 与理论计算吻合良好, 而457和596 cm-1特征峰可以用来区别R-氯胺酮和S-氯胺酮, 电子结构和极化率分析解释了异构体拉曼性质的差异, PED分析对拉曼振动峰进行了归属。 因为手性异构体的存在及特殊的双六元环结构, 氯胺酮拉曼光谱的研究较为复杂, 该研究为氯胺酮拉曼光谱法快速检测提供了准确实验数据以及可靠理论支持, 将有助于氯胺酮拉曼检测标准的制定以及毒品拉曼光谱数据库的建立, 并将为手性异构体光谱性质的研究提供借鉴。
Ketamine is a common new type of drug. According to the chirality of the C atom connected to 2-chlorophenyl, ketamine has chiral isomers ofR and S-ketamine. Due to the similarity of physical and chemical properties of the two isomers, it is difficult to distinguish them by traditional chromatographic methods. To reveal the differences between ketamine isomers and the rapid identification and characterization of ketamine,experimental combined theoretical calculations were used to investigate their properties in this article.The structure optimization of R and S-ketamine chiral isomers was carried out by B3LYP/6-311++G (d,p), and the single point energy was calculated at the MP2/aug-cc-pVTZ level. The calculation of surface electrostatic potential and molecular polarizability shows significant specificity in the properties of the two isomers, leading to their different Raman properties. Using standard samples, Ketamine Raman spectroscopy was experimentally obtained, and the characteristic peaks were determined to be 1 044, 654 and 1 590 cm-1, which are in good agreement with theoretical calculations, while the characteristic peaks of 457 and 596 cm-1 can be used to distinguish between R and S-ketamine. The differences in Raman properties of isomers were explained by electronic structure and polarization analysis, and the Raman vibrational peaks were assigned by PED analysis. Due to the isomers and special double hexagonal ring structure, the study of ketamine Raman spectroscopy is relatively complex. This article provides accurate experimental data and reliable theoretical support for the rapid detection of ketamine Raman spectroscopy, which will contribute to the formulation of ketamine Raman detection standards and the establishment of drug Raman spectroscopy databases. It will also provide a reference for the study of differences in the spectral properties of chiral isomers.
近年来在毒品犯罪案件总量下降、 传统毒品犯罪得到有效遏制的背景下, 新型毒品违法犯罪逆势上涨, 新型毒品隐蔽性强, 对青少年群体危害尤其严重。 氯胺酮(ketamine, Ket)是苯环己哌啶(phencyclidine, PCP)的衍生物, 全名为2-邻氯苯基-2-甲氨基环己酮, 俗称K粉, 是一种常见的新精神活性物质(new psychoactive substance, NPS), 氯胺酮的滥用正成为社会的重要隐患[1]。 氯胺酮是一种NMDA拮抗剂, 有麻醉和镇痛的作用, 过量使用可以引起幻觉、 高血压和呼吸困难等。 根据与2-邻氯苯基相连C原子手性, 氯胺酮可以分为R-氯胺酮(简称Rke)和S-氯胺酮(简称Ske)。 临床上氯胺酮也常用作镇痛剂、 麻醉剂, 并被广泛的应用于治疗抑郁等[2, 3], 临床所用的氯胺酮一般是R-氯胺酮和S-氯胺酮异构体的消旋体, 而越来越多的研究表明, 氯胺酮手性异构体作用机制和代谢动力学不同, 因此, 对氯胺酮手性异构体特异性的研究正受到越来越多的关注[4, 5, 6]。
目前, 对氯胺酮的检测方法主要有液相色谱-质谱法、 气相色谱-质谱法、 红外光谱法、 拉曼光谱法、 电化学法、 核磁共振法等。 尽管液相色谱-质谱、 气相色谱-质谱、 电化学、 核磁共振等方法检测灵敏度高, 但复杂的样品预处理、 耗时的分析程序和对实验室环境的高要求限制了它们的应用。 拉曼光谱无需样品前处理, 测试速度快, 成本低, 是一种基于分子振动谱学的无损分析技术, 可以快速、 准确地识别毒品成分, 近年来在新型毒品的快速检测中得到广泛应用, 对于提高毒品检测的效率和准确性具有重要意义[7, 8, 9]。
手性化合物的结构和理化性质相似, 传统的色谱法难以对其区分, 而利用偏振特性, 拉曼光谱可以作为手性分子构型判断的重要依据[10, 11]。 越来越多的研究表明, 异构体分子拉曼光谱存在显著差异, 而实验测得的拉曼光谱往往来自多种构象分子[12, 13, 14, 15]。 研究者对氯胺酮拉曼光谱进行了研究, 然而这些研究都没有对氯胺酮的手性异构体进行比较, 得到的拉曼特征峰存在差异, 也没有对拉曼峰归属做出合理解释[16, 17]。 本研究结合实验和密度泛函理论计算, 对氯胺酮进行了研究, 并对其特征峰归属进行了分析, 为氯胺酮拉曼光谱快速检测提供了准确的实验数据以及可靠的理论支持, 将有助于氯胺酮拉曼检测标准的制定以及毒品拉曼光谱数据库的建立。
氯胺酮标准样品由贵州省公安厅物证鉴定中心提供, 样品呈粉末状, 纯度≥ 98%。
拉曼光谱采用雷尼绍inVia激光显微共聚焦拉曼光谱仪。 主要技术指标: 采集光谱范围200~3 200 cm-1, 激发波长532 nm, 激光最大输出功率100 mW, 积分时间范围为1 ms~20s。
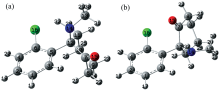
对于氯胺酮的稳定构象, 采用B3LYP杂化泛函结合6-311++G(d, p)基函数优化, 在相同水平计算了其拉曼光谱, 所有计算使用Gaussian09程序包完成[18]。 两种氯胺酮异构体的初始结构从PDB晶体结构数据库获得(PDBID: 4F8H, 7EU7)[4, 19]。 如图1是优化得到的氯胺酮异构体的稳定结构, 相同水平计算了其Hessian矩阵, 证明得到的结构是局部极小值。
原子质量和键级是影响拉曼位移的重要因素, 因此在几何结构讨论中, 本文重点关注了异构体键长度的变化(表1), 可以看出, 虽然苯环中C— C键非常接近, 但是手性碳原子所在的环己酮结构出现明显差异。 其中, 差别最大是靠近电负性较强的O、 N原子附近的C7— C8, C9— C10和C11— C12。 对于R-氯胺酮, 分别为1.524、 1.531和1.566 Å ; 而对于S-氯胺酮, 分别为1.519、 1.549和1.550 Å 。 此外, 两种异构体中甲氨基dC12— C14键长也明显不同, 对于R-氯胺酮和S-氯胺酮, dC12— C14分别为1.469和1.482 Å 。 可以看出, 取代基取向的不同导致手性异构体结构发生明显变化。
| 表1 B3LYP/6-311++G(d, p)优化得到的氯胺酮异构体结构参数(Å ) Table 1 The structure parameters optimized by B3LYP/6-311++G (d, p) (Å ) |
氯胺酮异构体混合物可以视为处于温度为T的热力学平衡状态, 并服从玻尔兹曼分布
式(1)中, k为玻尔兹曼常数, Q为配分函数, 因此
根据优化得到的结构, 本文在MP2/aug-cc-pVTZ水平计算了两种异构体的单点能。 能量计算结果表明, R-氯胺酮和S-氯胺酮Δ G为0.23 kcal· mol-1, 其中熵贡献Δ TS为-0.36 kcal· mol-1, R-氯胺酮更稳定。 根据式(2), 在298 K, R-氯胺酮与S-氯胺酮比例约为3∶ 2。
图2(a)和(b)分别是本文理论计算得到的R-氯胺酮和S-氯胺酮拉曼光谱, 根据文献报道, 用修正因子0.980 8对得到的光谱进行了修正[20], 并重点研究了400~1 800 cm-1的拉曼光谱指纹区域。 从图中可以看到, R-氯胺酮在589、 646、 1 005、 1 049以及1 601 cm-1存在强的拉曼振动峰。 而S-氯胺酮在451、 550、 644、 1 046及1 600 cm-1存在强的拉曼振动峰。 可以看出, 由于分子构象不同, 虽然在644~646、 1 005~1 049、 1 600~1 601 cm-1处两种异构体都存在明显的拉曼峰, 但是在关键特征峰1 005~1 049 cm-1周围明显不同。 R-氯胺酮在1 049 cm-1左右主要有两个比较强的分峰, 分别为1 005和1 049 cm-1, 而S-氯胺酮仅在1 046 cm-1处存在一个峰。 此外, R-氯胺酮在589 cm-1存在明显拉曼峰, 而S-氯胺酮在451 cm-1存在明显拉曼峰。
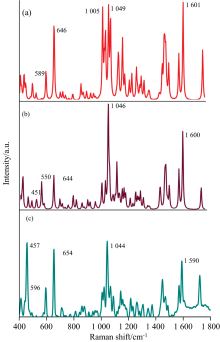 | 图2 (a) R-氯胺酮理论计算拉曼光谱; (b) S-氯胺酮理论计算拉曼光谱; (c) 氯胺酮实验拉曼光谱Fig.2 (a) Calculated Raman spectra of R-ketamine; (b) calculated Raman spectra of S-ketamine; (c) experimental Raman spectra of ketamine |
图2(c)是实验得到的拉曼光谱, 实验发现氯胺酮在457、 596、 654、 1 044以及1 590 cm-1存在明显拉曼峰, 其中峰654、 1 044以及1 590 cm-1与理论计算结果非常一致。 值得注意的是, 根据本文理论计算得到的结果, 596 cm-1特征峰来自R-氯胺酮, 而457 cm-1特征峰来自S-氯胺酮, 氯胺酮两种异构体拉曼性质表现出明显差异, 这种差异在以前的研究中并未见报道。
显然, 氯胺酮手性异构体表现出不同的拉曼活性。 分子表面静电势(molecular electrostatic surface potential, MEP)在预测分子反应活性位点、 性质、 静电相互作用、 分子极化率等有重要作用[21], 因此本文使用Multiwfn结合VMD在MP2/aug-cc-pVTZ水平分析和绘制了氯胺酮异构体分子的表面静电势[22], 如图3。 可以看出, 由于羰基取向的不同, 两个异构体的表面静电势表现出显著的差异性, S-氯胺酮苯环表面的静电势更负。 区别最大的是N原子, 由于远离Cl、 O形成的负电荷中央, S-氯胺酮N原子位置的静电势为正, 而R-氯胺酮N原子位置的静电势为负, 与其极化率的差异一致(表2), 这些电子结构的差异可能对手性异构体光学性质产生重要影响。
| 表2 氯胺酮异构体原子极化率(kcal· mol-1)及NBO电荷a Table 2 The atomic polarizability (kcal· mol-1) and NBO charge of ketamine isomersa |
分子拉曼散射光谱是由于分子感应偶极矩变化引起的, 极化感应偶极矩
拉曼活性
其中α 为极化率, 因此分子的拉曼活性与极化率的二次方成正比。 本文使用Multiwfn程序计算了氯胺酮异构体分子的极化率[22], 见表2。 可以看出, 两种异构体原子极化率有明显区别, 特别是在由Cl、 O组成的负电荷中心, 两种异构体O14、 N15、 C1和Cl13极化率分别相差52.09、 48.55、 38.28和32.63 kcal· mol-1。 而NBO自然键轨道分析同样表明, 两种异构体原子NBO电荷有明显区别, 且同样是在O14、 N15、 C1和Cl13等静电势为负的反应活性中心差别最显著。 显然, 这些电子结构的差异解释了氯胺酮异构体拉曼光学性质的不同[23]。
结合实验结果、 理论计算及PED(potential energy distribution)分析[24], 本文对氯胺酮各振动峰进行了归属(表3)。 对于R-氯胺酮, 拉曼活性最强的1 049 cm-1峰归属苯环C1— C2对称伸缩振动引起的苯环呼吸振动, 以及环己酮C11— C10、 C8— C9和C10— C9的对称伸缩振动; 而对于S-氯胺酮, 拉曼活性最强的1 046 cm-1峰归属苯环C1— C2、 C2— C4的对称伸缩振动引起的苯环的呼吸振动, 并不受环己酮振动干扰。 1 601 cm-1(R-氯胺酮)和1 600 cm-1(S-氯胺酮)归属芳香性环C1— C3和C2— C4对称伸缩振动。 B3LYP/6-311++G(d, p)对苯结构优化得到的结果表明, 苯中dC— C=1.394 Å , 说明氯胺酮中C1— C3、 C2— C4键长更小, 键级更高, 因此其伸缩振动更符合典型的C=C双键振动特征峰。 646 cm-1(R-氯胺酮)和644 cm-1(S-氯胺酮)归属键角C1— C2— C4和C3— C1— C2弯曲振动引起的苯环扭曲振动, 两种异构体非常相似。
| 表3 氯胺酮理论计算及实验光谱归属和PED分析a Table 3 Theoretical calculation and experimental spectra of ketamine, assignment and PED analysisa |
R-氯胺酮589 cm-1和S-氯胺酮550 cm-1谱峰归属羰基附近C7— C8对称伸缩振动和键角O15— C7— C8弯曲振动的贡献。 不同的是, 由于羰基的取向不同, 导致它们对振动贡献的相位是相反的。 此外, 二面角H13— N14— C13— H29的扭转振动(N— H摇摆)对R-氯胺酮589 cm-1峰贡献为17%, 因此, 此处两种异构体的拉曼性质出现明显差异。 从静电势(图3)可以看出, N— H处是两种异构体电子结构差异性最大的位置, 而对两种氯胺酮的极化率分析表明, R-氯胺酮N分子极化率明显大于S-氯胺酮, 显然极化率增强了N— H摇摆振动的拉曼活性, 并最终导致了两种异构体拉曼性质的明显差异。 而S-氯胺酮在451 cm-1的拉曼峰来自于环己酮C8— C9— C10弯曲振动和2-邻氯苯基C1— C2— C4— C6扭曲振动共同贡献, 但是R-氯胺酮却未得到这一谱峰。 值得注意的是, C8、 C9和C10处同样是两种异构体结构性质差异最大的位置(表1)。
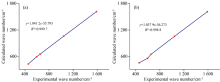
上述分析表明, 实验得到的氯胺酮拉曼光谱来自氯胺酮R, S异构体的共同贡献, 这与本研究的理论推断一致, 因为在氯胺酮标准样品中, 两种手性异构体都能稳定存在。 从氯胺酮拉曼光谱理论计算与实验结果的线性关系曲线(图4)也可以看出, 在457 cm-1附近, R-氯胺酮理论计算值与实验值出现比较大的偏差, 而在596 cm-1附近, S-氯胺酮理论计算值与实验值出现较大偏差。 因此, 457和596 cm-1是区别R-氯胺酮和S-氯胺酮的重要特征峰。 而由于氯胺酮两种异构体在1 044、 654和1 590 cm-1附近都有明显的特征峰, 因此选取1 044、 654和1 590 cm-1作为识别鉴定氯胺酮的特征峰更合适, 理论计算与实验结果相对误差在2%以内(表4), 吻合良好。
| 表4 特征峰1 044、 654和1 590 cm-1实验与理论计算对照, 括号内为相对误差 Table 4 Comparison of experimental and theoretical calculations for characteristic peaks 1 044, 654 and 1 590 cm-1, the relative errors in parentheses |
利用密度泛函理论对氯胺酮R, S异构体进行了结构优化, 计算了其表面静电势及分子极化率, 计算表明氯胺酮两种异构体电子结构存在明显差异。 通过实验得到了氯胺酮的拉曼光谱, 分析表明, 实验得到的氯胺酮拉曼光谱来自R, S异构体的共同贡献。 结合理论计算和PED分析, 对特征峰的归属进行了讨论, 表明氯胺酮的特征峰为1 044、 654和1 590 cm-1, 实验与理论计算结果吻合良好, 而457和596 cm-1是区别R-氯胺酮和S-氯胺酮的重要特征峰。 研究结果为氯胺酮的拉曼光谱快速检测提供了准确的实验数据以及可靠的理论支持, 将有助于氯胺酮拉曼检测标准的制定以及毒品拉曼光谱数据库的建立。
致谢: 感谢贵州大学贵州省高性能计算化学重点实验室(GHPCC)提供的理论计算支持。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|