作者简介: 王 策, 1991年生,渭南师范学院化学与材料学院讲师 e-mail: wangce1214@163.com
金属有机框架(MOFs)是金属离子或簇核与有机配体通过配位键连接, 具有高度结构设计性的分子基功能材料。 金属有机框架尤其在新型光学器件领域中显示出诱人的应用前景, 有望成为极具应用价值的环保型功能发光材料。 采用线型苯羧酸配体1,4-二(4-羧基苯基)苯(H2tpdc), 在溶剂热条件下合成无色透明晶体[Mn4(OH)2(tpdc)3]·2CH3CN(1)。 通过X射线单晶衍射仪对该化合物表征, 并对其热稳定性及荧光性质进行研究。 结果表明, 化合物1结晶在单斜晶系P21/c空间群, 每个不对称单元中包含三个tpdc2-配体阴离子, 四个Mn2+, 晶体生长为菱形二维层状结构。 测定了化合物的激发光谱、 发射光谱, 并探索了其在水溶液中对不同阴阳离子的荧光响应。 结果表明, 化合物1能够从不同离子中有效识别Fe3+、 Cr2
Metal-organic Frameworks (MOFs) are a kind of molecular-based functional materials that are highly structurally designed by connecting metal ions or cluster nuclei with organic ligands through coordination bonds. Metal-organic frameworks show attractive application prospects especially in new optical devices, and are expected to become environmentally friendly functional luminescent materials with great application value. Therefore, a colorless transparent crystal [Mn4(OH)2(tpdc)3]·2CH3CN (1) was synthesized under solvothermal conditions using linear benzene-carboxylic acid ligand 1,4-bis (4-carboxyphenyl) benzene (H2tpdc). The compound was characterized by an X-ray single-crystal diffractometer, and its thermal stability and fluorescence properties were studied. Compound 1 crystallizes in the monoclinic P21/c space group. Each misalignment unit of the compound contains four Mn2+ ions and three H2tpdc2-ligand anions in an asymmetric unit. The crystal growth is a rhomboid two-dimensional layered structure. The excitation and emission spectra of the complexes were measured, and the fluorescence responses of the complexes to different metal ions in aqueous solution were investigated. The experimental results show that compound 1 can sensitively detect Fe3+, Cr2
金属有机框架(metal organic frameworks, MOFs)作为功能材料由于拓扑变化以及次级结构单元特点使其具有巨大的应用潜力, 在催化[1, 2]、 气体吸附[3, 4]、 离子传感[5, 6]、 气体储存[7, 8]、 药物缓释[9]、 光学器件[10, 11]等领域中显示出诱人的应用前景。 一些新颖性能如智能响应、 复合功能等常被报道[12]。 Chem. Rev.及Chem. Soc. Rev.过去十年刊出六期专辑综述, 从设计组装、 可控制备、 性质研究和功能调控等多方面介绍了MOFs前沿进展, 体现出该领域的重要性[13]。
近年来, 发光MOFs以其独特的发光特性, 光学传感及可视光功能越来越引起学者的广泛关注。 由于超强的组合性, 协同效应以及有序可控的设计特点使MOFs成为极具应用前景的功能发光材料[14, 15]。 MOFs内的孔隙可用于封装大量的光子客体, 如纳米粒子, 金属离子或有机染料来构建光子MOFs[16]。 传统的传感技术主要依赖于物理或化学性质的改变来检测目标物质, 而这些传感技术往往受到灵敏度、 选择性和稳定性的限制。 如传统的传感器在检测微量物质或复杂环境中的目标物质时, 可能难以达到理想的性能。 传统的传感技术存在制备成本高、 操作复杂等问题, 在一定程度上限制了其在实际应用中的推广。 与传统传感方法相比, 发光传感具有响应速度快、 灵敏度高、 抗电磁干扰能力强、 操作安全、 可远程监测爆炸或燃烧环境等优点。 MOFs的发光性能对MOFs的结构特征、 配位环境、 孔表面特性、 配位键、 π — π 相互作用以及与外来物质之间的氢键都很敏感, 为开发发光MOFs提供了坚实的理论基础[17, 18, 19]。 荧光MOFs可以有效地消除传感器设计和开发过程中的外部干扰[20, 21, 22]。 MOFs在发光传感方面的优势已经得到了证明, 所面临的挑战也得到了很好的解决[23, 24]。 研究人员不再简单合成MOFs传感器, 而是将重点放在探索这些MOFs材料的传感策略上。 传感策略的研究对于指导荧光MOFs的设计和合成至关重要, 是克服实际传感应用中巨大困难的关键。 因此筛选简单易得、 稳定性高的荧光传感材料更加迫切。
本工作采用溶剂热法构筑了过渡金属Mn化合物, 得到了一例无色透明晶体, [Mn4(OH)2(tpdc)3]· 2CH3CN。 通过X-单晶射线衍射、 粉末射线衍射、 热重分析技术表征了其结构, 并探究了其在Fe3+, Cr2
实验所需的试剂均为AR级, 未经处理直接使用。 四水合氯化锰(纯度99%)和乙腈(CH3CN), 国药集团化学试剂有限公司; 三联苯二羧酸(纯度98%), 济南恒化科技有限公司; 实验用水为超纯水(实验室自制)。
Bruker SMART APEX Ⅱ CCD X射线单晶衍射仪上进行晶体结构测试。 在Rigaku D/Max-3c 日本力学株式会社(Cu-Kα , λ 1=0.154 059 8 nm, λ 1=0.154 442 6 nm, U=45 kV, I=40 mA, 2θ =2° ~30° )上进行X射线粉末衍射测试, 模拟粉末衍射图谱由Mercury 4.0计算生成。 在美国TA TGA Q500/DSC-Q2000热重差、 热综合热分析仪上进行热重分析。 在爱丁堡FS5时间分辨荧光仪上进行荧光光谱测试。
室温下将15 mL CH3CN溶液加入到含有H2tpdc(H2tpdc=2', 5'-dimethylterphenyl-4, 4″-dicarboxylate, 34.5 mg, 0.1 mmol), MnCl2· 4H2O(28.6 mg, 0.2 mmol)25 mL的聚四氟乙烯反应釜中, 使用超声仪超声处理, 然后用磁力搅拌器搅拌至完全溶解, 并将水热反应釜密封, 置于烘箱中在150 ℃下保持3 d, 随后以每小时15 ℃的速度冷却到室温。 最后用CH3CN洗涤得到大量无色块状晶体[Mn4(OH)2 (tpdc)3]· 2CH3CN(1), 产率80%~88%, 产量30.9 mg。
元素分析数据, Cal (C70H54N2Mn4O12, Fw=1 334.93): C 61.98%, H 4.31%, N 2.10%; Found: C 62.14%, H 4.27%, N 2.38%。
选取晶体尺寸为0.25 mm× 0.15 mm× 0.15 mm, 在Bruker SMART APEX Ⅱ 型单晶衍射仪上, 并在硅油保护下迅速上样, 采用Mo-Kα 射线(λ =0.071 073 nm)为衍射源, 在室温(293 K)温度下, 按劳艾群策略收集数据。 数据还原后, 先用帕特森法确定金属原子位置, 然后用差值傅里叶法求出全部非氢原子坐标, 并用理论加氢法得到氢原子位置, 用全距阵最小二乘法对所有非氢原子坐标和温度因子进行修正[25, 26]。 结构解析工作用SHELXTL-2014及OLEX-2程序包完成。 表1为化合物1的晶体学数据。
| 表1 化合物1的晶体学数据 Table 1 Crystal data and structure refinement for 1 |
通过X射线单晶衍射分析表明, 该晶体结晶在单斜晶系P21/c空间群。 每个不对称单元包含四个Mn2+, 三个tpdc2-配体阴离子, 以及两个OH-, 整个金属-有机框架呈电中性[图1(a— d)]。 在不对称单元中Mn1采用八面体配位构型, 分别与三个不同tpdc2-羧酸基团中的三个氧原子进行单齿配位, 并与两个OH-中的氧原子单齿配位, 其中Mn— OH距离为0.219 2(14)~0.242 0(14) nm, 羟基位于八面体MnO4(OH)2单元内的反式位置; Mn2采用八面体配位构型, 分别与四个不同tpdc2-羧酸基团中的四个氧原子进行单齿配位, 以及两个OH-中的氧原子配位, 其中Mn— OH距离为0.229 8(14)~0.240 1(14) nm; Mn3采用八面体配位构型, 分别与来自五个不同tpdc2-羧酸基团中的五个氧原子进行单齿配位, 以及一个OH-中的氧原子单齿配位, 其中Mn— OH距离为0.221 8(14)~0.234 1(14) nm; Mn4采用八面体配位构型, 分别与来四个不同tpdc2-羧酸基团中的四个氧原子进行单齿配位, 以及两个OH-中的氧原子单齿配位, 其中Mn— OH距离为0.229 8(14)~0.240 1(14) nm。 对配体tpdc2-采用μ 4-(η 1∶ η 1)∶ (η 2∶ η 1)模式连接Mn2+。 以上述配位模式, Mn2+连接tpdc2-羧酸形成[Mn(COO)2]一维链。 而tpdc2-通过其羧基中两个氧原子占据Mn2+轴向位点进而将一维链拓展为菱形二维层。
为了确定样品的相纯度, 对化合物1进行了PXRD表征。 如图2所示, 化合物1的PXRD实验图与模拟图吻合较好, 两者的衍射峰位置基本相同。 说明该样品具有较高的相纯度, 可用于后续表征及性质测试。
化合物1红外曲线如图3所示, IR数据(KBr, cm-1): 3 418(m, br), 3 048(vw, br)、 2 848(vw, br), 1 655 (w, sh), 1 593(s, sh), 1 537(w, sh), 1 414(vs, sh), 1 083(vw, sh), 973(m, sh), 847(m, sh), 772(sm, sh), 716 (vw, sh), 523(vw, sh)。 其中3 048和2 848 cm-1处较弱的峰可归属为配体中烷烃链上ν C— H的伸缩振动, 1 655和1 593 cm-1处强峰的伸缩振动归属为苯环的骨架振动。
化合物1热重曲线如图4所示, 25~150 ℃温度范围内, 第一阶段损失20.8%(理论值为21.3%), 可归因于化合物结构中客体CH3CN分子的释放。 第二个阶段在500~650 ℃温度范围内显示出55.6%的失重(理论值为56.8%), 归因于化合物结构中配体tpdc分子的分解。 随后进一步升高温度, 表明最终产物可能是MnO。
化合物1的固态激发和发射光谱如图5(a)所示。 与配体相比, 化合物1的发射表现出单一的窄蓝色发射。 配体与化合物1的发射光谱最大值分别位于360与420 nm, 化合物1与自由配体H2tpdc的发射光谱相比发生了较大的红移[如图5(b)所示], 表明存在配体π * — π 或n— π * 电子跃迁[25]。 将化合物1的发射光谱转换成色度坐标, 绘制于CIE(国际照明委员会)图, 结果如图5(c)所示, 色度坐标值为(0.169, 0.255), 表明化合物1发出明亮的蓝光。
为了验证化合物对水溶液中不同阴阳离子的检测效果, 将晶体样品充分研磨, 均匀的分散于不同金属阳离子M(NO3)x(0.01 mol· L-1, M=K+, Mg2+, Ag+, Cd2+, Pb2+, Ca2+, Ba2+, Zn2+, Ni2+, Co2+, Al3+, Cu2+, Na+, Fe3+)及不同阴离子NanA(0.01 mol· L-1, A=OAc-,
为了进一步验证化合物1可以高选择性地检测Fe3+, 同样进行了干扰实验。 将Fe3+与其他干扰阳离子(K+, Mg2+, Ag+, Cd2+, Pb2+, Ca2+, Ba2+, Zn2+, Ni2+, Co2+, Al3+, Cu2+, Na+)等量混合, 随后加入化合物1, 观察其相对强度的变化。 结果如图7(a)所示, 观察到当其他干扰离子与Fe3+混合时, 化合物1的相对强度几乎为零, 表明即使在其他干扰离子的存在下, 化合物1仍然可以检测水溶液中的Fe3+。 将Cr2
 | 图7 (a) Fe3+引入不同阳离子干扰实验; (b) Cr2 |
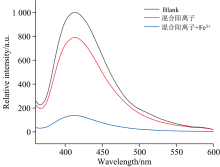
研究了Fe3+对化合物1发光猝灭效率的选择性。 化合物1除Fe3+外, 其余金属离子均为1 mmol· L-1的水溶液分散体系中, 发光强度轻微猝灭。 而加入1 mmol· L-1 Fe3+后, 荧光被剧烈猝灭(如图8所示)。 表明即使在存在其他竞争离子的情况下, 化合物1能选择性地检测水中的Fe3+。
为了深入探究化合物1对Fe3+、 Cr2
| 表2 基于不同MOFs材料检测Fe3+的比较 Table 2 Comparison of Fe3+ ion detection based on different MOF materials |
为了解释Fe3+、 Cr2
在溶剂热条件下成功构筑一例化合物[Mn4(OH)2(tpdc)3]· 2CH3CN(1)。 采用X射线单晶衍射仪、 粉末衍射仪、 热重分析仪对化合物进行了表征, 在500 ℃能够保持较好的热稳定性。 进一步测试化合物1的荧光识别能力。 经计算得化合物1用于检测Fe3+、 Cr2
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|