作者简介: 刘文博,女, 1999年生,北京工业大学化学与生命科学学院硕士研究生 e-mail: liuwenbo2021@163.com
急性细菌性结膜炎是一种常见的眼科疾病, 医治不及时会严重损害视力。 目前针对细菌性结膜炎常规的诊断方法仍为微生物培养法, 该方法灵敏度高, 但耗时耗力, 难以满足快速检测的需求。 该研究开发了一种SERS@Au微阵列芯片, 将其作为增强基底收集细菌性结膜炎相关金黄色葡萄球菌、 大肠杆菌、 铜绿假单胞菌和表皮葡萄球菌的SERS图谱。 结果表明, 该芯片具有良好的增强效果、 重现性和稳定性。 选取400~1 800 cm-1波段, 通过建立SVM模型和OPLS-DA模型对四种致病菌进行判别分析, 区分准确率分别达到97%和90%。 采用SERS@Au微阵列芯片对加标泪液进行检测, 仅需短暂培养即可快速、 准确、 便捷、 无损筛查致病菌, 减少患者的痛苦。 该研究开发的SERS@Au微阵列芯片与便携式拉曼光谱仪配套使用, 具有准确、 便携、 快速、 现场检测及微量样品检测的特点, 适用于眼科细菌性感染疾病的快速筛查。 该方法无需标记、 无需鉴定培养基、 对患者无损, 实现了对复杂生物样本混合感染的快速检测, 大大提高了检测效率, 有望成为眼科疾病的新型辅助筛查手段。
Acute bacterial conjunctivitis is a prevalent ocular disease that can lead to severe vision impairment if not promptly treated. The conventional diagnostic method for bacterial conjunctivitis still relies on microbial culture, which, although highly sensitive, is time-consuming, labor-intensive, and unable to meet the demand for rapid detection. In this study, we developed a SERS@Au microarray chip as an enhanced substrate for collecting the SERS spectra of conjunctivitis-associated bacteria, including Escherichia coli, Staphylococcus aureus, Pseudomonas aeruginosa, and Staphylococcus epidermidis. The results demonstrated that the SERS@Au microarray chip has an excellent enhancement effect, reproducibility, and stability. By selecting the Raman shifts from 400 to 1 800 cm-1 of pathogenic bacteria to perform an SVM model and OPLS-DA model, the discrimination accuracies achieved 97% and 90%, respectively. Detecting spiked tears using the SERS@Au microarrays chip can quickly, accurately, and conveniently screen pathogenic bacteria with simple culture. Collecting tears for direct testing is simple, painless, and non-destructive for patients. Combining the SERS@Au microarray with a portable Raman spectrometer is suitable for on-site screening of ophthalmic bacterial infections. Moreover, it enables the detection of mixed infections, thereby greatly enhancing overall efficiency in diagnosis and providing a valuable assistive tool for ophthalmic disease screening.
细菌感染可引起多种疾病并造成了巨大的医疗负担[1]。 以眼科疾病常见的急性细菌性结膜炎为例, 患者通常直接接触感染源或由天然结膜菌群异常增殖引起, 如果医治不及时会导致视力严重受损[2, 3]。 引起细菌性结膜炎的常见病原体包括金黄色葡萄球菌、 溶血性链球菌、 表皮葡萄球菌、 阴性肠道细菌和铜绿假单胞菌等[4, 5, 6]。 临床上主要采用微生物培养法分离、 提取感染的菌株, 结合自动微生物分析系统进行进一步的鉴定。 该方法准确、 灵敏, 但是依赖于选择性培养基, 需要昂贵的设备, 费力且耗时, 难以满足快速检测的需求。 聚合酶链反应(PCR)具有快速检测的优势, 而PCR依赖于特定的DNA序列, 对于未知的或不常见的病原体, PCR可能无法提供所需的信息, 导致假阳性或假阴性结果, 其样品制备需要进行DNA提取、 纯化及扩增等步骤[7]。 眼睛是较为敏感的部位, 采用拭子或结膜刮片的方式从患者眼部取样, 增加病人的不适感, 取样量较少, 增加了检测的难度[8]。 在对患者不造成损伤的前提下, 如何实现微量、 快速、 高效、 准确、 无损检测是一个技术难题。
表面增强拉曼光谱(surface enhanced Raman spectroscopy, SERS)作为一种新兴的分子光谱分析技术, 在特定波长的激光激发下, 纳米结构的等离子体金属表面由于等离子体共振产生极强的电磁场, 被测物的拉曼信号会被显著增强, 具有较高的检测灵敏度[9, 10]。 SERS不仅可以检测已知目标病原体, 还能检测未知病原菌, 并提供致病菌的的生物化学组成和结构信息。 SERS检测具有快速、 指纹识别、 无损、 不怕水的干扰等优点, 这种多功能性使得它在眼科疾病检测领域显示出巨大的应用潜力, 便于发现和诊断未知病因的细菌性感染[11, 12, 13], 有望成为眼科疾病筛查和医学诊断的辅助手段[14]。 Xie等利用拉曼光谱技术检测角膜炎患者和正常人泪液, 通过建立PCA-SVM和PLS-SVM判别模型, 区分病人与正常人, 准确率分别为77.86%和100%[15]。 Kuo等利用拉曼光谱检测结合PCA分析能够区分感染性和非感染性溃疡性角膜炎疾病[16]。 Wu等通过收集角膜炎患者、 结膜炎患者及健康体检者的泪液, 对比分析其拉曼光谱, 筛查角膜炎和结膜炎的准确率达94.8%[17]。 Kim等使用SILAR技术, 将金纳米颗粒直接合成并沉积在渗透性多孔基底的亲水区域, 制备了金纳米生物传感纸条, 将其应用于腺病毒性结膜炎、 单纯疱疹性角膜炎和眼部带状疱疹的检测中, 结合多元统计分析判别患者感染类型[18]。
尽管使用SERS技术检测泪液以判断眼科疾病已有文献报道, 但现有相关研究主要采用拉曼光谱技术结合化学计量学对病人眼泪的光谱数据进行建模分析, 以研究正常人与患者泪液之间的差异, 不同致病菌引起感染的分类检测与诊断的报道还相对较少。 本工作以急性细菌性结膜炎的主要病原菌为研究对象, 研发了一种新型的无标记的SERS@Au微阵列芯片, 通过收集微量的眼泪进行短暂的培养(8~10 h), 待菌落长成针尖状大小即行检测, 达到分离、 检测、 鉴定不同病原体的效果。 该方法针对泪液中不同致病菌进行鉴别和区分, 无需擦拭患者角膜或眼睑, 对患者无损, 检测方法操作简便, 无需鉴定培养基, 大大缩短了整体的鉴定时间, 以便临床医生更加快速、 准确地选择药物治疗方案与个性化治疗措施, 有望成为眼科疾病临床诊断的新方法。
用无水乙醇和去离子水超声处理基板10 min, 以去除基板表面的有机物和污染物, 待干燥后将铝箔纸平整无褶皱且无气泡地贴在带有粘性的基板上。 将制备好的基板放置于定制的点样板中, 紧密贴合制备点样室。 点样本总大小为8 cm× 2.5 cm, 共8个阵列, 每个阵列直径为3 mm。 将金纳米颗粒加至点样室进行冷冻干燥制备成SERS@Au微阵列芯片, 然后抽真空保存。 金纳米颗粒合成参考化学还原法[19], 将质量分数为0.01%的氯金酸溶液加入圆底烧瓶中, 将其置于油浴锅中装上冷凝回流装置, 搅拌加热, 加入1%柠檬酸三钠溶液后继续加热, 待冷却后装入棕色试剂瓶, 避光4 ℃条件下保存。 制备的金颗粒的平均粒径约为(60± 12) nm, 在535 nm吸光度最大。 氯金酸(分析纯)和柠檬酸三钠(99%)购自国药集团化学试剂有限公司。
实验中所用的金黄色葡萄球菌(Staphylococcus aureus)、 大肠杆菌(Escherichia coli)、 铜绿假单胞菌(Pseudomonas aeruginosa)和表皮葡萄球菌(Staphylococcus epidermis)菌株来自于中国普通微生物菌种保藏管理中心。 LB培养基和琼脂购于北京奥博星生物技术有限责任公司。
将上述四种菌株在LB固体培养基上进行培养8~10 h, 长出针尖大小即可挑取单菌落进行检测, 取2 μ L无菌水加至点样室混匀, 并放置在便携式拉曼光谱仪的激光探头下进行检测。 采用便携式拉曼光谱仪的大小为42 cm× 32 cm× 18 cm, 激发波长为785 nm, 激光功率为250 mW, 积分时间设为20 s, 积分次数设为1, 平滑系数设为3。
将微量毛细管放置于下眼睑, 待眼睛轻微湿润, 采集5~10 μ L泪液置PCR管4 ℃保存备用。 取10 μ L加标金黄色葡萄球菌和大肠杆菌的泪液置于90 μ L LB液体培养基中充分混匀, 涂布于LB固体培养基, 37 ℃培养。 待菌落长至针尖大小, 随机挑取单菌落至点样室内, 滴加1~2 μ L无菌水充分混合, 进行拉曼光谱检测, 方法同上。 同时, 待测菌株使用革兰氏染色试剂盒进行染色鉴定。
对原始数据进行去除宇宙射线、 基线校正和平滑处理, 取400~1 800 cm-1导入SIMCA14.1软件进行正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis, OPLS-DA)。 MATLAB软件中分别对光谱数据进行迭代训练, 其中包括参数优化等, 输出光谱数据, 将光谱数据输入到支持向量机(support vector machine, SVM)模型进行分类, 建立判别模型。 图片采用Origin 2018和MATLAB绘制。
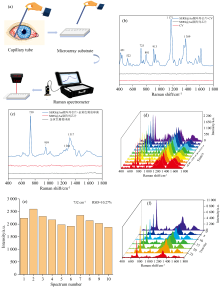
本研究开发了一种SERS@Au微阵列芯片[图1(a)], 该芯片点样室直径为3 mm, 适用于微量样品检测, 与便携式拉曼光谱仪配套使用, 具有便携、 快速、 现场检测的特点。 对SERS@Au微阵列芯片的增强效果、 重现性、 稳定性进行评价, 以结晶紫(crystal violet, CV)和金黄色葡萄球菌作为目标物, 检测发现CV和金黄色葡萄球菌的拉曼信号被显著增强[图1(b, c)]。 根据公式(EF=ISERS· cvol/IRS· csurf), 比较CV的普通RS信号和SERS信号, 计算出本文开发的基底增强因子达到5.39× 109。 随机抽取10批次SERS@Au微阵列芯片进行金黄色葡萄球菌检测, 不同批次间的信号强度一致[图1(d)]。 选取732 cm-1处特征峰强度计算相对标准偏差值(RSD), 结果为10.27%[图1(e)], 证明不同批次的SERS芯片具有良好的重现性和稳定性。 该芯片保存一定时间后仍然能够检测到被测物的信号。 如图1(f)所示, 每隔5 d收集被测物的SERS信号, 发现在30 d内金黄色葡萄球菌的信号强度虽有下降, 但指纹信息仍然清晰可见, 特征峰峰型及峰位无改变, 说明采用该芯片检测细菌的指纹信息结果可稳定保存一段时间, 便于临床检测结果的数字化存储及信息追溯。
金黄色葡萄球菌、 铜绿假单胞菌、 表皮葡萄球菌和大肠杆菌等为细菌性结膜炎常见致病菌[5, 6]。 采用SERS@Au微阵列芯片检测四种致病菌的拉曼信号, 每种细菌至少选取50组样本进行检测, 研究结果发现, 四种致病菌在400~1 800 cm-1波段具有拉曼特征信号[图2(a)]。 从拉曼图谱可以直观看到不同细菌具有不同的拉曼特征表型。 尽管, 金黄色葡萄球菌和表皮葡萄球菌峰型较为相似, 却仍有不同。 其中金黄色葡萄球菌的最强拉曼峰出现在732, 959和1 266 cm-1, 表皮葡萄球菌的特征峰主要为733, 960, 1 232和477 cm-1[图2(a)]。 表皮葡萄球菌在477, 1 232和1 579 cm-1有着不同于金黄色葡萄球菌的特征峰。 表皮葡萄球菌在477 cm-1波段的振动推测是谷氨酸[20], 730 cm-1归属于N-乙酰胞壁酸和N— H振动[21]。 大肠杆菌与铜绿假单胞菌的特征峰与葡萄球菌明显不同, 大肠杆菌的最强拉曼峰为722, 754, 1 001 cm-1, 分别属于腺嘌呤[22]或糖苷环振动、 吡咯杂环[23]、 苯丙氨酸[24]。 铜绿假单胞菌的主要拉曼峰出现在861, 1 096和1 222 cm-1, 分别归属于酪氨酸[25]、 C— C或C— O振动[26]、 酰胺Ⅲ [27]等。 四种致病菌的其他拉曼特征峰及归属详见表1。
| 表1 四种细菌性结膜炎相关致病菌的拉曼特征峰及归属 Table 1 Raman characteristic peaks of four bacterial conjunctivitis-related pathogens and the assignments |
图2(a)可以直观看出不同细菌具有独特的的拉曼特征表型, 可能是由于不同种类的细菌具有各自特有的细胞壁组成及代谢产物。 为了进一步提高分类的准确性和客观性, 同时使用SVM和OPLS-DA对四种病原菌进行建模分析与鉴定。 SVM是一种有监督算法, 通过构建一个最优的超平面将不同类别的数据点分开, 具有准确性高、 误差率低和可解释性等优点。 将光谱数据随机打乱, 70%数据设置为SVM模型训练集, 30%为测试集, 经数据归一化、 函数优化和算法优化得到SVM最佳参数, 结果如图2(a— f)所示, SVM模型训练集的准确率为100%[图2(c)], 迭代50次后[图2(b)], 预测集的准确率达到97%[图2(d)]。 说明通过SVM建模能够客观、 准确地区分四种致病菌。
OPLS-DA为偏最小二乘判别分析方法, 基于偏最小二乘回归模型(OPLS)来寻找可以有效区分样品组别的线性组合变量, 并通过判别分析将其转化为分类结果, OPLS-DA在保留原始变量同时减少噪声的影响。 OPLS-DA模型的分析结果如图2(e, f)所示, 选取三个主成分, 绘制散点图, 同一菌株的信息聚集, 说明拉曼信号的重复性良好; 不同致病菌分布在不同的区域, 说明四种致病菌之间的差异明显, 能够被很好地区分开[图2(e)]。 OPLS-DA模型自变量拟合指数(
所构建了SVM和OPLS-DA两种分类模型, 准确率均不小于90%, 在双控验证下, 大大提高了对不同菌株区分的可靠性和准确度, 验证了自主研发的SERS@Au微阵列芯片在细菌快速检测和鉴别中具有良好的可行性。
泪液中细菌较为复杂, 往往不是单一菌种的感染, 因此增加了检测难度。 采用泪液加标的方式, 通过简单的培养(< 10 h), 待出现针尖大小菌落, 如图3(a)所示, 从中随机选取20个菌落进行编号并SERS检测, 结果如图3(b, c)所示, 其中2、 3、 6、 8、 11、 12、 14、 16、 18和20号菌落具有相似的图谱(A组), 该组图谱与大肠杆菌的标准图谱相似[图2(a)和图3(b)]。 菌落1、 4、 5、 7、 9、 10、 13、 15、 17和19号(B组)的特征信号与金黄色葡萄球菌的标准图谱相似[图2(a)和图3(c)]。 将上述20组光谱数据放入OPLS-DA模型进行判别分析, 结果如图3(d)所示, 未知菌落A组落在大肠杆菌所处区域, 未知菌落B组与金黄色葡萄球菌所处区域重合。 通过革兰氏染色, 未知菌落组A镜检结果为杆状革兰氏阴性菌, 未知B组为球菌、 革兰氏阳性细菌。 SVM模型分析结果与OPLS-DA相一致, 分类准确率达到97.2%[图3(e)]。
拉曼光谱结合机器学习的方法为无标记检测, 无需选择鉴定培养基, 对患者无损, 全程仅需12 h即可出结果, 因此大大降低了人力和物力成本, 大大缩短了检测时间, 在临床检测方面具有潜在的应用价值。
研究开发了一种新型的SERS@Au微阵列芯片, 通过收集患者泪液进行SERS检测, 仅需简单培养即可快速、 准确、 便捷、 无损地筛查致病菌, 减少患者的痛苦, 结合SVM和OPLS-DA模型能够准确识别细菌性结膜炎常见病原菌种类, 大大提高了临床检测效率。 通过加标模拟实验结合简单的分离培养, 待长出针尖大小的菌落进行SERS检测, 无需标记、 无需鉴定培养基、 对患者无损, 即可实现对复杂生物样本的混合感染进行快速的多重检测。 采用简单分离培养的方法从取样、 培养、 检测、 分析到出结果全程仅需12h, 通过SVM和OPLS-DA模型进行鉴定, 准确率均大于90%, 证明该方法结果可靠。 利用开发的新型SERS@Au微阵列芯片, 采用简单培养SERS检测和多元统计分析相结合的技术手段, 适用于眼科细菌性感染疾病的快速筛查, 为开发眼科疾病的新型诊断技术提供参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|