作者简介: 吕志岩, 1988年生,山西工学院讲师 e-mail: lvzhiyan0721@163.com
萤石(CaF2)作为国家战略性矿产资源, 其高效回收面临重大挑战: 一方面与方解石等钙质矿物紧密共生, 另一方面浮选体系中金属离子(Ca2+、 Ba2+、 Fe3+)的干扰导致选择性分离效率低下。 本研究采用溶液化学计算、 zeta电位分析、 红外光谱分析(FTIR)和X射线光电子能谱(XPS)分析技术, 系统揭示金属离子调控辛基异羟肟酸(OHA)在萤石表面吸附的微观机制。 通过溶液化学计算与zeta电位分析, 表明金属离子在一定的pH值下金属阳离子优势组分通过压缩萤石颗粒表面双电子层的方式改变萤石表面zeta电位, 导致矿物表面zeta电位负值降低, 萤石表面电位调控使OHA吸附量提升。 FTIR结果表明, 经OHA处理后的萤石谱图中多处出现了OHA官能团, 说明OHA在萤石表面发生化学吸附。 经金属离子和OHA处理的萤石谱图中, 出现了—CH3、 —CH2—、 C=O、 C—N、 C—C—C、 C—O、 N—O吸收峰, 且吸收峰有所增强。 XPS深度分析揭示, 金属离子作用萤石后吸附OHA的含量都明显高于未经金属离子作用的萤石吸附OHA 的含量。 经金属离子和OHA处理萤石后, Ca(2p)的结合能偏移量变大, Ba、 Fe可取代表面Ca晶格位点, N(1s)峰强度增加, 并形成Me—O—N新型键合方式, 结合zeta电位、 FTIR以及XPS分析, 金属离子对萤石与OHA吸附效能序列: Fe3+>Ba2+>(Ca2+/Ba2+/Fe3+)≥(Ca2+/Ba2+)≥(Ca2+/Fe3+)>Ca2+。 该研究建立的“金属离子—界面—药剂”三元作用模型, 为复杂水质条件下萤石高效浮选提供了理论支撑, 所发现的晶格取代-化学吸附协同机制对新型浮选药剂设计具有重要参考价值。
As a national strategic mineral resource, the efficient recovery of fluorite (CaF2) faces major challenges: on the one hand, it is closely associated with calcareous minerals such as calcite; on the other hand, the interference of metal ions (Ca2+, Ba2+, Fe3+) in the flotation system leads to low selective separation efficiency. In this study, solution chemical calculation, zeta potential analysis, infrared spectroscopy (FT-IR), and X-ray photoelectron spectroscopy (XPS) analysis techniques were used to systematically reveal the microscopic mechanism of metal ions regulating the adsorption of octyl hydroxamic acid (OHA) on fluorite surface. It shows that the dominant components of metal cations change the surface zeta potential by compressing the double electron layer on the surface of fluorite under a certain range of pH values, resulting in a decrease in the negative zeta potential of the mineral surface, and the surface potential regulation of fluorite increases the adsorption capacity of OHA. FTIR results showed that OHA tube energy groups appeared in many places in the fluorite spectrum after OHA treatment, indicating that OHA was chemically adsorbed on the surface of fluorite. The absorption peaks of —CH3, —CH2—, C=O, C—N, C—C—C, C—O, and N—O appeared in the spectra of fluorite treated with metal ions and OHA, and the absorption peaks were enhanced. XPS depth analysis revealed that the content of OHA adsorbed by fluorite after metal ions was significantly higher than that of OHA adsorbed by fluorite without metal ions. After the treatment of fluorite with metal ions and OHA, the binding energy offset of Ca(2p) increases. Ba and Fe can replace the surface Ca lattice site, and the intensity of the N(1s) peak increases, and a new bonding mode of Me—O—N is formed. Combined with zeta potential, FTIR and XPS analysis, the adsorption efficiency sequence of metal ions on fluorite and OHA is: Fe3+>Ba2+>(Ca2+/Ba3+/Fe3+)≥(Ca2+/Ba2+)≥(Ca2+/Fe3+)>Ca2+. The ternary interaction model of “metal ion-interface-reagent” established in this study provides theoretical support for the efficient flotation of fluorite under complex water quality conditions. The synergistic mechanism of lattice substitution-chemical adsorption found in this study points out the direction for the design of new flotation reagents.
萤石(CaF2)作为关键氟源矿物, 是制备氢氟酸、 乳白玻璃及高辛烷值燃油催化剂的核心原料, 同时在陶瓷工业中具有重要应用, 已被列入国家战略性钙矿资源[1, 2, 3]。 而萤石常与稀土矿、 方解石、 重晶石等矿物伴生, 其中白云鄂博萤石矿以早期萤石为主[4], 主要呈浸染状, 具有形状不均匀, 嵌布粒度细等特点, 比较难选。 为提高萤石浮选回收率, 通常采用绿色廉价抑制剂选择性抑制伴生矿物(如稀土矿、 方解石、 重晶石等)[5, 6], 或通过活化剂增强萤石可浮性[7]。 此外, 开发高效耐低温捕收剂也是提升分选性能的重要途径[8]。
在萤石浮选过程中, 工业回水所含Ca2+、 Mg2+、 Ba2+、 Fe3+和Ce3+等离子(矿物磨浮过程中因溶解/氧化产生的固有离子)难免会影响矿物可浮性[9]。 其中, Ba2+、 Ca2+和Fe3+等离子浓度超标时, 将对浮选过程产生显著活化或抑制效应[10, 11]。 金属离子在浮选中的作用机理主要涉及: 物理/化学吸附、 络合物沉淀吸附、 与药剂发生表面反应以及矿物表面离子交换及晶格取代。 宁江峰等[12]研究表明, Zn2+与水玻璃协同作用可选择性抑制方解石, 显著提升萤石-方解石浮选分离效率。 另外, 金属离子与浮选药剂形成的金属-药剂络合物可调控矿物可浮性。 例如, Pb2+在pH 6~8条件下与水杨酰异羟肟酸(SHA)形成Pb-SHA络合物, 可显著活化钛铁矿浮选[13]。 又如, Fe3+与BHA捕收剂形成的Fe-BHA络合物可显著增强其在钛铁矿表面的吸附效能[14]。 在酸性条件下, Ca2+则容易和脂肪酸类等捕收剂生成难溶物, 降低浮选效果。 例如, 在蓝晶石-SDS浮选体系中, Ca2+与十二烷基磺酸钠(SDS)反应生成难溶沉淀, 导致浮选效率显著降低[15]。 而对于矿物浮选吸附机理, 通常采用FTIR、 XPS进行分析[16, 17], 从矿物表面官能团的变化、 特征峰的强弱及波数的红移; 以及XPS 可用于定性分析以及半定量分析, 一般从XPS图谱的峰位和峰型获得样品表面元素成分、 化学态和分子结构等信息, 从峰强可获得样品表面元素含量或浓度, 判定吸附的活性位点以及吸附的强弱。
因此, 本文针对萤石浮选过程中的金属离子, 采用萤石纯矿物进行Zeta电位分析, 基于浮选溶液化学计算, 重点利用FTIR、 XPS分析揭示复杂金属离子体系中(Ba2+、 Ca2+、 Fe3+)对萤石浮选的作用机理, 从而为萤石浮选生产工艺以及药剂研发提供理论依据。
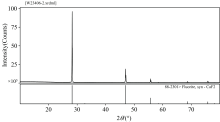
萤石纯矿物取自白云鄂博萤石矿床, 为浅紫色透明的萤石块状晶体, 制备方式为: 在矿山挑选出的含萤石晶体的大块矿敲碎后, 经过弱磁、 强磁、 摇床重选、 人工淘洗等方法, 得到高纯度的单矿物, 再将萤石晶体中结晶好的选出来, 通过显微镜, 我们成功提取了萤石的高纯度矿物。 采用玛瑙研磨机对矿物进行研磨, 经过精细的干筛分离, 这些颗粒被妥善存放于宽口瓶中, 以便于后续实验的使用。 部分矿样经过玛瑙研钵的进一步细磨, 制得-5 μ m的颗粒样品, 以供FTIR和XPS分析使用。 萤石的XRD谱图见图1, 从图1可以看出, 萤石的XRD峰与标准卡片的峰高完全一致, 未见杂峰, 充分证明了所用萤石的高纯度。 表1中显示, 萤石样品的钙含量高达51.12%, 氟含量为48.48%, 这一系列数据表明, 所有试验所用的萤石纯矿物样品的纯度均超过95%, 完全符合检测标准, 且与理论计算的钙和氟含量相吻合。
| 表1 萤石矿物的化学多元素分析 Table 1 Chemical multielement analysis of fluorite minerals |
盐酸和氢氧化钠用作pH值调整剂, 来自西安(中国)。 氯化钙(CaCl2)、 氯化钡(BaCl2)、 三氯化铁(FeCl3)在试验中用作表面改性剂, 来自连云港(中国)。 辛基异羟肟酸(OHA)用作捕收剂, 纯度为99.9%, 来自天津(中国)。 使用的化学品均为分析纯, 所有试验均采用mil-9水系统制备的Ⅰ 型去离子水, 电阻率为18.2 MΩ · cm。
1.2.1 Zeta电位试验与分析
在行星研磨机上将萤石纯矿物研磨至-5 μ m进行电位试验。 电解质为1× 10-3 mol· L-1 NaCl溶液。 矿样加入后, 先用HCl和NaOH调节溶液的pH值。 以确保颗粒悬浮, 测量加入捕收剂前后的不同pH条件下矿物表面的Zeta电位。 然后使用NanoBrook 90Plus Zeta粒径分析仪(Brookhaven Instruments, USA)进行Zeta电位测量。 所有试验均重复3次。
1.2.2 傅里叶变换红外光谱(FTIR)测量及分析
将纯矿物研磨至-5 μ m进行FTIR测试。 调节程序与用于浮选试验的程序相似。 浮选后, 样品离心, 过滤上清液, 然后重复冲洗三次, 以去除任何残留或物理吸附的捕收剂。 采用VT-70傅里叶变换红外光谱仪进行了FTIR测试。 纯矿物样品和溴化钾在40 ℃真空干燥24 h, 纯矿物样品与溴化钾比例为1:200, 进行充分研磨混合, 采用压片机进行压片, 压片被直接放置在视窗上。 分析范围为4 000~400 cm-1, 使用32次扫描, 分辨率为2 cm-1, FTIR光谱在室温下测试。 利用原始软件的绘图对FTIR结果进行分析。
1.2.3 X射线光电子能谱(XPS)测量及分析
实验使用的XPS检测装置为Kratos AXIS Ultra XPS系统, 配备单色Al X射线源(工作在150 W, 能量分辨率为0.48 eV (Ag 3d5/2), 误差值为0.05 eV)。 然后将2 g样品放入烧杯中, 加入去离子水35 mL。 调整pH值并加入合适的试剂后, 悬浮液调节30 min。 随后, 固体样品从悬浮液中离心分离, 用与反应处理相同pH值的去离子水洗涤3次。 最后, 样品在真空下60 ℃干燥1 h, 然后进行XPS分析。 每个样品在XPS测试中测试了足够的次数, 以确保数据在± 0.005 eV 内。
实验条件为: 每次测量从0~1 350 eV开始, 停留时间为8 s, 带通能量为150 eV, 步长为1 eV。 对于高分辨率扫描, 增加扫描次数, 将停留时间降低到0.5 s, 将带通能量调整到30 eV。 最后所得数据利用Advantage 6.0软件进行拟合峰。
根据Ca2+的性质可知, 其溶液中可生成沉淀氢氧化钙, 因此Ca2+在溶液中存在均相和多项体系两种体系平衡, 已知Ca2+浓度c=2× 10-4 mol· L-1, Ba2+浓度c=2× 10-4 mol· L-1, Fe3+浓度c=1× 10-4 mol· L-1, OHA浓度c=1× 10-4 mol· L-1, 金属离子在水作用后形成各种羟基络合物, OHA捕收剂在水溶液作用后, 形成OHA分子形态和离子形态, 通过溶液平衡关系可以得出各种组分的浓度。
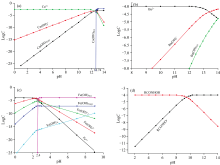
由图2可以看出, 在水溶液中, 随着pH值的升高, Ca2+分别以Ca2+、 Ca(OH)-、 Ca(OH)2(aq)的形式存在。 当pH值小于12.74时, 主要以Ca2+、 Ca(OH)+形式存在, 且溶液中的Ca(OH)+浓度随着pH值的升高而逐渐增大, 到pH值等于-12.74时达到最大。 pH值大于12.5, 溶液中Ca2+、 Ca(OH)+减少, 主要以Ca(OH)2(S)沉淀存在。 Fe3+的水解组分存在形式是多样的。 当pH值小于2.4时, 铁离子主要以Fe3+、 Fe(OH)2+和Fe(OH)+的形式存在, 并且随着pH值的升高, Fe3+、 Fe(OH)2+和Fe(OH
图3显示了在OHA捕收剂(5× 10-4 mol· L-1)中Ca2+(3× 10-4 mol· L-1)、 Ba2+(2× 10-4 mol· L-1)、 Fe3+(2× 10-5 mol· L-1)、 Ca2+/Fe3+(3× 10-4 mol· L-1/1× 10-5 mol· L-1)、 Ca2+/Ba2+(3× 10-4 mol· L-1/2× 10-4 mol· L-1)和Ca2+/Ba2+/Fe3+(3× 10-4 mol· L-1/0.5× 10-4 mol· L-1/0.5× 10-5 mol· L-1)作用萤石前后的表面zeta电位随pH的变化。
 | 图3 金属离子对萤石表面zeta电位的影响 (a): 单一金属离子; (b): 混合金属离子Fig.3 The effect of metal ions on the zeta potential of fluorite surface (a): Single metal ions; (b): Mixed metal ions |
由图3可知, 金属离子对萤石表面电位随着pH的变化有较大的影响。 萤石在纯水中的零电点pH值为7.2, 当pH值小于7.2, 萤石表面带正电, 当pH值大于7.2, 萤石表面带负电。 当萤石与OHA作用后, 萤石表面的电位全部为负电荷, 其萤石负电荷显著增加, 这是萤石表面吸附了带负电的OHA阴离子, 使其zeta电位向负方向移动的结果。 当单一金属离子Ca2+、 Ba2+、 Fe3+作用和混合金属离子Ca2+/Fe3+、 Ca2+/Ba2+、 Ca2+/Ba2+/Fe3+与萤石表面后, 使萤石表面的负电荷向正方向移动, 尤其是混合金属离子影响萤石表面负电荷移动的幅度较大, 如图3(b)所示。 这可能是在磨矿时, 萤石表面的晶格遭到破坏, 表面Ca— F键发生断裂, 造成表面电荷不平衡, 当加入金属离子, 萤石表面的断裂键得到补偿, 增加萤石表面的正电荷。 随着pH值的增大, 金属阳离子在水溶液中优势组分浓度增大, 而优势组分通过压缩萤石颗粒表面双电子层的方式改变萤石表面zeta电位, 导致矿物表面zeta电位负值降低。 当pH值小于零电点时, 萤石本身表面带正电, 此时, 带负电的OHA离子能吸附在萤石表面, 这是电性吸附, 但吸附至萤石表面呈中性后, 萤石本身带负电, 此时带负电的OHA离子克服静电斥力仍能继续吸附, 直到萤石表面呈现负值最大, 这是化学吸附, 即化学亲和力大于电性斥力。 而金属离子的加入, 带负电的OHA离子克服静电斥力的能力增大, 导致萤石表面吸附OHA的含量增多。 因此, 单一金属离子Ca2+、 Ba2+、 Fe3+作用和混合金属离子(Ca2+/Fe3+)、 (Ca2+/Ba2+)、 (Ca2+/Ba2+/Fe3+)会促进萤石吸附OHA。
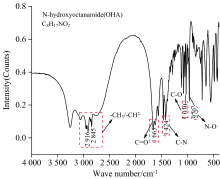
为了进一步探明金属离子对OHA吸附萤石的表面作用的官能团和吸附强度, 分别对不同类别的金属离子在矿物表面作用前后进行了FTIR分析, 金属离子在萤石表面的红外光谱的试验条件与zeta电位的试验条件是一致的, pH值为8, 结果如图4和5所示。 图4为OHA捕收剂的红外光谱。 图5(a)是单一金属离子在萤石与OHA作用前后的红外光谱, 图5(b)是混合金属离子在萤石与OHA作用前后的红外光谱。
由图4可知, OHA捕收剂的红外光谱中[18], 3 000~2 800 cm-1处出现了OHA的甲基(— CH3)、 亚甲基(— CH2— )的伸缩吸收峰, 1 665 cm-1处出现了C=O伸缩振动吸收峰, 1 424 cm-1处出现了C— N伸缩吸收峰, 1 078 cm-1处出现了C— C— C面内摇摆振动吸收峰, 1 030 cm-1处出现了C— O伸缩振动吸收峰, 970 cm-1处出现了N— O伸缩吸收峰。
如图5(a)所示, 纯萤石在红外光谱的测定下有两个峰, 在1 627 cm-1处是氟化物的特征峰[18], 在3 432 cm-1处是样品中的水分子的— OH官能团, 此外, 无其他特征峰。 经OHA处理后的萤石出现了多处峰, 在2 974.2和2 925 cm-1处出现了— CH3、 — CH2— 吸收峰, 1 457 cm-1处出现了C— N的吸收峰, 在1 089.7~879.5 cm-1处出现了C— C— C、 C— O、 N— O吸收峰, 均为OHA的特征峰, 说明OHA在萤石表面发生吸附作用。 经Ca2+和OHA处理的萤石, 在2 919.2 和2 849.8 cm-1处出现了— CH3、 — CH2— 吸收峰, 而在其他范围没有出现OHA的特征峰, 但— CH3、 — CH2— 吸收峰有所增强; 在Ba2+和OHA处理的萤石谱图中, 除了出现有机峰, 在1 606.6 cm-1处出现了C=O吸收峰, 在1 072.4和977.9 cm-1处出现了C— C— C和N— O吸收峰, 这些也是OHA的特征峰, 此外, 有机峰出现了比Ca2+处理萤石时有显著的增强; 当Fe3+和OHA处理萤石时, 谱图中出现了有机峰在2 958.7~2 856.5 cm-1, 在1 612.4 cm-1处出现了C=O吸收峰; 分析说明, 金属离子的加入, 影响了萤石吸附OHA, 且吸附强度有所变化, 金属离子对萤石表面吸附OHA的强度大小为Fe3+Ba2+Ca2+。
如图5(b)所示为混合金属离子处理萤石后吸附OHA的红外光谱图。 经Ca2+/Fe3+和OHA处理萤石的红外光谱图, 有机峰出现在2 974.2~2 927.9 cm-1处, 在1 608.6和1 516 cm-1处出现了C=O和C— N吸收峰, 在1 098.7~881.4 cm-1处出现了C— C— C、 C— O、 N— O吸收峰, 这些峰都是OHA官能团的特征峰。 同样在Ca2+/Ba2+、 Ca2+/Ba2+/Fe3+处理萤石后吸附OHA的红外光谱图中这些特征峰有体现, 只是发生了红移, 说明其混合金属离子的种类不同, 作用方式也是不同的。 同样从有机峰— CH3、 — CH2— 官能团的峰强上比较三种金属离子作用强度, 可以看出混合金属离子对萤石吸附OHA能力大小为: (Ca2+/Ba2+/Fe3+)> (Ca2+/Ba2+)> (Ca2+/Fe3+)。 说明在混合金属离子作用于萤石表面后, 金属离子发生了协同效应, 共同活化萤石表面, 易于萤石的浮选。
图6为金属离子和OHA捕收剂作用前后的萤石XPS全谱图, 其实验条件与zeta电位的试验条件是一致的, pH值为8。
 | 图6 金属离子和OHA捕收剂作用前后的萤石XPS全谱图 (a): 单一金属离子; (b): 混合金属离子Fig.6 Full XPS spectra of fluorite before and after the interaction of metal ions and OHA collectors (a): Single metal ions; (b): Mixed metal ions |
图6(a)为单一金属离子在萤石吸附OHA作用前后的XPS全谱, 图5(b)为混合金属离子在萤石吸附OHA作用前后的XPS全谱, 表2表示药剂作用前后的萤石表面的不同原子浓度。 由图6(a)— (b)可知, 药剂作用之后的萤石表面出现了N元素, 经单一金属离子作用后出现Ca、 Ba、 Fe元素, 同时混合金属离子作用后, 萤石同时出现两种金属离子元素, 具体见表2可知。 从表2可知, 经OHA作用后的萤石表面N元素为0.96%, 经Ca2+、 Ba2+、 Fe3+作用之后的萤石表面N元素为1.28%、 3.28%、 2.58%, 经Ca2+/Fe3+、 Ca2+/Ba2+、 Ca2+/Ba2+/Fe3+作用之后的萤石表面N元素为2.29%、 2.31%、 2.44%, 可以看出经过单一金属离子作用后萤石表面的N浓度明显高于未经过金属离子作用的, 而混合金属离子作用后的萤石明显低于未经过金属离子作用的萤石。 说明混合金属离子作用在萤石后, 过多的金属离子发生竞争吸附, 不利于萤石浮选。 但总体上可以看出, 无论是单一金属离子还是混合金属离子活化萤石后吸附OHA的含量都明显高于未经金属离子活化的萤石吸附OHA 的含量。
| 表2 金属离子和OHA捕收剂作用前后的萤石表面的不同原子浓度 Table 2 Different atomic concentrations of fluorite surface before and after the action of metal ions and OHA collectors |
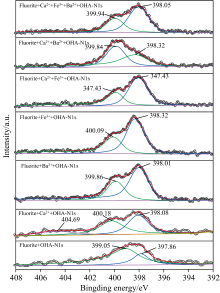
图7为萤石经药剂作用前后的Ca(2p)元素窄谱图, 药剂作用之前的萤石表面的Ca(2p)轨道峰可以拟合出两个峰, 347.13 eV处是Ca(2p)3/2的特征峰, 350.68 eV是Ca(2p)1/2的特征峰[19]。 经OHA处理后的萤石Ca(2p)的结合能发生了偏移, Ca(2p)偏移了0.26 eV, 说明捕收剂OHA在萤石表面Ca位点发生了吸附。 经金属离子和OHA处理萤石后, Ca(2p)的结合能偏移量更大, 偏移量为0.28~0.53 eV, 说明金属离子的加入, 使Ca(2p)的偏移量变大, 其中Fe3+处理萤石后表面Ca(2p)的偏移量最大, 从表2中也可以说明这一点。 说明Fe3+作用在萤石上, 替代了萤石表面Ca元素晶格位置, 成为萤石表面的吸附位点, 同样其他金属离子也是一样的原理, 形成Me— O— N新型键合方式。 从Ca(2p)轨道峰的光电子强度可以看出, 随着金属离子的加入, Ca(2p)轨道峰的光电子强度降低了, 原因可能是金属离子和OHA吸附在萤石表面, 造成表面的Ca相对浓度降低。
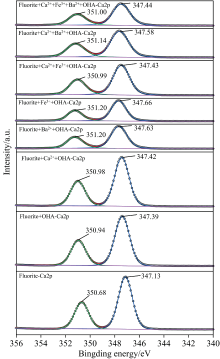 | 图7 药剂作用前后萤石表面Ca元素窄谱区扫描拟合图谱Fig.7 The narrow-band scanning fitting spectrum of Ca element on the surface of fluorite before and after the action of reagent |
图8为OHA和金属离子处理后表面N元素窄谱区扫描拟合图谱。 经OHA处理的萤石表面N(1s), 可以看出出现两个拟合峰, 在399.05 eV归属于有机氮的峰, 在397.86 eV 处是金属氮的峰, 这可能是OHA中的氮原子的孤电子对萤石表面的Ca原子形成金属螯合物, 因此在397.86处可能是N— Ca 。 而通过添加Ca2+和OHA后, 萤石表面的N(1s)拟合峰发生了偏移, 其中金属氮的峰光电子强度增加, 说明萤石矿浆中添加Ca2+后, 会影响萤石与OHA的吸附方式, 增加了金属离子与OHA的吸附量, 形成Me— O— N新型键合方式, 同样其他金属离子的添加也会影响规律, 如图8所示。 原因是, 无论是单一金属离子Ba、 Fe还是混合金属离子Ca2+/Fe3+、 Ca2+/Ba2+、 Ca2+/Ba2+/Fe3+都会吸附在萤石表面, 与萤石表面断裂的F— 成键, 达到萤石表面电性平衡, 而吸附在表面的金属离子与OHA形成金属螯合物, 进而促进萤石表面N元素浓度的增多。 通过比较金属离子对萤石与OHA吸附量的影响, 得出以下吸附能力顺序: Fe3+> Ba2+> (Ca2+/Ba2+/Fe3+)≥ (Ca2+/Ba2+)≥ (Ca2+/Fe3+)> Ca2+, 这与表2可以相互应征。 说明混合金属离子可能发生竞争吸附, 影响萤石吸附OHA。
研究了Ca2+、 Ba2+、 Fe3+对以辛基异羟肟酸浮选萤石的影响, 通过各药剂的溶液化学计算、 zeta电位分析、 FTIR和XPS得出如下结论。
(1)OHA吸附使萤石表面带负电。 金属离子(Ca2+、 Ba2+、 Fe3+)及其混合体系(Ca2+/Fe3+、 Ca2+/Ba2+、 Ca2+/Ba2+/Fe3+)显著降低萤石表面负zeta电位(混合离子作用更强)。 随pH升高, 金属阳离子优势组分浓度增加, 通过压缩双电层降低zeta电位负值。 同时, 这减弱了带负电OHA离子与萤石表面的静电斥力, 增强了OHA的化学吸附。 单一及混合金属离子均促进萤石对OHA的吸附。
(2)FTIR分析表明, OHA在萤石表面发生化学吸附(特征官能团峰出现)。 金属离子增强吸附, 单一离子: Fe3+≥ Ba2+> Ca2+(— CH3、 — CH2— 峰增强)。 混合离子显著增强多种OHA官能团峰(— CH3, — CH2— , C=O, C— N等), 作用强度为Ca2+/Ba2+/Fe3+> Ca2+/Ba2+> Ca2+/Fe3+。 混合金属离子产生协同效应, 共同活化萤石表面, 显著促进OHA化学吸附, 有利于萤石浮选。
(3)XPS分析表明, 金属离子显著提升萤石对OHA的吸附量(均高于无离子处理)。 吸附机制为OHA通过Ca位点吸附(Ca(2p)结合能偏移); 金属离子(Ba2+, Fe3+)替代表面Ca晶格, 成为新吸附位点(进一步增大Ca(2p)偏移); 形成 Me— O— N新型键合(N(1s)峰偏移且强度增加)。 吸附能力顺序: Fe3+> Ba2+> (Ca2+/Ba2+/Fe3+)≥ (Ca2+/Ba2+)≥ (Ca2+/Fe3+)> Ca2+(混合离子具协同作用)。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|