作者简介: 王 岩, 1999年生,太原理工大学硕士研究生 e-mail: 962101213@qq.com
有色溶解性有机质(CDOM)的污染特征解析对揭示水体碳氮循环机制、 评估富营养化风险及制定精准防控策略具有重要意义。 针对半干旱流域面源污染分散输入、 源汇关系复杂的现状, 本研究以汾河水库上游流域为对象, 采用三维荧光光谱技术(EEM), 结合荧光区域积分法(FRI)和平行因子分析(PARAFAC)模型, 系统解析了夏秋两季36个干支流断面CDOM的组成、 来源及时空分异规律。 结果表明: 流域内CDOM包含五类特征峰, 其中类腐殖质(A、 M、 C峰)主导农业面源污染, 类蛋白峰(T、 B峰)显著表征生活污水与畜禽养殖废水输入。 FRI分析显示, 夏季类腐殖质占比达58.28%; 秋季类腐殖酸占比骤降至19.37%, 类富里酸(29.80%)与色氨酸类蛋白(28.28%)占比上升。 PARAFAC模型提取出三类组分: 类腐殖质C1(Ex/Em=255(315)/415 nm)、 C2(Ex/Em=255(360)/470 nm)及类蛋白C3(Ex/Em=225(280)/340 nm); 流域CDOM组成以类腐殖质类物质为主导, 秋季类蛋白质类物质占比升高。 荧光参数(FI、 HIX、 BIX)进一步验证了CDOM季节分异机制, 夏秋两季都以陆源输入为主, 秋季微生物活动贡献增强。 研究结果为半干旱流域水质动态监测与面源污染精准管控提供了科学依据。
The pollution characteristics of chromophoric dissolved organic matter (CDOM) are of great significance for revealing the carbon and nitrogen cycling mechanisms in water bodies, assessing the risk of eutrophication, and formulating precise control strategies. In view of the current situation of diffuse input of non-point source pollution and complex source-sink relationships in semi-arid basins, this study took the upper reaches of the Fenhe Reservoir as the research object. It used three-dimensional fluorescence spectroscopy (EEM) combined with fluorescence region integration (FRI) and parallel factor analysis (PARAFAC) models to systematically analyze the composition, sources, and spatiotemporal differentiation patterns of CDOM at 36 dry and tributary sections in summer and autumn. The results showed that CDOM in the basin contained five characteristic peaks, among which the humic-like peaks (A, M, and C peaks) dominated agricultural non-point source pollution, and the protein-like peaks (T and B peaks) significantly indicated the input of domestic sewage and livestock and poultry breeding wastewater. FRI analysis indicated that the proportion of humic-like substances reached 58.28% in summer; in autumn, the proportion of humic acid-like substances dropped sharply to 19.37%, while the proportions of fulvic acid-like (29.80%) and tryptophan-like protein (28.28%) substances increased. The PARAFAC model extracted three components: humic-like C1 (Ex/Em=255(315)/415 nm), C2 (Ex/Em=255(360)/470 nm), and protein-like C3 (Ex/Em=225(280)/340 nm); humic-like substances dominated the composition of CDOM in the basin, and the proportion of protein-like substances increased in autumn. Fluorescence parameters (FI, HIX, BIX) further verified the seasonal differentiation mechanism of CDOM, with land-based input being the main source in both summer and autumn, and the contribution of microbial activity increasing in autumn. The research results provide a scientific basis for dynamic water quality monitoring and precise control of non-point source pollution in semi-arid basins.
有色溶解性有机质(colored dissolved organic matter, CDOM)作为水体溶解性有机质(DOM)的重要组成部分, 其荧光特性可有效表征水体组成特征[1, 2]。 是一类广泛存在于自然水体中的可溶性有机化合物, 这类由富里酸、 腐殖酸、 芳烃聚合物等成分构成的复杂有机化合物在水环境保护和水域生物地球化学研究中具有极其重要的价值。 三维荧光光谱技术(excitation-emission-matrix spectra, EEM)能够同时获取激发和发射波长信息, 有效地揭示水体中CDOM的组成信息[3]。 三维荧光激发-发射矩阵(EEM)与平行因子分析(parallel factor analysis, PARAFAC)技术相结合, 实现混合有机物的化学信号分离与半定量表达[4]。 此外, 荧光区域积分法(fluorescence fegional integration, FRI)通过划分EEM谱图特征区域, 可量化解析CDOM的组分异质性[5, 6]。 这两种方法已成为研究水环境中溶解性有机物动力学特征的关键工具。
当前研究表明, 干流CDOM的组成结构及迁移转化行为显著受控于支流输入过程; 系统解析支流入河口CDOM的荧光光谱指纹信息, 阐明其荧光组分特异性、 污染溯源指示功能及DOM分子示踪潜力, 可为揭示流域尺度溶解性有机物的生物地球化学循环机制提供重要理论支撑。 当前水体CDOM荧光特征研究主要集中于典型水生环境(湖泊、 海洋、 海湾、 河口)以及中东部高有机污染负荷流域的河流系统。 值得注意的是, 针对半干旱区内陆性河流体系的CDOM环境行为研究仍显薄弱, 尤其是具有典型区域特征的汾河上游流域, 其支流水体CDOM荧光指纹与干流水质参数的耦合机制尚未形成系统性研究成果。
本研究选取汾河水库上游为典型区域, 在分析支流入河口水体CDOM污染浓度与荧光强度相关关系的基础上, 了解和掌握入河水体CDOM荧光光谱基本特征, 采用平行因子分析和荧光区域积分技术分析其CDOM荧光物质组分组成、 类型; 并就入河水体CDOM的光学特征参数对污染物的指征特性进行探讨, 以期为进一步深入分析内陆河流DOM特征及迁移转化规律提供科学依据, 同时也可为流域污染管控提供技术支撑。
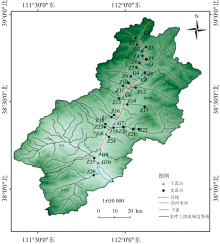
汾河水库上游流域, 起于河源, 止于汾河水库入口, 长约128 km, 流域面积5 268 km2, 属于山区性河流。 流域为温带大陆性季风气候, 年均气温在6~13 ℃之间; 年均降水量494.2 mm, 75%以上集中在6月— 10月。 流域内支流众多, 季节性断流明显, 较大支流有中马坊河、 东碾河、 岚河、 涧河。 其中, 上游干流从头马营段到水库入口的81.2 km河道, 是万家寨引黄工程南干线的输水通道, 水质总体达Ⅱ 类标准。
流域内约80%的土地为草地、 灌丛、 森林等自然生态系统。 研究流域内近90%左右耕地集中于地势较平坦的岚县, 其余耕地沿汾河河道两侧呈山区旱地分布。 干流沿岸城镇化率仅为38%, 城镇扩展对土地利用和生态环境影响有限; 受限于严格环保制度, 工业污染源较少。 因此, 流域内主要污染源为农业面源、 畜禽养殖和农村分散式雨污混排等。
为揭示汾河水库上游流域CDOM组成的典型季节性差异及其驱动机制, 本研究选择在夏季(8月)和秋季(11月)进行两次采样。 研究区域75%以上的年降水量集中在6月— 10月, 夏季(8月)处于丰水期和汛期, 同时高温也显著影响微生物活性; 秋季(11月)进入旱季, 降水量锐减, 支流季节性断流现象显现, 陆源输入通量降低, 水温下降抑制微生物活动。 对比分析夏秋两季, 有助于深入理解自然水文过程(降雨径流)和气候条件(温度)对半干旱流域CDOM来源、 组成及迁移转化规律的调控作用。
设置采样点36个, 其中以雷鸣寺G1为起点, 娄烦县湿地公园G10为终点, 自北向南设置10个干流采样点, 采集汾河水样(图1); 选择常年有水的支流设置26处支流采样点(N1— N26)。 采样时, 以有机玻璃采水器采集河道水面下0.5 m处的水样; 采集后以便携式测定仪现场测定水温、 溶解氧、 pH值、 电导率, 其余水样在4 ℃冷藏条件下运回实验室保存。
实验室内采用碱性过硫酸钾消解-紫外分光光度法测定总氮(TN); 硝酸盐氮(
采用荧光区域积分法对水样中DOM的各区域荧光积分强度进行积分, 以不同的激发/发射波长将溶解性有机物的荧光区域分成5个部分[6], 分别为区域Ⅰ : Ex=200~250 nm/Em=280~330 nm的酪氨酸类蛋白区; 区域Ⅱ : Ex=200~250 nm/Em=330~380 nm的色氨酸类蛋白区; 区域Ⅲ : Ex=200~250 nm/Em=380~550 nm的紫外区类富里酸; 区域Ⅳ : Ex=250~380 nm/Em=280~380 nm的溶解性微生物代谢副产物区; 区域Ⅴ : Ex=250~450 nm/Em=380~550 nm的可见区类腐殖酸。 通过对5个区域荧光强度进行积分, 实现对CDOM的定性及半定量分析。 对EEM数据扣除空白, 按特定顺序组成三维数据阵列。
将扣除空白影响的三维荧光光谱数据按照样品编号、 Em和Ex顺序组合成三维数据阵列。 在MatlabR2018a平台上用DOMflour方法进行平行因子分析, 用“ 裂半分析和残差分析” 检验模型有效性。
2.1.1 荧光峰识别与分析
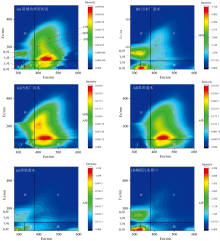
三维荧光光谱中的特征荧光峰是识别水体污染类型的关键依据。 通过Ex/Em组合及荧光强度特征, 可区分类腐殖质与类蛋白污染物来源。 分别对流域内典型河流、 城镇污水处理厂进水、 城镇污水处理厂出水、 农田退水、 养殖废水和城镇污水排口进行分析, 三维荧光光谱图如图2。
研究流域的断面样品中, 识别出五类典型特征峰: 类腐殖质 A(Em=400~460 nm, Ex=260 nm)、 M(Em=370~410 nm, Ex=290~310 nm)、 C(Em=420~460 nm, Ex=320~360 nm)峰, 以及类蛋白T(Em=320~350 nm, Ex=270~280/220~240 nm)、 B(Em=300~320 nm, Ex=270~280/220~240 nm)峰。 类腐殖质峰的出现, 表明水体中CDOM可能主要源于土壤释放, 降雨造成的水土流失会增强类腐殖质荧光强度。 而类蛋白荧光在天然水体中主要来自动植物分泌物及腐败遗体, 若其荧光峰显著且强度高, 往往意味着存在人为污染[7]。
从图2中可见, 污水处理厂进水以类蛋白质T峰和B峰为主, 出水则以类腐殖质A、 M峰为主; 农田退水以类腐殖质A峰为主; 畜禽养殖废水以类蛋白质B峰为主, 伴有类腐殖质A峰和类蛋白质T峰; 城镇污水排口以类蛋白质T峰和B峰为主, 同时存在类腐殖质A峰。 这清晰地展现出不同污染源的荧光峰特征差异。
2.1.2 FRI识别与分析
基于FRI法对汾河水库上游流域36个干流和支流断面的CDOM组分进行分析, 结果表明其标准荧光区域积分占比和荧光区域体积积分值呈现显著的季节性分异特征(图3)。
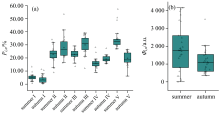
标准荧光区域积分结果中, 夏季以类腐殖质类物质(区域Ⅲ 、 Ⅴ )为主导, 占比均值为 58.28% , 其中类腐殖酸(区域Ⅴ )占比最高, 均值35.45%(范围 26.77%~57.06%), 反映夏季高度腐殖化。 秋季类腐殖酸(区域Ⅴ )占比骤降至19.37% , 而类富里酸(区域Ⅲ , 均值29.80%)和色氨酸类蛋白质(区域Ⅱ , 均值28.28%)显著上升。 夏季类腐殖酸(区域Ⅴ )占比显著高于秋季, 主因可能为丰水期降雨径流输入携带植被覆盖区腐殖化 CDOM[8], 而高温加速微生物介导的腐殖化进程, 促使小分子有机物(如富里酸)向大分子腐殖酸转化。 秋季低温抑制微生物活性, 腐殖化速率下降导致类蛋白质(区域Ⅰ 、 Ⅱ 、 Ⅳ )和类富里酸(区域Ⅲ )积累[9]; 同时, 秋季植被凋落物降解(如枯枝落叶)释放木质素衍生物, 进一步增加富里酸占比[10]。
荧光体积积分值(反映总有机质含量)也表现出显著的季节性差异[图3(b)]: 夏季均值为1 876.29 a.u., 显著高于秋季均值1 160.75 a.u.。 夏季较高的体积积分值, 来源于丰水期降雨径流输入的类腐殖质类物质贡献; 秋季较低的体积积分值则可能与类腐殖质类物质输入减少有关。
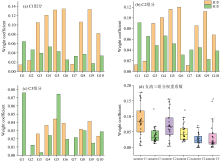
对夏、 秋两个季节从上游至下游的10个干流断面进行 FSI分析。 夏季时[图4(a、 b)], 类蛋白质类物质(Ⅰ 、 Ⅱ 、 Ⅳ 区)标准体积积分占比及体积积分值逐渐增高, 这与研究流域中, 下游区域的生活污水排放及畜牧业污染相关[11, 12], 表明了色氨酸类蛋白质的积聚[7]。 此外, 可溶性微生物代谢产物(区域Ⅳ )沿程上升, 这可能与下游区域水体DOM生物可利用性增高相关。 类腐殖酸(区域Ⅴ )占比逐渐降低, 但体积积分值沿程基本稳定, 这一矛盾现象反映了自然与人为过程的竞争: 陆源腐殖质通过夏季丰水期径流输入(如植被覆盖区土壤淋溶), 但其占比因下游人为污染物(如类蛋白质)的稀释作用而被掩盖[11]。 类富里酸(区域Ⅲ )的占比和积分值基本不变, 夏季高温加速微生物介导的腐殖化反应, 促使小分子富里酸向大分子腐殖酸转化, 但因陆源输入的持续补给(如土壤淋溶), 其总量维持稳定[9]。
 | 图4 干流标准荧光区域体积占比与荧光区域体积积分Fig.4 The proportion of the volume of the standard fluorescence region in the main stream and the volume integral of the fluorescence region |
而到了秋季[图4(c、 d)], 类腐殖酸的占比和体积值呈现出逐渐降低的趋势, 这一趋势与夏季形成鲜明对比, 表明陆源输入大幅减少, 秋季降雨减少, 植被覆盖区土壤淋溶作用减弱, 导致陆源腐殖质输入减少, 同时秋季温度显著降低微生物活性, 腐殖酸合成速率下降[9] 。 类富里酸占比和体积值沿程基本不变, 秋季低温显著抑制微生物活性[9], 导致类富里酸向腐殖酸的转化速率下降; 然而, 植被凋落物(如枯枝落叶)降解释放的木质素衍生物[10]通过地表径流输入河道, 持续补充富里酸物质, 抵消了腐殖化停滞导致的消耗。 类蛋白质类物质的占比和积分值也呈现出沿程逐渐升高的趋势, 再次印证人为活动导致类蛋白质类物质积聚[11]。
汾河水库上游流域支流各区域标准荧光区域体积积分占比及荧光区域体积积分值无论在夏季还是秋季都有较大的差异, 这与不同区域的水体环境及污染源输入有关。 其中夏季Z4王家沟河、 Z9西马坊河、 Z18西碾河、 Z25岚河四个点位的标准荧光区域积分体积明显高于其他点位。 Z9西马坊河、 Z18西碾河、 Z25岚河点位为汾河水库上游的较大支流交汇处, 其受到农业活动和生活污水的影响较为显著, 导致水体中有机质的含量增加; 其中, Z9西马坊河点位类腐殖酸(Ⅴ 区)占比34.6%, 与农田退水携带的土壤腐殖质淋溶相关, 而Z18西碾河、 Z25岚河点位类色氨酸(Ⅱ 区)占比25.2%~25.5%, 显示生活污水与农业面源的复合输入。
2.1.3 平行因子组分识别与分析
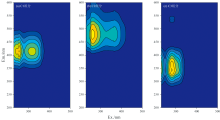
对汾河水库上游流域两季36个样本进行平行因子解析, 得出三个组分。 C1组分最大Ex/Em位于255(315)/415 nm, 可能源于微生物活动或陆源输入。 C2组分最大Ex/Em位于255(360)/470 nm, 属于长波类腐殖质荧光物质; 其中255/470 nm对应于传统的A峰, 360/470 nm对应于传统的C峰。 C2组分通常被认为是一种陆源输出的腐殖质物质, 随着流域内陆源养分的输入而增加, 是富营养化湖泊中CDOM的重要组成部分[10]。 C3组分最大Ex/Em位于225(280)/340 nm, 具有典型的类蛋白荧光特征, 是类腐殖酸C1经微生物降解的产物, 也有来源于工业废水和生活污水。 一般而言, 类蛋白往往能在较短的时间内被微生物降解; 然而Kothawala等[13]的研究一定程度上说明微生物活动过程中伴随类腐殖酸的降解, 会产生类色氨酸等蛋白质。 C3组分常被用作废水处理厂、 家禽粪便等人为排放的重要标志[7, 12, 14]。 在汾河水库上游流域水体中表征类蛋白荧光T峰的稳定组分C3, 可以初步作为甄别人为污染CDOM的特征性标志。
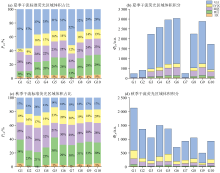
汾河水库上游干流平行因子三组分的时空分布表现出显著的季节差异性。 夏季三组分呈现递增趋势, 表明夏季降水径流输入类腐殖质类物质积聚及下游人为活动影响下类蛋白质类物质积聚。 秋季C1和C2组分呈现递减趋势, 表明秋季降雨减少, 植被覆盖区土壤淋溶作用减弱, 导致陆源腐殖质输入减少, 同时秋季温度显著降低微生物活性, 腐殖酸合成速率下降, 微生物源腐殖质输入减少; C3组分呈现沿程递增趋势, 印证了人为活动导致类蛋白质类物质积聚[7]。 总的而言, 汾河水库上游干流平行因子三组分的时空分布受自然和人为因素共同影响。
汾河水库上游流域内支流三组分权重系数时空分布有明显差异。 其中, Z4王家沟河的 C1及C2两组分相较于其他点位更低, 而其C3组分则相对较高, 这与该点位的特殊人为活动存在关联, 已有研究表明[12]畜禽养殖活动会对CDOM中荧光组分的分布产生影响, 而Z4王家沟河的C3组分权重系数高达7.03%正是这种影响的具体体现。 现场调研中发现Z4王家沟河中存在养殖场, 尽管大部分养殖废水已被处理排放, 但仍有少部分废水渗出到支流中, 这印证了这一推断。 另外, 值得注意的是, 这种影响在秋季表现得尤为明显, 秋季时, Z4王家沟的C1及C2组分权重系数相较于夏季略有下降, 而C3组分则显著上升至15.64%, 这或许与秋季气温的降低以及微生物活动的减弱有关。
研究通过计算并分析汾河上游水体CDOM的荧光特征参数来进一步验证其组分来源, 具体计算方法及参数意义如表1所示。
| 表1 荧光光谱指数计算方法及参数意义[15] Table 1 Calculation method and parameter significance of fluorescence spectral index |
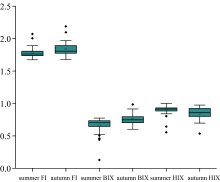
不同季节汾河水库上游CDOM组成与来源差异显著。 秋季FI均值升至1.84(范围1.68~2.19), 表明在地表径流输入陆源腐殖质减少与低温降低微生物活性输入微生物源腐殖质减少双重驱动作用下, 地表径流输入陆源腐殖质减少的更多, 微生物输入占比上升。 BIX均值升至0.76(范围0.60~0.98), 接近自生源临界值(0.8< BIX< 1.0), 反映微生物输入CDOM占比增加。 HIX均值降至0.84(范围0.53~0.97), 表明秋季水体腐殖化程度较高, 但比夏季略低, 反映陆源腐殖质输入减少。 总体而言, 夏季陆源输入主导, 腐殖化程度强; 秋季微生物输入占比上升, 腐殖化程度略微降低。 支流部分采样点受农业径流影响有限, 更多反映微生物活动影响。
对支流中的特例进行分析, 其中Z4王家沟采样点和Z11新堡河采样点的腐殖化指标HIX值均较低, FI和BIX指标值相对较高。 结合这两个采样点C3类蛋白质组分贡献大小高于C1及C2组分, 说明其腐殖质特征较弱, 而新生内源CDOM含量较高, 因此推测这两个采样点受农业径流影响有限, 更多地反映了水体内部微生物活动的影响。
综合各采样点荧光特征参数计算结果及3个指标的意义, 推测该流域水体中CDOM主要由水体自身微生物活动和陆源混合输入, 且具有强腐殖质特征; 另外, 部分采样点腐殖质程度较低, 受农业径流影响有限。
对夏季平行因子组分、 荧光区域分区占比和各荧光参数、 水体理化性质进行相关性分析(图8), 发现夏季C1组分与Ⅴ 区及FI值显著正相关, 同时与C3组分、 Ⅰ 区、 Ⅱ 区占比及BIX值的负相关, 表明C1组分与微生物对陆源腐殖质的改造相关, 微生物通过分泌胞外酶将大分子腐殖酸分解为小分子C1组分, 该过程在夏季高温条件下显著加速, 释放的代谢产物进一步促进腐殖化进程, 同时印证类腐殖质类物质陆源输入与微生物代谢的协同作用。 C2组分与Ⅲ 区、 Ⅴ 区占比及HIX显著正相关, 表明其具有高度腐殖化特性, 与黄土高原地表径流携带的腐殖酸类物质密切相关; 而C2组分与C3组分、 Ⅰ 区、 Ⅱ 区占比的负相关, 揭示腐殖质类组分与活性蛋白类物质存在底物竞争, 微生物优先降解类蛋白物质, 导致腐殖质在水体中相对积累。 C3组分与BIX正相关, 表明其与微生物活动高度相关, 在微生物活动中分解消耗, 同时在微生物活动中由类腐殖酸分解而成。 整体而言, 夏季的驱动机制为高温促进腐殖化进程及雨季导致径流输入增多, CDOM来源表现为陆源输入及微生物源输入的协同输入。
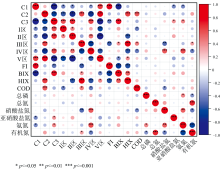 | 图8 夏季荧光参数与水质指标相关性分析Fig.8 Correlation analysis between fluorescence parameters and water quality indexes in summer |
对秋季平行因子组分、 荧光区域分区占比和各荧光参数、 水体理化性质进行相关性分析(图9), 发现秋季C1、 C2组分与Ⅲ 区、 Ⅴ 区占比及HIX显著正相关, 且互相之间显著正相关, 同时, C1和C2组分与C3组分、 Ⅰ 区、 Ⅱ 区占比及BIX的负相关, 表明C1组分与C2组分同为陆源输入占主导, 与夏季陆源输入与微生物代谢的协同作用不同, 反映了低温抑制微生物活动进一步抑制腐殖化。 C3与Ⅳ 区占比和BIX显著正相关, 反映其与微生物活动高度相关。 FI不再与除Ⅳ 区占比外其他指标具有相关性, 表明微生物对腐殖质的改造几乎消失, 陆源腐殖质输入占据绝对主导。 总体而言, 秋季的驱动机制为低温抑制腐殖化进程及旱季导致径流输入减少, CDOM来源表现为陆源输入及微生物源输入的协同输入。
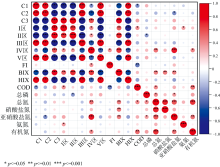 | 图9 秋季荧光参数与水质指标相关性分析Fig.9 Correlation analysis of autumn fluorescence parameters and water quality indexes |
夏季CDOM组分中, Ⅳ 区与
秋季Ⅳ 区与
运用三维荧光光谱技术(EEM), 结合平行因子分析、 区域荧光积分及荧光参数指标, 对汾河水库上游流域CDOM污染特征及来源进行解析, 主要结论如下:
(1)夏季丰沛降雨和高温驱动下, 陆源输入的类腐殖质物质(以可见区类腐殖酸(区域Ⅴ )为主)占比最高(58.28%); 秋季降雨减少导致陆源输入减弱, 类腐殖酸(区域Ⅴ )占比骤降(19.37%), 而类富里酸(区域Ⅲ )和类蛋白物质占比显著升高(分别达29.80%和28.28%)。 平行因子分析(PARAFAC)提取的类腐殖质组分(C1、 C2)全年主导, 而作为人为污染标志的类蛋白组分(C3)在秋季占比升高。 类蛋白组分异常升高可能是由于干流沿岸城镇化区域的生活污水排放。
(2)荧光参数(FI, HIX, BIX)及其季节变化(夏季: FI=1.78, BIX=0.66, HIX=0.89; 秋季: FI=1.84, BIX=0.76, HIX=0.84)联合验证了CDOM主要来源于陆源输入与微生物活动的混合, 且季节性转换明显: 夏季陆源输入主导且腐殖化程度高, 秋季陆源输入减少且微生物源贡献增强。
(3)荧光特征与水质指标相关性分析显示, 夏季C1与微生物活动相关, C2与陆源腐殖质输入相关, C3与微生物活动密切关联; 秋季C1、 C2以陆源输入为主, C3仍与微生物活动相关。
CDOM荧光特性通过关联微生物代谢副产物、 氮形态分布及腐殖质动态, 揭示了水体碳-氮耦合循环的微生物调控机制, 为评估有机污染、 富营养化潜力及制定季节性水质管理策略提供了关键光谱学依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|