作者简介: 付 超, 1992年生, 塔里木大学食品科学与工程学院讲师 e-mail: 528268300@qq.com
以‘温185’纸皮核桃为原料, 采用溶解性分级的方法分离核桃清蛋白、 球蛋白、 醇溶蛋白和谷蛋白, 研究榨油温度对其结构特征的影响。 采用红外光谱分析蛋白二级结构变化, 荧光光谱和紫外光谱分析蛋白三级结构变化。 红外光谱结果表明, 清蛋白二级结构受榨油温度的影响较小; 球蛋白、 醇溶蛋白和谷蛋白二级结构在榨油温度达到130 ℃后均发生明显变化, 谷蛋白的α-螺旋和β-折叠总含量低于其他三种蛋白组分, 说明其二级结构稳定性要弱于其他三种蛋白。 荧光光谱结果表明, 清蛋白和球蛋白的最大荧光峰位置在榨油温度超过130 ℃后发生红移, 表明其蛋白三级结构展开导致蛋白表面疏水性氨基酸暴露增多; 醇溶蛋白荧光峰在榨油温度超过100 ℃后发生轻微蓝移, 表明其蛋白表面疏水性氨基酸被包裹在蛋白分子内部, 但当榨油温度超过130 ℃, 荧光峰发生明显红移, 蛋白表面疏水性氨基酸增多; 谷蛋白最大荧光峰在榨油温度40~70 ℃范围内先发生红移, 蛋白三级结构展开导致疏水基团暴露增多, 但当温度超过130 ℃后, 其荧光峰发生蓝移, 蛋白表面疏水基团暴露减少, 谷蛋白的三级结构相对其他三种蛋白更不稳定。 此外, 清蛋白和球蛋白的整体荧光强度要高于醇溶蛋白和谷蛋白, 表明清蛋白和球蛋白比醇溶蛋白和谷蛋白含有更多的疏水基团。 紫外光谱结果表明, 四种蛋白组分在波长为275 nm附近表现出明显的紫外吸收。 随着榨油温度的增加, 清蛋白、 球蛋白、 醇溶蛋白和谷蛋白的峰强度变化不大, 但清蛋白和球蛋白的紫外吸收峰个数多于醇溶蛋白和谷蛋白, 该现象表明清蛋白和球蛋白含有更多暴露的疏水性氨基酸基团, 这与荧光光谱中推测清蛋白和球蛋白表面含有更多疏水基团的结论一致。 综上所述, 榨油温度达到130 ℃, 对清蛋白、 球蛋白和醇溶蛋白结构均有明显影响; 谷蛋白结构稳定性较低, 当榨油温度达到70 ℃, 对其结构已有明显影响。 此研究对深入理解榨油温度对核桃蛋白结构的影响及开发核桃饼粕蛋白组分相关产品具有一定的参考意义。
Using ‘Wen 185’ paper-skin walnuts as the raw material, walnut albumin, globulin, prolamin, and glutelin were separated using a solubility gradient method. The study investigates the effect of oil extraction temperature on their structural characteristics. Infrared spectroscopy was employed to analyze the changes in the secondary structure of proteins, while fluorescence and ultraviolet spectroscopy were used to examine the changes in the tertiary structure. The results from infrared spectroscopy showed that the secondary structure of albumin was minimally affected by the oil extraction temperature. However, the secondary structure of globulin, prolamin, and gluten underwent significant changes when the extraction temperature reached 130 ℃. Additionally, the total content of α-helix and β-sheet structures in gluten was lower than in the other three protein components, indicating that its secondary structure stability is weaker than that of the other proteins. Fluorescence spectroscopy results revealed that the maximum fluorescence peak of albumin and globulin shifted to a longer wavelength (red shift) after the oil extraction temperature exceeded 130 ℃, indicating that their tertiary structure unfolded, exposing more hydrophobic amino acids on the protein surface. The fluorescence peak of prolamin shifted slightly to a shorter wavelength (blue shift) after the extraction temperature exceeded 100 ℃, suggesting that the hydrophobic amino acids on its surface were buried within the protein molecule. However, when the extraction temperature exceeded 130 ℃, a noticeable red shift occurred, indicating an increase in hydrophobic amino acids on the protein surface. The maximum fluorescence peak of gluten exhibited a red shift within the oil extraction temperature range of 40 to 70 ℃, indicating that changes in its tertiary structure led to increased exposure of hydrophobic groups. However, when the temperature exceeded 130 ℃, a blue shift in the fluorescence peak was observed, suggesting a reduction in the exposure of surface hydrophobic groups. This indicates that the tertiary structure of gluten is relatively more unstable compared to the other three types of proteins. Furthermore, the overall fluorescence intensity of albumin and globulin was higher than that of prolamin and gluten, suggesting that albumin and globulin contain more hydrophobic groups than prolamin and gluten. Ultraviolet spectroscopy results showed that all four protein components exhibited a significant UV absorption around 275 nm. As the oil extraction temperature increased, there was little change in the peak intensity of albumin, globulin, prolamin, and gluten. However, the number of UV absorption peaks in albumin and globulin was greater than in prolamin and gluten, suggesting that albumin and globulin contain more exposed hydrophobic amino acid groups, which is consistent with the conclusion drawn from fluorescence spectroscopy that albumin and globulin have more hydrophobic groups on their surfaces. In conclusion, when the oil extraction temperature reaches 130 ℃, it significantly affects the structure of albumin, globulin, and prolamin. The structural stability of gluten is relatively low, and at an oil extraction temperature of 70 ℃, its structure is already noticeably impacted. This study provides useful insights for understanding the effect of oil extraction temperature on walnut protein structure and for the development of walnut cake protein component products.
核桃又称胡桃, 为胡桃科植物, 拥有丰富的药用和食用价值。 核桃主要用作鲜食, 也有部分用作榨油, 榨油方式分为热榨和冷榨, 热榨相比冷榨具有出油率更高、 香气更浓郁等特点, 是主流榨油方式之一[1]。 据报道, 核桃在不同榨油温度出油率为: 32.24%± 1.0%(40 ℃), 46.52%± 0.69%(70 ℃), 57.38%± 1.10%(100 ℃), 61.79%± 1.52%(130 ℃), 63.46%± 1.52%(160 ℃), 考虑到榨油温度超过100 ℃后, 其出油率并不会显著升高, 因此较经济的榨油温度应该在100 ℃附近[2]。 此外, 榨油温度越高, 越易破坏核桃蛋白结构, 导致蛋白变性甚至碳化, 使其在动物体内消化率降低, 因此榨油温度应尽可能低一些[2]。 但工业生产中, 为保证较高的出油率, 核桃榨油温度普遍偏高。 核桃饼粕是核桃榨油后残留的固体残渣, 热榨核桃饼粕与冷榨核桃饼粕相比成分更复杂, 营养价值更低, 因此热榨核桃饼粕常被用作饲料、 肥料或燃料等低附加值产品, 未被充分利用。 前期研究表明热榨核桃饼粕中含有蛋白质、 氨基酸、 油脂等营养成分, 若能开发核桃饼粕类相关产品, 将对榨油的整体经济效益的提高产生积极的影响[3, 4]。
已有学者对热榨核桃蛋白进行了研究, 但核桃蛋白结构复杂, 很难解释蛋白变性的机理[5, 6]。 有研究表明高温会导致核桃蛋白二级结构及疏水基团暴露变化, 但结构变化和基团暴露的主要来源尚不明确。 根据核桃蛋白在水溶液, 盐溶液, 醇溶液和碱性溶液中溶解度不同, 可从核桃蛋白中分离出清蛋白、 球蛋白、 醇溶蛋白和谷蛋白[6]。 若能深入研究每一种蛋白组分的结构特性, 将有助于深入理解核桃蛋白变性的原因。
核桃主要以初级加工产物为主, 很少有开发蛋白组分的产品, 但蛋白组分具有不同的开发前景, 若能开发核桃蛋白组分将促进核桃产业的发展。 例如: 核桃清蛋白是一种具有多种功能特性的高营养植物蛋白, 能很好地满足以力量型运动员为代表的专业运动群体的基本营养需求, 可应用于功能性食品开发[7]。 核桃球蛋白具有较好的ABTS自由基清除能力, 是开发抗氧化食品的较好原料[8]。 醇溶蛋白难溶于水相, 有较好的疏水性, 可用于生产食品涂层、 薄膜或包装材料[9]。 核桃谷蛋白可被复合蛋白酶水解改变其功能特性, 适合于饮料或植物肉的生产[10]。
核桃蛋白组分的提取方法和结构分析方法已相对成熟。 据报道核桃蛋白中含有7.2%清蛋白, 16.9%球蛋白, 4.5%醇溶蛋白和71.4%谷蛋白, 且以上四种蛋白组分的的纯度均在90%左右[6]。 虽然蛋白组分为一类具有相同特性的混合蛋白, 分离后无法达到晶体纯度级别, 但蛋白类物质的独特结构和疏水性氨基酸基团在光谱中的特性变化可反映其二级或三级结构的变化, 这为研究蛋白结构打下了坚实的基础, 当前已有学者基于红外光谱, 荧光光谱和紫外光谱研究了蛋白质的二级和三级结构[11, 12, 13]。
本研究从不同榨油温度生产的核桃饼粕中分离出谷蛋白、 球蛋白、 清蛋白和醇溶蛋白, 通过红外光谱, 紫外光谱和荧光光谱分析榨油温度对核桃蛋白组分结构的影响, 揭示蛋白组分结构变化, 对深入理解蛋白的变性机理和开发核桃蛋白组分相关产品具有潜在的参考意义。
将核桃去壳, 取1 kg核桃仁放入蒸馏水中浸泡5 h, 用小刀刮去种皮, 核桃仁置于鼓风式干燥箱40 ℃干燥24 h, 使用游侠X5S螺旋榨油机在40、 70、 100、 130和160 ℃榨取核桃饼粕。 将核桃饼粕放入烧杯中, 按照料液比1∶ 2加入石油醚, 用封口膜封口后, 浸泡24 h后过滤, 重复3次, 将滤渣取出, 置于通风柜中, 待石油醚完全挥发后, 制得的核桃饼粕脱脂粉于4 ℃贮存。
参考任娇艳[6]等的方法制取蛋白组分, 取一定量核桃饼粕脱脂粉与去离子水按照1∶ 10混合, 在40 ℃保温振荡1.5 h 后5 000 r· min-1离心25 min, 取上清液冻干24 h得到清蛋白。 将清蛋白提取后的沉淀, 按照1∶ 10的比例加入1.0 mol· L-1 NaCl溶液, 在40 ℃下保温振荡1.5 h后5 000 r· min-1离心25 min, 取上清液冻干24 h得到球蛋白冻干粉。 将球蛋白提取后的沉淀, 按照1∶ 10的比例加入70%乙醇, 在40 ℃保温振荡1.5 h后5 000 r· min-1离心25 min, 取上清液冻干24 h得到醇溶蛋白冻干粉。 将醇溶蛋白提取后的沉淀, 按照1∶ 10的比例加入1.0 mol· L-1 NaOH, 在40 ℃下保温振荡1.5 h后5 000 r· min-1离心25 min, 取上清液冻干24 h得到谷蛋白冻干粉。
1.2.1 傅里叶红外光谱分析
将干燥后的KBr与待测蛋白样品按1∶ 100的比例混合均匀, 压制成均匀透明薄片, 使用红外灯照射1 h干燥后放入PeakinElmer Frontier红外光谱仪中进行400~4 000 cm-1波数扫描, 使用PeakFit 4.1.2软件对酰胺Ⅰ 带(1 600~1 700 cm-1)光谱数据进行分析[14]。
1.2.2 荧光光谱分析
使用pH 7.0的磷酸盐缓冲液溶解蛋白, 制备成浓度为0.1 mg· mL-1的蛋白待测溶液。 用日立F-4500 荧光分光光度计测定蛋白质的荧光光谱, 设置激发波长290 nm, 扫描范围300~400 nm, 狭缝宽5 nm, 扫描速度1 200 nm· min-1。
1.2.3 紫外光谱分析
使用紫外-分光光度计对核桃蛋白的三级结构进行测定。 将核桃蛋白样品用pH 7.0的磷酸盐缓冲液稀释到浓度为0.1 mg· mL-1的蛋白溶液。 取约5 mL样液放入石英比色皿中, 使用UNICO UV-2800紫外-分光光度计在波长200~400 nm 范围测量样品的吸光度值。
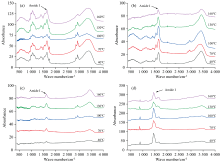
图1是不同榨油温度下核桃蛋白组分的红外光谱图, 图中的酰胺Ⅰ 带(1 600~1 700 cm-1)常被用于分析蛋白质的二级结构, 1 610~1 640 cm-1被指认为β -折叠、 1 640~1 650 cm-1被指认为α -螺旋、 1 660~1 700 cm-1被指认为β -转角、 1 650~1 660 cm-1被指认为无规则卷曲[14, 15]。 图1(a)是榨油温度对核桃清蛋白红外光谱的影响, 由图可知100 ℃红外光谱相对其他温度光谱峰整体强度降低, 但该温度下, 峰之间的相对强度未发生明显变化, 表明该峰强度整体降低主要与仪器参数变化有关, 而与蛋白结构变化关系不大。 随着榨油温度的增加, 100 ℃的酰胺I带峰型也相对于其他温度变化更大, 预示着其二级结构可能会与其他温度相比有较大的不同。 图1(b)是不同榨油温度下核桃球蛋白的红外光谱图。 随着温度的增加, 40、 70和100 ℃ 峰型相差不大, 但130和160 ℃峰型有一定的变化。 随着温度的增加, 40、 70和100 ℃球蛋白酰胺Ⅰ 带峰型相差不大, 在130和160 ℃有较为明显的变化, 表明球蛋白的二级结构含量在130和160 ℃变化显著。 图1(c)是榨油温度对核桃醇溶蛋白红外光谱的影响, 由图可知随着温度的提高, 峰型都有变化, 与清蛋白和球蛋白蛋白酰胺Ⅰ 带光谱相比, 其变化更大, 表明醇溶蛋白的二级结构变化相对会更明显。 图1(d)是不同榨油温度下核桃谷蛋白的红外光谱图, 由图可知70、 100和130、 160 ℃峰型各异, 温度超过130 ℃的谷蛋白结构变化较大。 随着榨油温度的升高, 40和100 ℃谷蛋白酰胺Ⅰ 带峰型基本一致, 70和130 ℃峰型类似。
图2是不同榨油温度下核桃清蛋白酰胺Ⅰ 带拟合后的光谱图, 通过分析每个拟合峰面积占比可以推测出蛋白二级结构的变化, 表1为通过计算峰面积占比计算出的清蛋白二级结构比例, 为了避免赘述, 后续蛋白组分二级结构分析只展示通过计算得出的蛋白二级结构占比。 随着温度的增加, 酰胺Ⅰ 带拟合峰的形状相差不大, 但在100 ℃拟合峰峰高增加, 峰的形态变尖, 预示着100 ℃清蛋白二级结构含量发生相对明显改变。
| 表1 核桃清蛋白二级结构含量 Table 1 The content of walnut albumin secondary structure |
天然蛋白质的二级结构中α -螺旋、 β -折叠较多, 是因为其内部具有较多的氢键, 氢键越多则蛋白质结构越稳定[16]。 表1是不同榨油温度下核桃清蛋白二级结构含量, 从表中可以看出, 随着榨油温度的升高, 核桃清蛋白中α -螺旋含量由24.59%降至22.63%, β -折叠含量由25.49%升至27.70%, 整体变化不明显。 100 ℃ α -螺旋含量相较于其他温度要高一点。 以上结果表明, 榨油温度对核桃清蛋白的二级结构影响整体较小, 清蛋白的二级结构相对稳定。
表2是不同榨油温度下核桃球蛋白二级结构含量。 随着温度达到130 ℃, 核桃球蛋白二级结构中的α -螺旋、 β -折叠和β -转角含量均发生较大变化, 预示榨油温度达到130 ℃后球蛋白二级结构变化明显。
| 表2 核桃球蛋白二级结构含量 Table 2 Walnut globulin secondary structure content |
表3是不同榨油温度下核桃醇溶蛋白二级结构含量, 从表中可以看出, 随着温度的增加, 二级结构含量呈无规则变化。 130 ℃ α -螺旋和β -折叠含量之和最低, 为63.43%, 且β -转角增加最多; 该现象可能是由于高温导致蛋白质分子间或分子内氢键断裂, 发生了去折叠, 且在此条件下β -折叠结构易转变为β -转角结构, 结构变得更为无序, 因此, 推断榨油温度达到130 ℃核桃醇溶蛋白的二级结构发生明显变化, 结构稳定性降低。
| 表3 核桃醇溶蛋白二级结构含量 Table 3 The content of walnut prolamin secondary structure |
表4是不同榨油温度下核桃谷蛋白二级结构含量, 从表中可以看出, 40和100 ℃二级结构含量相近。 谷蛋白的α -螺旋含量和β -折叠含量之和相较于其他三种蛋白是偏低的, 表明其二级结构稳定性要弱于其他三种核桃蛋白; 当榨油温度达到130 ℃, 其二级结构的β -折叠和β -转角含量均发生明显变化, 因此推测榨油温度达到130 ℃后其二级结构明显改变。
| 表4 核桃谷蛋白二级结构含量 Table 4 Walnut valley protein secondary structure content |
图3是榨油温度对核桃蛋白组分荧光光谱的影响。 蛋白质中的色氨酸(Trp)、 酪氨酸(Tyr)和苯丙氨酸(Phe)的侧链生色基团在波长290 nm光激发下会产生荧光, 通过分析最大荧光峰位移变化和峰强度变化可推断出这3种芳香族氨基酸的暴露情况[17]。 在未变性的天然蛋白质中, 这3种氨基酸主要位于蛋白内部, 但当蛋白质结构展开时, 这些氨基酸逐渐暴露, 最大荧光峰位置发生红移; 相反, 最大荧光峰发生蓝移, 则是蛋白结构收缩, 疏水氨基酸被包裹在蛋白质分子内部导致。 清蛋白和球蛋白在榨油温度超过130 ℃后最大荧光峰发生明显红移, 说明温度超过130 ℃清蛋白和球蛋白三级结构展开导致其内部疏水性氨基酸暴露。 醇溶蛋白在榨油温度超过100 ℃后, 其最大荧光峰先发生轻微蓝移, 疏水性氨基酸被包裹, 其后, 当榨油温度超过130 ℃, 最大荧光峰发生明显红移, 蛋白结构展开导致其内部疏水氨基酸暴露。 图3(d)是不同榨油温度下的谷蛋白荧光光谱, 值得注意的是, 该光谱与其他三种蛋白荧光光谱形态有较大差异, 且受榨油温度的影响峰型变化更加频繁, 表明其三级结构更不稳定, 当榨油温度超过40 ℃, 最大荧光峰先发生红移, 谷蛋白结构内部疏水基团暴露, 当榨油温度在70~100 ℃时, 最大荧光峰位置未发生明显位移, 但当温度超过130 ℃, 其最大荧光光谱发了明显蓝移, 蛋白结构收缩, 其疏水基团再被包裹住。
荧光峰强度也可反映出这3种发色基团的暴露情况, 荧光峰强度越强, 芳香族氨基酸发色基团暴露的越多[18]。 当榨油温度为40 ℃时, 清蛋白荧光强度: 3 315.3 au, 球蛋白: 1 018.3 au, 醇溶蛋白: 681.1 au, 谷蛋白: 188.3 au, 清蛋白和球蛋白的荧光强度高于醇溶蛋白和谷蛋白, 表明清蛋白和球蛋白表面可能含有更多的疏水基团。
图4是不同榨油温度下核桃蛋白组分的紫外光谱图。 蛋白质的紫外吸收强度和其侧链中的氨基酸残基有关。 其中, 疏水性氨基酸基团, 色氨酸(Trp)、 酪氨酸(Tyr)和苯丙氨酸(Phe)残基的暴露直接影响蛋白质的紫外吸收水平, 因此观察其光谱变化也能够反映蛋白质的构象变化。 虽然, 非疏水性的组氨酸和半胱氨酸对紫外吸收也有影响, 但其产生的影响没有以上3种氨基酸产生的影响大。 核桃四种蛋白组分在275 nm附近波长处都表现出明显的紫外吸收, 随着榨油温度的增加, 清蛋白、 球蛋白、 醇溶蛋白和谷蛋白的峰强度变化不大, 但清蛋白和球蛋白的紫外吸收峰个数多于醇溶蛋白和谷蛋白, 说明清蛋白和球蛋白含有更多暴露的疏水性基团, 该结果与前面讨论的荧光光谱峰强度与疏水基团暴露情况所得出的结论一致。
采用‘ 温185’ 纸皮核桃作为样品, 研究了榨油温度对四种核桃蛋白组分的二级和三级结构的影响。 红外光谱结果表明, 清蛋白二级结构受榨油温度影响较小; 球蛋白、 醇溶蛋白和谷蛋白二级结构在榨油温度达到130 ℃后均较大变化, 谷蛋白的α -螺旋和β -折叠含量之和低于其他三种蛋白组分, 表明谷蛋白的二级结构稳定性要弱于其他三种蛋白。 荧光光谱结果表明, 清蛋白和球蛋白在榨油温度超过130 ℃后蛋白三级结构展开, 蛋白内部疏水性氨基酸基团暴露。 醇溶蛋白在榨油温度超过100 ℃后表面少量疏水性氨基酸被包裹, 榨油温度超过130 ℃后三级结构展开, 其蛋白内部疏水性氨基酸暴露。 谷蛋白在榨油温度在40~70 ℃先发生蛋白三级结构展开疏水基团暴露, 然后当温度超过130 ℃, 疏水性氨基酸再被包裹。 此外, 清蛋白和球蛋白比醇溶蛋白和谷蛋白含有更多的疏水性氨基酸基团。 紫外光谱结果表明, 随着温度的增加, 清蛋白、 谷蛋白、 球蛋白和醇溶蛋白的紫外吸收峰强度变化不大, 但清蛋白和球蛋白的紫外吸收峰个数比醇溶蛋白和谷蛋白更多, 表明清蛋白和球蛋白表面的疏水性氨基酸基团更多, 与荧光光谱所分析得出的结论一致。 综上所述, 榨油温度达到130 ℃, 对清蛋白、 球蛋白和醇溶蛋白结构均有明显影响; 谷蛋白结构稳定性较低, 当榨油温度达到70 ℃, 对其结构已有明显影响。 此研究可以对深入理解榨油温度对核桃蛋白的影响及深入开发核桃饼粕蛋白组分相关产品具有一定的参考意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|