作者简介: 曾 造, 1978年生, 贵州工程应用技术学院化学工程学院教授 e-mail: 710843449@qq.com
去甲去氢斑蝥素类化合物是一类具有抗癌活性的药物, 其与人血清白蛋白(HSA)的相互作用机理对了解该类药物的性质具有重要意义。 以呋喃、 肉桂醛和马来酸酐为原料, 合成了去甲去氢斑蝥酰亚胺缩肉桂醛(DCIC), 其结构经NMR确证。 采用荧光光谱法、 位点竞争和分子对接模拟研究了DCIC与HSA的相互作用机理。 荧光光谱表明, DCIC对HSA的猝灭机制为静态猝灭, 在298、 303和313 K时, 猝灭常数分别是8.53×104、 7.05×104和6.05×104 L·mol-1; 303 K时结合位点数为0.978, 吉布斯自由能为-25.75 kJ·mol-1; 焓变Δ H<0, 熵变Δ S<0, 可知DCIC与HSA之间的作用力主要是氢键和范德华力。 根据Forster能量转移定律, 计算出两者间结合距离为3.946 nm, 小于7 nm, 表明DCIC对HSA为非辐射能量转移的静态猝灭。 同步荧光显示该化合物使色氨酸(Trp)残基周围微环境的疏水性增加。 位点竞争实验表明DCIC与HSA主要是在亚结构域ⅡA (site Ⅰ)结合。 分子对接模拟表明DCIC与HSA主要通过氢键结合, 最优结合能为-25.44 kJ·mol-1, 结合位点为site Ⅰ, 结果与光谱法、 位点竞争实验一致。 本研究结果可以为DCIC在人体的贮存、 运输、 药代动力学等研究提供重要的理论依据。
Dehydronorcantharidin compounds are a class of drugs with anticancer activity. The interaction mechanism between compounds and human serum albumin (HSA) is of great significance for understanding the properties of such drugs. In this study, dehydronorcantharidin imide-cinnamaldehyde (DCIC) was synthesized from furan, cinnamaldehyde and maleic anhydride, and the structure of the target compound was confirmed by NMR spectroscopy. The interaction mechanism of DCIC with HSA was investigated using fluorescence spectroscopy, site marker competition and molecular docking simulations. Fluorescence spectroscopy results indicated that the quenching mechanism of DCIC towards HSA followed a static quenching model. The quenching constants at 298, 303, and 313 K were found to be 8.53×104, 7.05×104, and 6.05×104 L·mol-1, respectively. At 303 K, the number of binding sites was calculated to be 0.978, and the Gibbs free energy is -25.75 kJ·mol-1. Both the enthalpy change (Δ H) and entropy change (Δ S) were negative, suggesting that the main interaction forces between DCIC and HSA were hydrogen bonds and van der Waals forces. According to Förster's theory of energy transfer, the binding distance between DCIC and HSA was calculated to be 3.946 nm, which is less than 7 nm, indicating static quenching through non-radiative energy transfer. Synchronous fluorescence spectroscopy results further revealed that DCIC increased the hydrophobicity of the microenvironment surrounding the tryptophan residue. Molecular docking simulations showed that DCIC binds to HSA at site I through a hydrogen bond, with an optimal binding energy of -25.44 kJ·mol-1, which is consistent with the findings from the spectroscopic and site competition experiments. This study provides a crucial theoretical foundation for research on the storage, transport, and pharmacokinetics of DCIC within the human body.
斑蝥素是从昆虫纲动物大斑蝥中提取的有效成分, 对原发性肝癌、 乳腺癌等有一定的疗效, 具有升高白细胞数、 不抑制免疫系统等优点[1]。 但斑蝥素对肾脏、 泌尿系统有较大毒副作用, 合成步骤复杂, 其使用受到限制[2]。 去甲去氢斑蝥素类化合物是容易合成的斑蝥素类似物, 具有与斑蝥素类似的抗肿瘤活性, 可降低不良反应, 增强免疫调节, 其毒性相对较低, 药用价值优于斑蝥素[3]。 肉桂醛为肉桂等植物提取出的一种丙烯醛衍生物, 具有抗癌、 抗细菌、 抗病毒等多重生物活性[4]。 在癌症治疗中, 分子靶向药物能精准地选择性攻击和杀灭癌细胞, 由于癌症的发病机制十分复杂, 是多种因素综合作用的结果, 单一靶点药物往往不能达到满意的效果。 基于去甲去氢斑蝥素和肉桂醛的抗菌抗肿瘤活性, 利用化学方法将两个具有药效基团连接起来, 发挥多个靶点的协同作用, 以提高该类药物的抗癌活性。
人血清白蛋白(human serum albumin, HSA)是血浆中含量最丰富的蛋白质。 HSA可以保持渗透压, 缓冲pH值, 充当血液中的运输载体, 运输和储存各种物质, 具有多种功能[5]。 药物进入人体后, 在血浆中存储, 且向病变部位转运, 在此过程中发挥药效并产生药理作用[6]。 目前, 虽然去甲去氢斑蝥素酰亚胺类衍生物已被证明具有一定的抗癌活性, 但其与血清白蛋白相互作用的机理仍不清楚。 考虑到该类药物的生物活性和医疗价值, 研究去甲去氢斑蝥酰亚胺药物与HSA的相互作用, 对理解该类药物在人体内的贮存、 运输、 作用机制等有重要意义。
本文利用呋喃、 顺丁烯二酸酐、 肉桂醛等原料合成了去甲去氢斑蝥酰亚胺缩肉桂醛(dehydronorcantharidin imide-cinnamaldehyde, DCIC), 通过荧光光谱法、 位点竞争实验探究了DCIC与HSA的荧光猝灭机理、 结合位点、 结合距离和作用力, 并通过分子对接模拟计算DCIC和HSA之间的最优结合能、 结合位点、 相互作用力等。 这为研究斑蝥素-肉桂醛类药物与人血清蛋白的相互作用机制、 药物动力学及新药开发提供了重要的实验数据和支持。
400 MHz核磁共振仪(瑞士Bruker公司); F-7100 FL荧光分光光度计(日本日立公司); T600 AS 紫外分光光度计(北京普析通用仪器有限责任公司); SGWX-4B显微熔点仪(上海仪电物理光学仪器有限公司); MS-H340-S4磁力搅拌器(北京大龙兴创实验仪器股份公司); B-220恒温水浴锅(上海亚荣生化仪器厂); PHS-3C酸碱度pH计(上海仪电科学仪器有限公司)。 人血清白蛋白(AR, 天津希恩思生化有限公司); 其余试剂, 如顺丁烯二酸酐、 呋喃、 水合肼、 肉桂醛、 保泰松、 布洛芬等均为分析纯, 试验用水为超纯水。
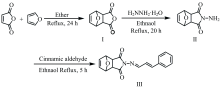
目标化合物的合成路线如图1所示。
在置有聚四氟乙烯磁子的100 mL三颈烧瓶中, 加入50 mL无水乙醚和1.96 g(0.02 mol)顺丁烯二酸酐, 搅拌溶解后, 滴加5.80 mL(0.08 mol)呋喃, 34 ℃下, 回流24 h。 反应结束后, 过滤, 经重结晶、 干燥后得到白色针状物中间体Ⅰ 2.81 g, 产率85%。 称取1.66 g(0.01 mol)中间体Ⅰ 于100 mL 三颈烧瓶中, 加入50 mL无水乙醇并搅拌, 待Ⅰ 溶解后滴加0.50 mL(0.01 mol)水合肼, 83 ℃下, 回流20 h。 反应结束后过滤, 产物经重结晶、 干燥后得到去甲去氢斑蝥酰亚胺(中间体Ⅱ )1.67 g, 产率为93%。 称取中间体Ⅱ 0.36 g (0.002 mol)于50 mL三颈烧瓶中, 加15 mL无水乙醇溶解。 加入0.26 g(0.002 mol)肉桂醛, 83 ℃下, 回流5 h。 冷却后过滤, 固体用无水乙醇重结晶, 干燥后得到DCIC(产物Ⅲ )0.39 g, 浅黄色固体, 产率67%。
1.3.1 药品的配制
称取0.007 4 g去甲去氢斑蝥酰亚胺缩肉桂醛定容250.00 mL, 配制成1× 10-4 mol· L-1储备液; 配制2× 10-5 mol· L-1的HSA储备液; 配制Tris-HCl缓冲溶液(pH 7.4, 内含0.10 mol· L-1的NaCl), 以上溶液均在4 ℃下保存, 备用。
1.3.2 荧光猝灭实验
在10.00 mL容量瓶中分别加入1.00 mL Tris-HCl、 HSA溶液, 再分别加入不同体积(0.00、 1.00、 2.00、 3.00、 4.00、 5.00、 6.00 mL)的DCIC溶液, 摇匀, 定容。 按上述方法配置三组溶液, 分别在298、 303、 313 K水浴中恒温40 min。 激发波长为280 nm, 狭缝宽度均为5 nm, 测定300~450 nm荧光发射光谱。
1.3.3 同步荧光实验
按1.3.2步骤配制一组待测液, 在298 K恒温40 min, 设置激发波长为280 nm, 发射波长分别为295和340 nm, 狭缝宽度为5 nm, 测定不同DCIC浓度下HSA残基特征荧光光谱。
在10.00 mL容量瓶中, 分别加入1.00 mL HSA、 Tris-HCl和2× 10-5 mol· L-1 DCIC溶液, 再分别加入0、 1.00、 2.00、 3.00、 4.00、 5.00和6.00 mL保泰松、 布洛芬储备液(2.0× 10-5 mol· L-1), 在298 K恒温40 min, 测定竞争试剂对HSA的荧光光谱。
中间体Ⅰ 去甲去氢斑蝥素, 白色固体, 产率为85%, 熔点: 117.6~118.2 ℃。 1H NMR (400 MHz, DMSO-d6): δ 6.56 (s, 2H), 5.33 (s, 2H), 3.27 (s, 2H), 中间体Ⅰ 的氢谱数据与文献相符合[9]。 中间体Ⅱ N-氨基去甲去氢斑蝥素酰亚胺, 白色固体, 产率93%, 熔点: 136.2~138.1 ℃, 1H NMR (400 MHz, DMSO-d6) δ 6.54 (s, 1H), 5.10 (s, 1H), 5.06 (s, 1H), 2.85 (s, 2H)。 产物去甲去氢斑蝥酰亚胺缩肉桂醛(C17H14N2O3)白色固体, 产率67%, 熔点: 140.8~143.2 ℃。 1H NMR (400 MHz, DMSO-d6) δ 8.76 (d, J=9.4 Hz, 1H), 7.70 (d, J=7.3 Hz, 2H), 7.49~7.37 (m, 4H), 7.12 (dd, J=15.8, 9.6 Hz, 1H), 6.59 (s, 2H), 5.22 (s, 2H), 2.99 (s, 2H)。 1H NMR证实合成产物为目标化合物。
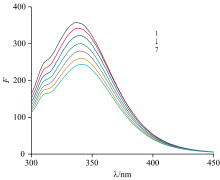
不同浓度的DCIC与HSA相互作用的荧光光谱如图2所示, 激发光波在280 nm时, 人血清白蛋白(HSA)在(345± 5) nm处表现出特征的最大荧光发射峰。 随去甲去氢斑蝥素衍生物(DCIC)浓度增加, HSA发射光谱形状基本不变, 荧光强度渐降, 最大发射波长出现红移(340→ 344→ 346→ 348→ 350 nm), 说明DCIC与HSA间发生了相互作用, 使HSA内源氨基酸残基荧光发生猝灭。
荧光猝灭类型主要包括动态猝灭、 静态猝灭以及能量转移猝灭等。 其中, 动态猝灭是猝灭剂与蛋白质分子发生碰撞, 导致荧光猝灭, 温度升高猝灭常数会增大, 反之则为静态猝灭[10]。 药物DCIC与HSA间的荧光猝灭过程符合Stern-Volmer方程[11]。
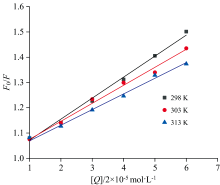
式(1)中, F0为未加入药物的蛋白荧光强度, F为加入药物后的蛋白荧光强度, Ksv为荧光猝灭常数, Kq为双分子猝灭速率常数, [Q]为药物DCIC的浓度, τ 0为无猝灭剂时的荧光分子平均寿命(约为1× 10-8 s)。 在298、 303和313 K时, 作F0/F对[Q]的Stern-Volmer曲线图, 猝灭常数由直线斜率来求出, Ksv分别为8.53× 104、 7.05× 104和6.05× 104 L· mol-1, Kq分别为8.53× 1012、 7.05× 1012和6.05× 1012 L· mol-1· S-1, 如图3所示。 结果表明, 随着温度的升高, Ksv逐渐降低, 且Kq大于各类猝灭剂对蛋白质分子的最大动态猝灭常数(2.0× 1010 L· mol-1· S-1), 可推测DCIC与HSA之间形成了复合物, 引起HSA荧光的静态猝灭。
药物DCIC-HSA形成复合物的荧光强度与药物浓度之间的关系可用猝灭式(2)来表示[12]。
式(2)中, 在不同温度下, 以药物浓度lg[Q]为横坐标、 荧光强度lg[(F0-F)/F]为纵坐标作图, 由直线截距可求出结合常数KA, 实验结果如图4。 当温度升高时, 其结合常数降低, 可能是因为温度升高, 分子运动加快, 使药物与蛋白质分子之间形成的复合物稳定性下降。
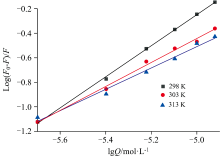 | 图4 不同温度下DCIC与HSA的Lineweaver-Burk曲线Fig.4 Lineweaver-Burk curves of HSA-DCIC at different temperatures |
由图4中直线的斜率可推出结合位点数n, 结果见表1, 在298、 303和313 K时, 其结合位点数分别是1.266 7、 0.977 8和0.870 4, 在3个温度下, 结合位点数的平均值为1.038, 约为1, 表明药物DCIC与HSA分子只有1个或1类结合位点。
| 表1 DCIC与HSA的结合常数和结合位点数 Table 1 Binding constants and binding points for the system of DCIC-HSA |
依据Ross理论可判断药物与蛋白质之间的相互作用力类型[13], 热力学参数Δ H< 0、 Δ S< 0时, 药物和蛋白质之间主要体现为氢键和范德华力; Δ H< 0, Δ S> 0时, 两者间主要体现为静电作用力; Δ H> 0、 Δ S> 0时, 两者间主要表现为疏水作用力。 可由热力学方程式(3)— 式(5)可推断DCIC与HSA相结合的作用力类型。
式(3)— 式(5)中, Δ G是吉布斯自由能, R为摩尔气体常数, KA是结合常数。 温度变化不大时, 反应的Δ H和Δ S可分别视为一个常数。 在298、 303、 313 K温度下, DCIC与HSA相互作用的热力学函数值见表2。
| 表2 DCIC与HSA的热力学参数 Table 2 The rmodynamic parameters of HSA-DCTC |
由表2可知, 在298、 303、 313 K时, Δ H=-245.47 kJ· mol-1, Δ S=-710.67 J· mol-1· K-1, 平均Δ G=-27.47 kJ· mol-1, 因热力学参数Δ H< 0, Δ S< 0, DCIC与HSA相互作用主要是氢键和范德华力, 同时Δ G< 0, Δ H< 0, 表明该反应为自发进行的放热过程。
同步荧光光谱可以反映出药物作用下氨基酸残基周围微环境的变化, 设定激发波长和发射波长差Δ λ 为15 nm, 可显示酪氨酸(Tyr)残基的同步荧光; 波长差Δ λ 为60 nm, 可显示色氨酸(Trp)残基特性的同步荧光光谱, 同步荧光实验如图5所示。
 | 图5 HSA和DCIC的同步荧光光谱图 |
由图5可知, 随着DCIC浓度的不断增大, 同步荧光光谱的谱形几乎没有改变, 荧光强度是呈现下降趋势, 表明DCIC对酪氨酸残基和色氨酸残基均有猝灭作用。 由图5(a)中Δ λ 为15 nm时, 最大发射波长蓝移0.6 nm, 图5(b)中Δ λ 为60 nm时, 最大发射波长蓝移1 nm, 结果表明, DCIC使HSA色氨酸等残基微环境发生改变, 极性减小, 疏水性增加, 从而导致HSA空间构象发生改变。
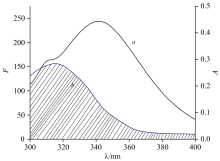
根据Forster的非辐射能量转移理论, 当药物(受体)的紫外吸收光谱与蛋白质(供体)的荧光发射光谱出现重叠, 两者间结合距离不超过7 nm时, 存在非辐射能量转移[14]。 其结合距离(r)计算关系如式(6)— 式(8)。
式(6)— 式(8)中, E为能量转移效率, R0为临界能量距离, N为介质折射指数(取值1.336), K2为偶极空间取向因子(取值2/3), Φ 为供体的荧光量子产率(取值0.118), J为供体荧光发射光谱与受体紫外吸收光谱重叠积分, ε (λ )为受体在波长λ 处的摩尔吸光系数。 HSA的荧光猝灭光谱与等浓度的DCIC紫外吸收光谱, 在300~400 nm区间有一定程度的重叠, 如图6所示。
根据式(6)— 式(8)求出能量转移效率E=0.328 6, 重叠区域的面积积分值J=8.5× 10-14 cm3· L· mol-1, R0=3.503 nm, 计算出药物DCIC与HSA之间的结合距离r=3.946 nm, 小于7 nm, 且满足0.5 R0< r< 1.5R0。 结果表明, HSA与DCIC之间发生了非辐射能量转移的荧光猝灭。
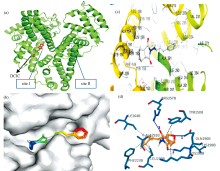
研究表明, 大多数药物都分别作用于HSA的亚结构域Ⅱ A(196~383氨基酸残基)、 Ⅲ A(384~585氨基酸残基), 也称作位点site Ⅰ 和site Ⅱ , 竞争试剂保泰松(或华法林)、 布洛芬分别被视为site Ⅰ 和site Ⅱ 定型药物[15, 16]。 利用保泰松和布洛芬分别作用于HSA, 根据其荧光变化程度确定药物与HSA的结合位点(如图7)。 由图7可知, 保泰松体系中最大荧光值明显降低, 而布洛芬体系的荧光光谱变化较小。 说明保泰松是HSA荧光猝灭的取代试剂, 为定位药物, 实验表明DCIC与HSA主要是在亚结构域Ⅱ A (site Ⅰ )结合。
根据分子对接结果, 选择了结合亲和力最优的配体构象与受体蛋白形成的复合物进行相互作用分析, DCIC分子与HSA的最优结合能为-25.44 kJ· mol-1, 与实验热力学参数非常接近(303 K、 Δ G=-25.79 kJ· mol-1), 其分子对接模拟如图8所示。
从图8(a)和(b)的结合模式可以看出, 配体结合在蛋白质表面类似一个“ 桥” 的口袋内, 且两者有良好的形状互补匹配, 该DCIC分子可以很好的分布在Ⅱ A域的疏水腔中, 在HSA的site Ⅰ 处结合, 与位点竞争实验结果一致。 图8(c)和(d)显示Gln196、 Lys199、 Arg257是药物与人血清白蛋白形成氢键的关键氨基酸残基。 同时, 药物分子被Tyr150、 Lys195、 Lru219、 Phe223、 Iie264等氨基酸残基包围, 其中多数氨基酸残基为疏水性基团[17], 分子对接模拟表明, DCIC与HSA之间主要存在氢键作用, 同时也存在疏水作用力的影响, 与实验结果一致。
DCIC、 去甲去氢斑蝥素酰亚胺缩水杨醛与HSA的相互作用可知[18], 两者与HSA都发生非辐射能量转移的静态猝灭, 303 K时, 其猝灭常数分别为7.05× 104、 3.29× 104 L· mol-1, 结合位点数约为1; 两者主要通过氢键、 范德华力和疏水作用力与HSA发生相互作用。
采用荧光光谱法、 分子对接技术等方法探究了去甲去氢斑蝥酰亚胺缩肉桂醛与HSA的相互作用机制。 在298、 303、 313 K时, DCIC对HSA的猝灭常数分别为8.53× 104、 7.05× 104和6.05× 104 L· mol-1, 实验结果表明DCIC对HSA的猝灭机制为静态猝灭, DCIC与HSA之间的主要作用力为氢键和范德华力。 同步荧光实验中, 当Δ λ 为60 nm时, 最大发射波长出现蓝移, 结果表明DCIC可能引起HSA蛋白质构象发生变化, 影响了氨基酸等残基周围的微环境。 分子对接模拟表明, DCIC与HAS主要通过氢键、 范德华力和疏水作用力发生作用, 在区域Ⅱ A(位点site Ⅰ )的疏水腔内结合, 该结果与位点竞争实验及荧光实验基本一致。 该研究为去甲斑蝥素类化合物在人体的分布、 运输、 药代动力学等, 提供重要的理论依据和实践参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|