作者简介: 叶艳青, 女, 1967年生, 云南民族大学化学与环境学院教授 e-mail: yey-qing@163.com
采用GC-MS和FTIR分析, 结合PCA、 PLS等多元分析方法, 对霉变烟叶进行评价鉴别。GC-MS分析筛选得到2-乙基己醇等9个烟叶霉变标记物。通过4-羟基丁酸内酯等9个关键化合物构建的线性判别方程, 可以实现烟叶霉变准确识别, 初始验证准确率100%和留一交叉验证准确率为98.7%。FTIR研究表明, 烟叶霉变过程中消耗了烟叶大量的碳水化合物、 蛋白质和脂质等。GC-MS和FTIR, 分别结合PCA和PLS-DA能实现霉变烟叶的有效判别。
GC-MS and FTIR analysis, combined with multivariate analysis methods such as PCA and PLS, were used to evaluate and identify moldy tobacco leaves. GC-MS analysis screened 9 markers of tobacco leaf mold, including 2-ethylhexanol. The linear discriminant equation constructed by 9 key compounds, such as 4-hydroxybutyrolactone, can accurately identify tobacco leaf mold, with an initial validation accuracy of 100% and a cross-validation accuracy of 98.7%. FTIR studies have shown that the moldy process of tobacco leaves consumes a large amount of carbohydrates, proteins, and lipids. GC-MS and FTIR, combined with PCA and PLS-DA respectively, can effectively distinguish moldy tobacco leaves.
烟叶的自然醇化是提高烟叶燃吸品质和可用性的必要环节, 片烟醇化周期通常为12~30个月[1, 2, 3], 期间由于烟叶吸湿性强, 含有微生物生长所需要的营养物质[4], 易导致烟叶发生霉变。霉变是影响烟丝质量的重要因素之一, 严重影响烟叶的外观品质和香味品质, 降低烟叶的使用价值[5]。如何有效地区分霉变和非霉变烟丝, 有效控制烟丝质量急为迫切。
烟叶霉变是指因霉菌在烟叶上滋生繁殖引起的烟叶变质[6]。目前生成过程中应用烟叶霉变的检测方法, 主要按照标准YC/T 475-2013[6]通过视觉和嗅觉观察是否有霉斑或白、 青色的绒毛状物, 以及是否有霉味, 少量难以鉴别的烟叶样品通过麦角甾醇检测进行验证。麦角甾醇是真菌中主要的甾醇类化合物, 可作为霉变检测的化学标志物[7]。麦角甾醇含量分析是烟叶霉变鉴别的重要方法[8]。关于麦角甾醇的常用分析方法主要有薄层色谱法[9]、 高效液相色谱[10]、 气相色谱-质谱联用[11]等。这些方法存在前处理复杂的问题, 如GC-MS分析时样品需要用双(三甲基硅烷基)三氟乙酰胺进行衍生[11]。不是所有的真菌都产生霉变, 部分霉菌在烟叶调制中存在改善风味的作用, 因此在未霉变烟叶中也存在一定量的麦角甾醇, 黄龙等研究目前烤烟中麦角甾醇含量为0.1~0.2 mg· g-1 [12], 郭乐乐在晾晒烟和雪茄烟中同样检测到麦角甾醇[13]。采用近红外[14]以及电子鼻[15]结合化学计量学方法进行霉变烟叶识别的方法也有报道。这两种方法很难解析烟叶霉变过程中具体的化学成分变化, 有必要开发新的霉变烟叶的评价方法。
挥发性有机化合物检测在农产品质量检测中应用广泛[16]。烟叶霉变过程中将释放出各种挥发性有机化合物。气相色谱-质谱联用(GC-MS)分析对挥发性化合物具有高效分离和鉴别的特点[16]。可以采用GC-MS分析技术对烟叶霉变过程中挥发性代谢物变化进行解析, 实现烟叶霉变差异成分的识别, 筛选出新的挥发性标记物。傅里叶变换红外光谱(FTIR)作为一种广泛应用的快速检测方法, 具有简单、 快速等特点, 同时通过特征吸收峰可以对样品的官能团以及化学成分进行解析, 具有很好的应用前景[17, 18, 19, 20, 21]。
本研究用中红外对烟叶化学成分整体化学成分解析以及GC-MS对具体成分分离鉴别的优势, 多维度解析烟叶霉变过程中的代谢物变化, 筛选出新的代谢标记物。结合主成分分析(PCA)、 偏最小二乘法判别分析(PLS-DA)以及线性判别等多元统计分析方法, 对霉变烟叶和正常烤烟烟叶进行研究, 以获得快速准确有效的鉴别霉变烟叶方法。
实验所用样品为云南中烟工业股份有限公司原料中心提供, 经烟叶专家按照标准YC/T 475-2013[6]鉴定的51个霉变(MB)和24个正常烤烟(KY)烟叶。烟叶样品品种为红大、 K326。样品在40 ℃, 干燥24 h后, 用旋风磨磨成40~60目的粉末。
氘代甲苯(分析标准品): 上海阿拉丁生化科技股份有限公司; 正己烷(色谱纯): 德国Merck公司。饱和正构烷烃(C7—C30): 美国Supelco公司; 浓硫酸(98%), 石油醚(30—60): 西陇化工。
气相色谱-质谱联用仪(型号7890B-5977B): 美国Agilent Technologies公司; DB-5MS毛细管色谱柱(60 m× 250 μ m× 0.25 μ m): 美国Agilent Technologies公司; 85 μ m CAR/PDMS萃取头: 美国Supelco公司; MPS多功能进样器: 德国Gerstel公司; XP504电子天平: 瑞士METTLER-TOLEDO公司; 配备金刚石ATR附件的Nicolet is 20傅里叶变换红外光谱仪: 美国Thermo Scientific公司; UTURA Ⅱ 连续流量分析仪, 法国AMS公司。
1.3.1 样品处理
使用电子天平准确称取烟末0.2 g(精确至0.01 g), 置于20 mL棕色顶空瓶中, 加5 μ L浓度为0.5 μ g· μ L-1的氘代甲苯作为内标, 迅速拧紧瓶盖, 采用HS-SPME-GC/MS分析。
1.3.2 仪器条件
固相微萃取使用的萃取头为85 μ m CAR/PDMS, 进样量设为10 μ L, 平衡时间为5 min, 萃取温度为80 ℃, 萃取时间为20 min, 解吸附时间为5 min。
采用DB-5MS毛细管色谱柱(60 m× 250 μ m× 0.25 μ m)串联质谱(Agilent 5977)的GC (Agilent)对挥发性的化学成分进行分析。以He为载气, 流速为1 mL· min-1, 分流比为5∶ 1, 自动注入样品。温度编程: 起始温度40 ℃, 以5 ℃· min-1的速度上升到230 ℃, 保持恒温10 min。
离子源温度为230 ℃, 传输线温度为270 ℃。质谱记录在70 eV的电子冲击电离(EI)中, 在扫描范围35~350 amu下进行分析, 溶剂延迟为8.5 min。在上述GC/MS条件下得到了总离子电流, 对样品的主要成分进行了分析和鉴定。
1.3.3 定性定量分析
在上述GC-MS条件下得到了总离子电流, 通过与现有质谱数据库(NIST谱库)的质谱进行比较, 对挥发及半挥发性成分进行定性分析; 并将其实验保留指数与同类正构烷烃系列(C7—C20)在相同实验条件下测定的文献数据进行辅助定性。
式(1)中: RIx为所测组分的保留指数; n为待分析组分前一正构烷烃碳原子数; tRx为待分析组分的保留时间; tRn为待分析组分前一正构烷烃的保留时间; tR(n+1)为待分析组分后一正构烷烃的保留时间。
采用内标法(内标物为0.5 μ g· μ L-1的氘代甲苯)进行半定量测定, 完成单个峰的识别。
取少量烟末样品置于ATR元件表面, 旋转压杆压实后, 进行FTIR扫描。扫描分辨率为4 cm-1, 扫描范围为400~4 000 cm-1。H2O和CO2的干扰在扫描过程中自动扣除。每个样本测试3次, 以获得平均值并消除误差。对原始光谱进行吸光度、 自动基线校正和归一化, 以获得相应的标准化光谱。
所有数据采用SPSS进行单因素方差分析(ANOVA), F检验, 显著性水平p< 0.05, 进行差异性分析。采用SIMCA软件进行主成分分析PCA, 偏最小二乘判别分析PLS-DA分析。采用origin软件进行Pearson相关性分析。
采用上述检测方法进行分析检测, 通过ANOVA分析结果见表1。共检测到55种挥发性成分, 包括5种醇类、 7种醛类、 19种酮类、 7种酯类、 8种烃类、 9种其他化合物。其中在霉变烟叶和正常烟叶的38种共有成分中, 糠醇、 2-苯基乙醛、 4-环戊烯-1, 3-二酮、 甲基庚烯酮、 6-甲基-3, 5-戊二烯-2-酮、 α -大马酮、 壬酸乙酯、 正十四烷、 正十六烷、 2, 3, 5-三甲基吡嗪、 二甲基马来酸酐、 2-乙酰吡咯、 3-乙酰吡啶、 正壬酸14种化合物无显著性差异(p=0.5), 其中发生霉变的烟叶中苯甲醇、 6-乙基-5, 6-二氢-2H-吡喃-2-酮、 4, 7, 9-巨豆三烯-3-酮、 4, 7, 9-巨豆三烯-3-酮A、 4, 7, 9-巨豆三烯-3-酮D、 二氢猕猴桃内酯、 邻苯二甲酸二丁酯、 α -柏木烯、 烟碱、 二烯烟碱含量比正常烟叶中的高。
| 表1 霉变烟叶和正常烟叶挥发性成分 Table 1 Moldy tobacco leaves and normal tobacco leaves of volatile components |
(2R, 3R)-2, 3-丁二醇、 2-乙基己醇、 吡咯-2-甲醛、 2(5H)-呋喃酮、 2, 6, 6-三甲基-2-环己烯-1, 4-二酮、 D-(-)-泛酰内酯、 辛酸乙酯、 长叶烯、 对甲酚9种化合物仅在发生霉变的烟叶中检出, 其中吡咯-2-甲醛在51个霉变样品中有36个样品能检到, 其他8个化合物在所有霉变样品中都能检到。吡咯-2-甲醛在部分霉变样品中没有检测到可能和霉变样品的霉变菌种有关。2-乙基己醇作为标记化合物在多种真菌代谢物中检测到, 这些真菌包括曲霉(Aspergillus versicolor)[22], 丝膜菌(Cortinarius odorifer)[23], 青霉菌(Penicillium chrysogenum)[24], 镰刀菌(Fusarium xyrophilum)[25]。感染由膨胀青霉(Penicillium expansum)引起的蓝霉病的苹果, 侵染匍匐根霉(Rhizopus stolonifer)、 多球孢青霉(Botryosphaeria dothidea)和交替孢霉(Alternaria alternate)霉变后的苹果, 都能检测到特异性化合物辛酸乙酯[26, 27]。曲霉Aspergillus fumigatus和Aspergillus clavatus导致的霉变大米中, 均能检测到长叶烯[28]。这些化学成分在霉变的烟叶中检测到, 表明样品烟叶的霉变可能与曲霉菌、 青霉菌等霉菌有关, 结果与周家喜[29]报道类似, 具体霉变的菌种须进行微生物组学分析才能进一步确认。而上述的化合物可用作为霉变的标记化合物。
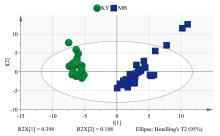
为了对霉变烟叶和正常烟叶进行区分, 分别对其进行无监督的主成分分析(PCA)。将检测的挥发性成分数据导入SIMCA, 进行PCA分析, 结果如图1所示。两种不同的烟叶区分明显, 表明通过SPME-GC/MS检测可以很好地区分已经发生霉变的烟叶和正常烤烟烟叶。
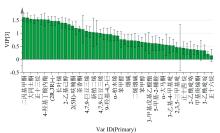
在PCA分析基础上, 将挥发性成分导入SIMCA, 进行有监督的偏最小二乘法-判别分析PLS-DA分析, 结果如图2所示。在PLS-DA图中, 霉变烟叶和正常烤烟烟叶聚类效果很好, 图3为其指纹图谱的VIP图, 通过VIP> 1, 筛选得到了22个特征成分, 分别是二丙基甲酮、 2, 3-二氢-2, 2, 6-三甲基苯甲醛、 大马士酮、 (E, E)-2, 4-庚二烯醛、 正十三烷、 糠醇、 4-羟基丁酸内酯、 D-(-)-泛酰内酯、 (2R, 3R)-(-)-2, 3-丁二醇、 3-(4, 8, 12-三甲基十三烷基)呋喃、 长叶烯、 2, 3-二氢-3, 5二羟基-6-甲基-4H-吡喃-4-酮、 2-乙基己醇、 6-乙基-5, 6-二氢-2H-吡喃-2-酮、 2(5H)-呋喃酮、 4-环戊烯-1, 3-二酮、 茶香酮、 3-甲基-1, 2-环戊二酮、 4, 7, 9-巨豆三烯-3-酮 B、 4, 7, 9-巨豆三烯-3-酮D、 新植二烯、 2-苯基乙醛、 4, 7, 9-巨豆三烯-3-酮A。
 | 图2 基于挥发性成分霉变烟叶和正常烤烟烟叶的PLS-DA图Fig.2 PLS-DA plot of moldy and normal tobacco leaves based on volatile components |
研究表明霉变烟叶和正常烤烟烟叶的挥发性成分指纹图谱显示出一定特征。为了进一步对不同烟叶进行区分, 筛选出不同烟叶的特征指标, 采用Fisher步进式线性判别分析方法对其进行了研究, 结果如表2所示。通过Fisher步进式线性判别分析, 共筛选出9个关键性指标, 分别为4-羟基丁酸内酯、 3-甲基-1, 2-环戊二酮、 二甲基马来酸酐、 D-泛酰内酯、 6-乙基-5, 6-二氢-2H-吡喃-2-酮、 二丙基甲酮、 2, 3-二氢-2, 2, 6-三甲基苯甲醛、 大马士酮、 9-羟基-4, 7-巨豆二烯-3-酮, 这些指标与PLS-DA分析中通过VIP筛选的指标基本相符, 进一步说明这9个指标是区分霉变烟叶和正常烟叶的关键性指标。
| 表2 霉变烟叶和正常烟叶Fisher线性判别函数 Table 2 Fisher linear discriminant function for moldy tobacco leaves and normal tobacco leaves |
通过上述关键指标组成的判别函数, 进行了验证, 结果如表3所示。在原始验证中, 霉变烟叶和正常烟叶均被正确分类, 验证识别正确率均为100%。交叉验证结果中, 仅1个正常烤烟烟叶误判为霉变烟叶, 交叉鉴别准确率为98.7%。因此, 基于Fisher线性判别分析, 可实现霉变烟叶和正常烤烟烟叶的鉴定, 而所选的9个关键指标就是其霉变烟叶和正常烟叶特征的关键性指标。
| 表3 不同烟叶Fisher线性判别预测结果验证 Table 3 Verification of Fisher linear discriminant prediction results for different tobacco leaves |
为了进一步研究烟叶霉变后化学成分的改变, 采用傅里叶变换红外光谱对普通烤烟和霉变烟叶进行了分析, 结果如图4所示, 红外光谱统计的结果如表4所示。烤烟烟叶中主要成分为: 脂质、 木质素、 蛋白质、 糖类(纤维素、 淀粉以及小分子糖)[30]。其中1 732 cm-1为烤烟烟叶脂质中C=O振动吸收峰, 霉变后吸收峰向1 734 cm-1偏移, 可能为脂质霉变过程中部分不饱和脂肪酸发生氧化所致[20]。农产品变质过程中, 脂质最容易发生变化, 通过C=O吸收峰高度比值, 表明霉变过程中降低了脂质约24.3%, 这部分脂质作为霉菌的碳源被代谢消耗。1 700~1 500 cm-1是烟叶中蛋白质的酰胺Ⅰ 带[18], 通过1 600 cm-1处峰高度比, 表明霉变过程中蛋白降低了约25.2%, 这部分蛋白质主要作为霉菌的氮源被代谢消耗。
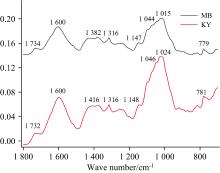 | 图4 正常烤烟烟叶和霉变烟叶样品的FTIR 所示的光谱曲线分别为样品的光谱曲线的平均值Fig.4 FTIR curves of normal and moldy tobacco samples The FTIR curves shown are the average values of the curves of thecorresponding samples |
| 表4 烟叶样品红外光谱归属 Table 4 Infrared spectral attribution of tobacco leaf samples |
1 500~1 350 cm-1为烟叶中木质素中芳香环及多糖中C—O吸收带, 由于正常的烟叶中糖含量明显多于木质素含量[17, 18, 21], 因此正常烤烟烟叶中1 416 cm-1主要表现为多糖中C—O吸收, 霉变烟叶中1 382 cm-1主要表现为木质素中芳香环吸收, 烟叶霉变后在吸收峰由向1 382 cm-1迁移, 可能是由于霉变过程木质素降解较少, 而多糖代谢多, 因此霉变后木质素的吸收峰相对较为明显; 通过峰强度比, 霉变后这个吸收带的峰强度降低了16.5%, 而其中大部分为碳水化合物的消耗, 木质素消耗量很少, 进一步证实了上述推测。
1 190~940 cm-1主要为多糖吸收带, 其中1 148 cm-1峰为多糖C—OH吸收峰, 1 046 cm-1为多糖中C—H键吸收峰, 1 024 cm-1处为糖苷键C—O—C的吸收峰[17, 18, 21], 霉变烟叶对应为1 147、 1 044和1 015 cm-1, 通过最高处峰强度比, 表明霉变过程糖消耗了38.1%, 分析认为由于烟叶中的多糖作为主要碳源被霉菌代谢消耗。
以上分析表明, 烟叶霉变过程主要消耗烟叶的糖水化合物, 其次是蛋白质和脂质, 木质素消耗较少。
为了验证上述红外分析结果, 总糖和蛋白质分别按照YCT 159-2002[31]、 YC/T 249-2008[32]标准方法, 采用连续流动分析仪进行检测, 总脂质参照文献[33]采用石油醚-索氏提取法进行检测, 木质素采用硫酸法[34]进行检测, 所得结果如表5所示。烟叶霉变后总糖含量降低最多降低了24.09%, 其次是蛋白质和总脂质分别降低了19.52%和9.18%, 它们分别作为霉菌的主要碳源和氮源被代谢消耗掉, 降低的趋势也与红外分析结果基本相符。霉变烟叶中木质素含量增加, 可能是由于木质素结构复杂, 霉菌难以代谢, 使得木质素消耗较少或者不消耗, 而在霉变烟叶中糖和蛋白含量的显著减少, 使得霉变烟叶中的木质素含量相对增加。由于检测方法的不同, 样品化学成分变化的具体数据不完全一致, 而趋势和结论与红外分析结果基本一致。
| 表5 烟叶样品的烟草化学成分 Table 5 Tobacco chemical compositions of tobacco samples |
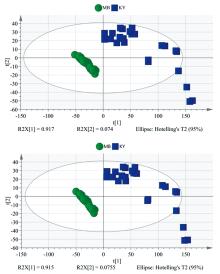
采用PCA和PLS-DA对红外区分霉变烟叶进行了研究, 结果如图5(a, b)所示。结果与气质PCA和PLS-DA分析结果一致, 霉变烟叶与正常烤烟区分明显, 不存在任何交叉和重叠, 因此采用红外-PCA或PLS-DA分析能对霉变烟叶进行准确的区分。
通过对霉变烟叶和正常烤烟烟叶的GC-MS以及FTIR分析, 结合PCA、 PLS-DA以及线性判别等化学计量学方法, 对霉变烟叶进行评价判别, 研究结论如下:
(1)(2R, 3R)-2, 3-丁二醇、 2-乙基己醇、 吡咯-2-甲醛、 2(5H)-呋喃酮、 2, 6, 6-三甲基-2-环己烯-1, 4-二酮、 D-(-)-泛酰内酯、 辛酸乙酯、 长叶烯、 对甲酚作为烟叶霉变的标记物, 可以对霉变烟叶实现有效鉴别, 烟叶霉变主要可能为曲霉菌和青霉菌感染所造成。
(2)GC-MS结合PCA和PLS-DA可以对霉变烟叶实现有效判别, 通过4-羟基丁酸内酯、 3-甲基-1, 2-环戊二酮、 二甲基马来酸酐、 D-泛酰内酯、 6-乙基-5, 6-二氢-2H-吡喃-2-酮、 二丙基甲酮、 2, 3-二氢-2, 2, 6-三甲基苯甲醛、 大马士酮、 9-羟基-4, 7-巨豆二烯-3-酮等9个关键化学成分构建的线性判别方程, 对霉变烟叶的初始验证准确率100%和交叉验证准确率98.7%。
(3)红外分析表明, 烟叶霉变过程主要消耗烟叶的糖水化合物, 其次是蛋白质和脂质, 木质素消耗较少。FTIR结合PCA和PLS-DA可以实现霉变烟叶的准确鉴别。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|