作者简介: 逯美红, 女, 1979年生, 长治学院物理系教授 e-mail: lmhxueer@126.com
中医药是中华文化的瑰宝和中华文明的结晶, 在全民健康中发挥着重要作用。由于中药生长环境受限及市场需求量的增大, 市场上出现了许多以次充好、 以假乱真的中药, 这对中药发展及质量保障都极为不利。因此, 对中药的检测和鉴定非常重要。为了探究中药的荧光光谱和拉曼光谱特性, 选取白芷、 苏木、 山药、 地榆四种中药进行分类检测研究。一方面, 从化学成分和结构的角度分析中药白芷和苏木产生荧光的可能性, 采用F-4600型荧光光谱仪(200~750 nm)分别在不同激发波长和不同浓度下测试了白芷和苏木水浸液的荧光光谱, 探究了白芷和苏木水浸液的荧光光谱特性, 并对荧光强度与不同浓度、 激发波长的关系进行了探讨。另一方面, 采用共聚焦显微拉曼光谱仪(100~4 000 cm-1)对4种不同产地的山药和2种不同产地的地榆中药饮片的拉曼光谱分别进行测试研究。结果表明, 白芷水浸液在波长260~350 nm的光激发下, 产生较强荧光, 最佳激发波长是340 nm, 荧光峰值波长为420 nm, 其荧光强度随浓度的增大而增强, 且样品浓度较低时, 荧光强度与浓度成线性关系; 苏木水浸液在200~290 nm的光激发下, 产生较强荧光, 最佳激发波长为220 nm, 荧光峰值波长为345 nm, 随浓度的增加, 荧光强度先增强后减弱, 在浓度为0.175 mg·mL-1时荧光强度达到最大。白芷水浸液和苏木水浸液的荧光强度都与激发波长的关系呈现高斯分布, 符合荧光规律。分析山药和地榆的拉曼光谱, 发现不同产地的拉曼特征基本一致, 确认山药的拉曼特征峰主要集中在477、 862、 939、 1 080、 1 258、 1 337和1 457 cm-1处; 地榆的拉曼特征峰主要集中在862和1 337 cm-1处, 主要归属与已有的化学成分研究结果相符。部分特征峰处拉曼活性出现差异, 可以作为区分不同产地中药的依据。该研究结果不仅为荧光光谱在中药鉴定及质量分析中的应用提供了实验数据和方法参考, 也为利用拉曼光谱技术实现中药的快速准确检测及产地归属奠定了基础。
Traditional Chinese medicine is a treasure of Chinese culture and the crystallization of Chinese civilization, playing an important role in the health of the whole nation. Due to the limited growth environment of traditional Chinese medicine and the increasing market demand, numerous substandard and falsified traditional Chinese medicines have emerged in the market, which is extremely detrimental to the development and quality assurance of traditional Chinese medicine. Therefore, it is of utmost importance to detect and identify traditional Chinese medicine. Four medicinal herbs, angelica dahurica, Sappanwood, yam, and sanguinaria officinalis, were selected for classification and detection research to explore traditional Chinese medicine’s fluorescent and Raman spectral characteristics. On the one hand, in this paper, we analyzed the possibility of angelica dahurica and sappanwood, traditional Chinese medicinal herbs, to exhibit fluorescence from the perspectives of chemical composition and structure. An F-4600 fluorescence spectrophotometer (200~750 nm) was used to measure the fluorescence spectra of aqueous extracts of angelica dahurica and sappanwood at different excitation wavelengths and concentrations, investigating the fluorescence spectral characteristics of aqueous extracts of angelica dahurica and sappanwood, and discussing the relationship between fluorescence intensity and different concentrations and excitation wavelengths. On the other hand, a confocal micro-Raman spectrometer (100~4 000 cm-1) was used to conduct Raman spectroscopy tests on herbal slices of yam from four different regions and sanguisorba officinalis from two different regions, and then the Raman spectra were obtained. The results showed that the aqueous extract of angelica dahurica exhibited strong fluorescence under excitation wavelengths ranging from 260 to 350 nm. The optimal excitation wavelength is 340 nm, and the peak fluorescence wavelength is 420nm. The fluorescence intensity increased with the concentration increase, following a linear relationship at lower concentrations. The aqueous extract of sappanwood exhibited strong fluorescence under excitation wavelengths ranging from 200 to 290 nm, with the optimal excitation wavelength at 220 nm and the peak fluorescence wavelength at 345nm. With the increase inconcentration, the fluorescence intensity first increased and then decreased, reaching its maximum at 0.175 mg·mL-1. Moreover, the fluorescence intensity of angelica dahurica and sappanwood aqueous extracts followed a Gaussian distribution about the excitation wavelength, followed by the fluorescence law. After analyzing the Raman spectra of yam and sanguisorba officinalis, it was found that the Raman characteristics of different producing areas were the same. The Raman characteristic peaks of yam were mainly concentrated at 477, 862, 939, 1 080, 1 258, 1 337, and 1 457 cm-1. The Raman characteristic peaks of sanguisorba officinalis were mainly concentrated at 862, 1 337 cm-1, consistent with the existing research results on chemical composition. Differences in Raman activity at certain characteristic peaks can be used to distinguish the origin of different traditional Chinese medicines. The research results provide experimental data and method references for applying fluorescence spectroscopy in the identification and quality analysis of traditional Chinese medicine, and they also lay the foundation for the rapid and accurate detection and origin attribution of traditional Chinese medicine by using Raman spectroscopy techniques.
白芷、 苏木、 山药和地榆都是常用的中药药材, 在传统医学中有着广泛的应用, 其功效和作用非常显著。山药和白芷营养丰富, 具有燥湿健脾的功效; 苏木和地榆分别具有祛瘀通经和止血解毒的功效[1, 2, 3, 4]。随着国家大力振兴中药文化, 市场上对中药药材的需求逐步扩大, 但问题也随之而来。市面上出现了许多以假乱真、 以次充好的中药药材, 而药效的好坏与药材的优劣有着密不可分的联系[5]。因此, 为了维护中药市场秩序并保障药品的安全性和有效性, 中药材真伪鉴定显得尤为重要。
对中药的检测方法有: 高效液相色谱法[6]、 气相色谱法[7]、 紫外吸收光谱法[8]、 近红外光谱技术[9]和傅里叶变换红外光谱法[10]等, 主要对其活性成分分析、 化学成分的提取分离及其药理作用的分析展开研究。随着国际社会对中草药的质量掌控越来越重视, 具有灵敏度高、 操作简便、 所需的试样量少、 成本低等诸多优点的荧光光谱技术及拉曼光谱技术在中药质检、 鉴定中发挥其巨大的潜力[11, 12, 13, 14, 15, 16, 17]。林文硕等[18]利用近红外拉曼光谱技术获得了山药、 地榆的拉曼光谱以及麻黄与杏仁、 桂枝混合汤剂的红外光谱, 并对其主要成分进行了定性分析; 董晶晶等[19, 20]应用激光拉曼光谱对三七、 三七花、 姜黄成分进行了分析; 史芳芳等[21]利用激光拉曼光谱仪采集了不同状态和部位的涪城麦冬样品的拉曼光谱图, 并分析了成分分布; 冯尚源等[22]测试研究了党参中药材的拉曼光谱以及党参煎剂的表面增强拉曼光谱, 并对谱峰进行初步振动归属; 战瑞雪等[23]基于传统荧光法和荧光光谱法对4种人参属中药材进行了鉴别研究。然而, 光谱分析技术在中草药方面的检测与应用研究还有待进一步拓展, 特别是, 对苏木和白芷水浸液的荧光光谱分析以及利用拉曼光谱技术进行不同产地中药的鉴别研究还未见报道。
本文一方面以白芷和苏木为研究对象, 利用荧光光谱技术测试白芷、 苏木水浸液的最佳激发波长, 对不同浓度白芷、 苏木水浸液在该激发波长下的荧光特性进行研究, 并探讨荧光强度与浓度、 激发波长的关系。另一方面, 以山药和地榆为研究对象, 利用拉曼光谱技术测试不同产地的山药和地榆的拉曼光谱, 对比并分析其光谱特性。
实验采用的荧光光谱仪为日立公司生产的F-4600型荧光光谱仪。光源为150 W氙灯, 光源光谱范围为200~750 nm, 扫描速度为2 400 nm· min-1, 激发狭缝5 nm, 发射狭缝5 nm, 光电倍增管电压为400 V, 波长间隔为10 nm, 扫描波长间隔为1 nm, 反应时间为4 s。白芷水浸液对应的激发波长为260~350 nm, 苏木水浸液的激发波长为200~290 nm。
实验采用的拉曼光谱仪为德国BRUKER公司生产的显微共聚焦拉曼光谱仪。仪器由显微镜、 光谱仪、 CCD软件、 计算机数据处理系统几个主要部分构成。实验中, 测试山药样品时的激发光波长为785 nm, 测试地榆样品时的激发光波长为532 nm, 物镜为50倍, 样品表面的激光功率为50 mW, 信号采集时间为100 s, 猝灭功率为50 mW, 累加次数为3次, 猝灭时间为10 s, 光阑为25× 1 000 μ m, 光谱范围为: 100~4 000 cm-1。
实验测试所用的白芷和苏木药材片均购于中医药药品店。配置及实验方法如下: (1)将药品清洁干燥, 用粉碎机粉碎, 用电子天平称取5.00 g于锥形瓶中, 用量筒量取200 mL蒸馏水置于锥形瓶中, 浸泡1 h。(2)将锥形瓶置于微波中加热2.5 min, 冷却后过滤取上层清液, 溶液配制成不同浓度后放在离心管中待用。(3)将配好的中药水浸液用移液枪移取1 mL置于5 mL的石英比色皿中, 放入荧光光谱仪中, 进行荧光光谱扫描。
实验测试所用的山药和地榆两种中药饮片均购于中医药药品店, 其中山药样品产自安徽、 河北、 河南、 内蒙四个地区, 地榆样品产自安徽、 山东两个地区。在室温下将中药饮片样品放在干净的载玻片上, 将光点聚焦在样品表面上, 即可测试。
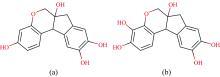
荧光是一种光致发光现象, 其荧光产生机理及荧光光谱规律都取决于物质的分子结构特点。一般认为, 产生荧光的物质分子大多具有刚性平面结构, 且含有共轭双键(π 键)结构、 荧光发色基团或含有一个以上的芳香基团, 共轭体系越大, 荧光越容易产生, 且芳香环数目越多, 荧光峰值波长越红移, 荧光强度越强[24]。白芷的主要成分为欧前胡素(C16H14O4)、 异欧前胡素(C16H14O4)等; 苏木的主要成分为巴西苏木素(C16H14O5)、 苏木色精(C16H14O6)等。主要成分结构如图1和图2所示。其中大多是刚性平面结构, 且均含有芳香基团、 共轭双键, 所以白芷和苏木均可以产生很强的荧光。通过实验测得中药的荧光光谱并分析荧光特征, 建立荧光光谱特征数据库, 根据荧光峰特征及相对强度大小为进一步鉴定识别、 成分含量分析等提供重要表征依据。
 | 图1 白芷主要成分结构 (a): 欧前胡素; (b): 异欧前胡素Fig.1 Main component structure of angelica dahurica (a): Imperatorin; (b): Isoimperatorin |
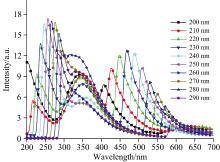
改变激发波长, 分别测试白芷水浸液和苏木水浸液的荧光光谱, 激发狭缝设置为2.5 nm, 发射狭缝设置为5 nm, 通过观察荧光强度的变化, 确定其最佳激发波长, 结果如图3和图4所示。由图3可以看出, 在260~350 nm的激发光照射下, 白芷水浸液在420 nm附近产生明显的荧光峰, 随着激发波长的增大, 荧光相对强度逐渐增大, 在340 nm的激发光照射下, 420 nm附近的荧光相对强度达到最大, 随后逐渐降低。520~600 nm的峰随激发波长的变化发生变化, 为入射光的散射峰。由图4可以看出, 苏木水浸液的荧光主要分布在一个明显的区域, 波长范围是300~400 nm。在200~290 nm的激发光照射下, 苏木水浸液在345 nm附近的峰位不随波长改变而改变, 确定其为荧光峰。在200~240 nm激发光照射下, 激发波长与荧光发射波长相差较大, 荧光相对强度较弱, 且随着激发波长增大而降低。用波长大于240 nm的光激发时, 荧光相对强度增大, 且随着激发波长的增大, 先增大后减小。根据荧光峰的特点, 确认220 nm为最佳激发波长。
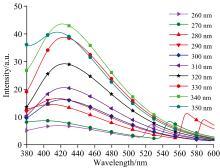 | 图3 260~350 nm激发波长下的白芷水浸液荧光光谱Fig.3 Fluorescence spectra of angelica dahurica aqueous extracts at excitation wavelengths of 260~350 nm |
为了对中药材水浸液的荧光光谱特性有更深入的研究, 在最佳激发波长340和220 nm照射下, 分别对不同浓度的白芷水浸液和苏木水浸液进行检测, 探究样品浓度对荧光特性的影响。图5是在0.025~2.5 mg· mL-1范围内九种不同浓度白芷水浸液的荧光光谱。从图中可以看出, 340 nm激发波长下, 在420 nm附近有明显的一个荧光峰, 随着白芷水浸液浓度的增加, 荧光强度逐渐增强, 荧光峰位基本不变。图6是在0.025~2.5 mg· mL-1范围内十种不同浓度的苏木水浸液的荧光光谱图。从图中可以看出, 220 nm激发波长下, 345 nm附近荧光峰强度随着浓度的增加先增强后减弱。当苏木水浸液浓度为0.175 mg· mL-1时, 荧光强度达到最大, 继续增大苏木水浸液的浓度, 其荧光强度减弱, 且伴随谱峰中心波长红移, 原因可能是形成的激基缔合物和荧光化合物浓度猝灭共同作用的结果。对比图3—图6, 不同种类中药的荧光性质不同, 同一浓度下, 荧光强度不同。
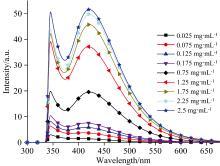 | 图5 0.025~2.5 mg· mL-1浓度下的白芷水浸液荧光光谱Fig.5 Fluorescence spectra of angelica dahurica aqueous extracts at concentrations of 0.025~2.5 mg· mL-1 |
用一束光强为I0的紫外-可见光照射一厚度为b、 盛有浓度为c的溶液的样品池, 观察其荧光。令其荧光强度为Fλ , 透射光强度为Id, 吸收光强度为Ia。物质吸收激发光的部分能量后发射更长波长的光, 产生荧光, 因此, 荧光强度与量子产率等因素有关。荧光强度可由公式
| 表1 白芷在不同激发波长及不同浓度下的荧光强度 Table 1 Fluorescence intensity of angelica dahurica at different excitation wavelengths and concentrations |
| 表2 苏木在不同激发波长及不同浓度下的荧光强度 Table 2 Fluorescence intensity of sappanwood at different excitation wavelengths and concentrations |
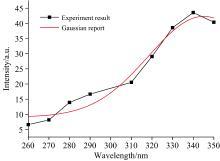 | 图7 白芷水浸液激发波长与荧光强度的高斯拟合Fig.7 Gaussian fitting of excitation wavelength and fluorescence intensity of angelica dahurica aqueous extracts |
由比尔定律可推得[25]: 荧光强度
 | 图9 白芷水浸液浓度与荧光强度的关系及线性拟合关系Fig.9 Relationship and linear fitting between the concentration of angelica dahurica aqueous extracts and fluorescence intensity |
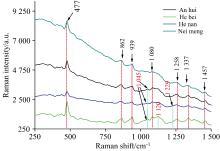
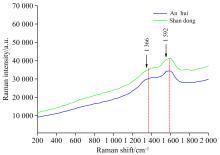
分别在785和532 nm波长激发下, 测得四种不同产地山药样品和两种不同产地地榆的拉曼光谱, 如图11和图12所示。由图11可知, 山药在300~1 500 cm-1光谱范围内有明显的拉曼特征峰, 且不同产地的拉曼光谱的特征峰峰位基本一致, 位于477、 862、 939、 1 080、 1 258、 1 337和1 457 cm-1处, 偏差不超过5 cm-1, 说明不同产地的山药成分相同, 与文献中报道结果一致[18]。其中, 河北产地的山药拉曼光谱在477 cm-1处的拉曼活性较强; 河北和安徽产地的山药拉曼光谱在1 045 cm-1处有明显的拉曼峰, 而内蒙和河南产地的没有; 河北产地的山药拉曼光谱在1 120 cm-1处拉曼活性明显, 而其他三个产地拉曼光谱在该处的拉曼活性极弱, 很不明显; 河南产地的山药拉曼光谱在1 229 cm-1处有明显的拉曼峰, 而其他产地的没有; 这些差异可作为区分不同产地的依据。由图12可知, 地榆在1 366和1 592 cm-1附近处出现明显的拉曼特征峰, 且不同产地的拉曼特征峰位一致, 但因物质成分复杂及荧光影响, 拉曼峰被淹没或不同振动峰重叠合并形成较宽的谱峰特点, 影响了拉曼光谱的一些拉曼活性。总之, 测试获得的山药和地榆拉曼信号, 显示了山药中生化物质的指纹特性, 其特征峰峰位与峰形特点可以作为研究中药成分检测鉴定的重要指标。对照特征拉曼频率初步指定表[26, 27, 28, 29], 山药拉曼光谱中, 477、 862和1 337 cm-1对应的为支链淀粉, 939、 1 080和1 457 cm-1对应的为糖原, 1 258 cm-1对应的为直链淀粉; 地榆拉曼光谱中特征峰对应为氨基葡萄糖。
由于不同种类中药的化学成分及结构不同而具有不同的荧光光谱和拉曼光谱特征, 基于此, 本文主要研究了中药白芷和苏木水浸液的荧光光谱及山药和地榆饮片的拉曼光谱特性。荧光光谱检测结果显示, 白芷水浸液和苏木水浸液都可以在紫外光的激发下产生荧光, 最佳激发波长分别为340和220 nm, 荧光峰值波长分别为420和345 nm; 在对应最佳激发波长下测试了0.025~2.5 mg· mL-1浓度范围内白芷和苏木水浸液的荧光光谱, 当溶液为稀浓度时, 荧光强度与浓度成线性关系; 当浓度增大到一定程度, 由于猝灭等原因, 荧光强度会减弱; 产生荧光时激发态的初始强度一定时, 荧光强度与激发波长呈高斯分布, 符合荧光规律。拉曼光谱检测结果显示, 山药和地榆中药饮片有明显的拉曼特征峰, 而且不同产地的主要拉曼光谱特征基本一致, 说明不同产地中药的主要成分是相同的, 可以作为鉴定和识别的依据; 拉曼光谱中存在的个别特征差异, 可以作为区分不同产地归属的表征。该研究工作表明拉曼光谱和荧光光谱技术可以为中药的定性鉴别提供客观有效的方法, 对于保障中药的质量监控和安全使用具有重要意义。然而, 由于白芷和苏木荧光较强, 在拉曼光谱检测中, 难以获得可靠有效的拉曼信号。因此, 提高检测灵敏度的研究工作有待进一步深入开展。此外, 山药和地榆具有明显的拉曼特征, 为中药光谱数据库的建立和补充提供了实验依据, 对进一步开展中药成分分析和振动模式归属具有指导意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|