作者简介: 孟晓慧, 2000年生, 浙江农林大学食品与健康学院与浙江省林业科学研究院硕士研究生 e-mail: xiaohui_meng23@163.com
藤茶中主要黄酮类物质——二氢杨梅素(DMY)具有多种生物活性, 而其降血脂机理鲜有报道。采用紫外光谱研究了DMY对胰脂肪酶(PL)的抑制作用, 结合荧光光谱、 同步荧光光谱、 三维荧光光谱及分子对接模拟法研究了二者之间的相互作用及机理。紫外光谱测得DMY对PL的半抑制浓度为2.6×10-4 mol·L-1, 表明其对PL具有较好的抑制作用, 采用Lineweaver-Burk方程得出该抑制剂为竞争性作用, 其抑制常数为6×10-4 mol·L-1; 通过Stern-Volmer方程和静态猝灭双对数公式对293和310 K两者互作的荧光光谱计算, 结果表明DMY能猝灭PL的自发荧光, 荧光猝灭方式为静态猝灭, 猝灭常数 KSV与温度负相关; 结合常数 Ka与温度正相关, 结合位点数 n约为1, 说明DMY与PL结合并形成稳定的配位复合物; 采用Van’t Hoff方程求出结合过程中的热力学参数Δ S=0.201 4 J·mol-1·K-1, Δ H=32.311 kJ·mol-1, Δ G小于0, 表明两者通过疏水作用力自发结合且放热; 由Förster非辐射能量转移理论计算出结合距离 r=1.475 nm, 说明DMY与PL结合生成复合物时发生了非辐射能量转移; 同步荧光光谱结果表明, DMY与PL的相互作用对PL的二级构象发生了明显改变, 主要作用于色氨酸(Tyr)附近。紫外光谱进一步揭示DMY可使PL发生π→π*跃迁, 导致其氨基酸残基的微环境变化; 三维荧光光谱显示DMY可使PL两个特征峰(peak1, peak2)分别红移10和5 nm, 荧光强度分别下降51.38%和41.93%, 证实两者发生疏水作用后PL的微环境极性增大, 构象改变; 分子对接模拟结果表明, DMY结合位点位于PL中由PHE77、 PHE215、 TYR114、 ILE209、 PRO180氨基酸形成的疏水口袋内, 其A环C5、 B环C4'、 C环C3、 C环—C=O的—OH分别与氨基酸HIS263、 TYR114、 SER152、 PHE215形成氢键, 与氨基酸LRU213、 GLU179、 ALA178、 THR78产生范德华力。实验数据有助于深入解DMY的降血脂分子作用机制, 其独特的结构为天然抑制剂的药物合成和筛选提供了理论依据。
A natural plant named vine (Ampelopsis grossedentata) has been proven to exsert various bioactivities due to its major component of dihydromyricetin (DMY), but there is little information on its hypolipidemic function. In this study, the inhibition behavior of DMY based on pancreatic lipase (PL) assay was investigated by ultraviolet spectroscopy followed by a series of multiple-spectroscopy measurements including fluorescence spectroscopy, synchronous fluorescence spectroscopy and 3D fluorescence spectroscopy as well as the DMY-PL interaction mechanism by molecular docking. The half inhibitory concentration (IC50) of PL detected by UV spectroscopy was 2.6×10-4 mol·L-1, showing its satisfactory lipid-lowering capacity on PL. The calculation of the Lineweaver-Burk equation indicated their interaction type was competitive inhibition with the inhibition constant of 6×10-4 mol·L-1. The Stern-Volmer equation and static quenching double logarithmic formula analyzed the fluorescence spectra. The results suggested that DMY could significantly quench PL’s self-luorescence and its fluorescence quenching constant KSV was negatively sensitive to temperature, revealing that the fluorescence quenching process belonged to static quenching. The value of 1 for the binding site and positive relation of Ka to temperature demonstrating PL might combine one DMY to produce a stable complex, which was further evidenced by Kq values exceeding 2.0×1010 L·mol-1·s-1. According to the Van’t Hoff equation, the results of thermodynamic parameters Δ S=0.201 4 J·mol-1·K-1, Δ H=32.311 kJ·mol-1 and Δ G<0 under 293 and 310 K elaborated that the binding force was mainly hydrophobic force and a spontaneous and exothermic process. The binding distance r=1.475 nm reflected the possible non-radiative energy transfer from PL to DMY based on the theory of Förster’s non-radiative energy transfer. Both synchronous fluorescence spectroscopy and UV spectroscopy results ascertained that the amino acid residue microenvironment and secondary structure of PL changed after the interaction with DMY. The former displayed DMY could bind to the surroundings of tryptophan (Trp) residue in PL by 2 nm red-shifts of the spectrum (Δ λ=60 nm), while the latter uncovered the π→π* transition of PL interacted with DMY. 3D fluorescence spectroscopy found the polarity of PL increased after hydrophobic interaction with DMY by 10 nm red-shifts of peak1 causing 51.38% decrease of fluorescence intensity and 5 nm bathochromic shifts of peak2 with 41.93% loss of fluorescence intensity. Moreover, the molecular docking results showed that the DMY binding site was located in the pocket of PL, which was formed by PHE77, PHE215, TYR114, ILE209, and PRO180 amino acids. The hydrogens in amino acids of HIS263, TYR114, SER152, and PHE215 could be linked to —OH of DMY on A ring C5, B ring C4', C ring C3 and C ring —C=O via hydrogen bonds, and other amino acids including THR78, LRU213, GLU179 and ALA178 may formed van der Waals forces with DMY. The experimental data obtained to a deeper understanding of the lipid-lowering molecular mechanism of DMY and its unique structure provides a theoretical basis for drug synthesis and screening of natural inhibitors.
肥胖又称慢性代谢疾病, 多因不健康的饮食习惯和缺乏运动造成脂肪在体内堆积形成, 同时也是引发诸如糖尿病、 非酒精性脂肪性肝、 高血脂、 高血压、 癌症等疾病的潜在诱因[1]。胰脂肪酶(pancreatic lipase, PL)由胰腺合成并分泌出一种水解酶, 承担着胃肠道中约2/3膳食脂肪的水解, 能将膳食脂肪中的甘油三酯水解成小分子的甘油单脂和脂肪酸以满足人体能量代谢的需要。若有效抑制PL的活性, 便能够降低脂肪的水解和人体肠道对脂质的吸收, 从而达到减肥降脂的目的[2]。目前, 奥利司他(Orlistat)是临床常用的半合成PL抑制剂, 而长期使用会引起胃胀气增多、 腹泻等副作用[3]。因此由植物界中筛选毒副作用低、 效果良好的PL抑制剂来预防和控制肥胖及与肥胖相关疾病的发生, 具有重要的意义。
在寻找天然PL抑制剂的过程中, 研究人员发现黄酮类化合物对PL活性具有抑制效果, 已知有效抑制脂肪酶的黄酮类化合物结构特征: C环上C-2和C-3之间存在双键, 保持了A环和C环的共面性; C-4位上存在一个羰基; C-5位上存在一个羟基; 3'、 4'、 5'位上存在羟基[4]。其中B环上OH基团的数量和位置, 包括C2=C3键的不饱和程度, 是获得高抑制作用的关键。大多数情况下, 高度羟化与酶的强相互作用和抑制作用相吻合, 已在不同的酶上得到证实, 如血管紧张素酶[5]、 消化酶如α -葡萄糖苷酶[6]、 α -淀粉酶[7]和醛糖还原酶[8]等。因此寻找天然富含黄酮类物质的植物资源成为热潮。
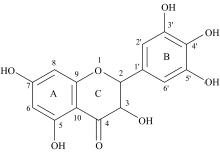
藤茶又名“ 别样茶” , 是葡萄科蛇葡萄属藤本植物[Ampelopsis grossedentata(Hand-Mazz.)W.T.Wang.], 在我国已有数百年的应用历史, 对入肝, 胃、 肺、 肾经, 具有利湿消肿的功效, 可通过调节肺, 脾, 肾, 肝各脏功能而利湿消肿从而发挥治疗肥胖的作用[9]。其富含30%以上的二氢杨梅素(Dihydromyricetin, DMY), 是一种二氢黄酮醇类化合物(图1), 具有抗肿瘤、 抗氧化、 抗血栓、 抗病毒、 抗炎抗菌、 降血糖血脂、 解酒护肝等多种药理作用[10, 11, 12]。有不少研究显示, DMY具有改善糖脂代谢和胰岛素抵抗作用, 减缓肥胖和高血脂小鼠的体重增长, 降低肝脂肪沉积和血清中的甘油三酯水平, 显著抑制皮下脂肪和内脏组织细胞生长。在分子机制方面, 它激活AMPK-PGC1α -Sirt1信号通路促进高脂饮食诱导的肥胖小鼠肩胛下脂肪组织棕色化和脂质沉积[13, 14]。在胆汁酸(BA)代谢和肠道菌群方面, DMY可以增强与胆汁酸(BA)结合, BA在肝脏中的转运, 抑制法尼醇X受体(FXR)相关信号通路介导的回肠中BA的重吸收, 减少与胆盐水解酶相关菌群的丰度, 进而改善肥胖[15]。
虽然已有一些报道表明, DMY在体内和体外实验上具有预防和改善肥胖及其相关疾病的可能性, 但从分子水平上研究DMY是否通过抑制PL的活性从而达到降脂作用、 何种抑制机制以及DMY对PL的抑制活性是否具有结构特殊性仍未见报道。本实验拟采用多光谱法结合分子对接技术研究了DMY在分子层面上与PL相互作用, 为其抗肥胖和降脂作用提供理论证据, 同时对进一步筛选和修饰天然的黄酮类PL抑制剂及开发预防和治疗肥胖或肥胖相关并发症的膳食补充剂奠定基础。
紫外-分光光度计(日本日立 U-1900 UV/VIS)、 高速离心机(德国艾本德Eppendorf Centrifuge 5804 R)、 多功能酶标仪(赛默飞世尔科技公司)。
PL(Ⅱ 型, 来自猪胰腺, 30~90 units· mg-1, EC: 3.1.1.3), 购自美国Sigma公司; DMY、 三羟甲基氨基甲烷(Tris)、 NaCl、 CaCl2、 盐酸、 月桂酸4-硝基苯脂(p-NPL)、 二甲亚砜(DMSO)、 Orlistat, 购自阿拉丁试剂公司(上海), 实验试剂均为分析纯, 采用离子水。
配制0.05 mol· L-1的Tris-HCl缓冲液(HCl调节pH 8.0); 称取适量PL溶解于Tris-HCl缓冲液, 4 ℃, 8 000 rpm, 离心8 min, 取上清液2× 10-5 mol· L-1的PL储备液; 用DMSO溶解适量月桂酸4-硝基苯酯(p-NPL), 得到8× 10-4 mol· L-1的p-NPL溶液。
1.3.1 DMY对PL的抑制作用
分别配制不同质量浓度(0、 0.3、 0.8、 1.6、 3、 5、 6)× 10-4 mol· L-1的DMY溶液和不同质量浓度(0、 0.8、 1.2、 1.6、 2、 3、 4)× 10-6 mol· L-1的Orlistat溶液(阳性对照)。96孔板中分别添加20 μ L DMY溶液、 60 μ L PL溶液及适量Tris-HCI缓冲液至120 μ L。37 ℃孵育10 min, 每孔加入80 μ L的p-NPL溶液启动反应, 避光反应60 min, 405 nm处测定吸光度。实验中以不加PL为实验空白组; 不加DMY为对照组; 不加PL和DMY为对照空白组。
1.3.2 抑制作用类型
PL浓度对抑制作用的影响: 固定p-NPL浓度8× 10-4 mol· L-1, 固定DMY溶液浓度0.3 mol· L-1, 依次施加质量浓度(0、 1、 2、 3、 4)× 10-4 mol· L-1的PL溶液, 测定不同浓度下的反应初速度。以PL浓度对反应速率作图, 根据曲线关系判断抑制类型是否可逆。
p-NPL浓度对抑制作用的影响: 固定PL溶液浓度为4× 10-4 mol· L-1, 固定DMY浓度为0.3 mol· L-1, 加入不同质量浓度(0、 0.08、 0.16、 0.4、 0.5)× 10-4 mol· L-1的p-NPL溶液, 分别测定酶催化剂的初始速度。根据Lineweaver-Burk双倒数方程, 以p-NPL浓度的倒数(1/[Q])为X轴和初始速度的倒数(1/V)为Y轴绘制曲线, 由Vmax和Km的变化判断抑制类型。
1.3.3 不同温度下荧光光谱、 同步荧光光谱及三维荧光光谱测定
移取适量DMY溶液和PL溶液混合均匀, 得到PL的浓度为1× 10-6 mol· L-1, DMY浓度从低到高依次为(0、 0.5、 0.75、 2、 3.75、 5、 7.5)× 10-5 mol· L-1, 分别在293和310 K的恒温震荡器中震荡20 min, 分别对不同温度下的溶液进行荧光发射光谱、 同步荧光光谱扫描。扫描参数: 激发波长290 nm, 狭缝宽为5 nm, 扫描速度为12 000 nm· min-1, 发射波长300~500 nm。同步荧光光谱扫描中, Δ λ =15 nm, 激发波长为255 nm, 发射波长为240~400 nm; Δ λ =60 nm, 激发波长为260 nm, 发射波长为200~400 nm, 扫描速度为12 000 nm· min-1, 温度为293 K。
1.3.4 紫外光谱测定
移取适量DMY溶液和PL溶液混合均匀, 得到PL的浓度为1.5× 10-6 mol· L-1, DMY浓度从低到高依次为(0、 0.5、 0.75、 2、 3.75、 5、 7.5)× 10-5 mol· L-1, 在293 K的恒温振荡器中振荡20 min, 用紫外分光光度计进行扫描, 扫描波长190~400 nm。
1.3.5 结合距离的测定
移取适量DMY溶液和PL溶液混合均匀, 得到PL浓度为5× 10-7 mol· L-1; DMY浓度为5× 10-7 mol· L-1以及DMY-PL浓度均为5× 10-7 mol· L-1的溶液, 293 K下。对DMY溶液进行紫外光谱测定, 对PL溶液和DMY-PL混合液进行荧光光谱分析, 参数设置同前。
1.3.6 分子对接模拟
PL的三维结构(PDB ID: 1GPL)来自于RCSB PDB数据库, DMY的三维结构(Pub CID: 161557)来自于PubChem数据库, 对接前对受体PL进行去水、 加氢等前处理并优化, 采用软件Discovery Studio 3.5中的CDOCKER程序对结合位点和关键残基进行选择, 选择结合能最低的构象作为对接结果分析, 采用Pymol 2.3.0软件处理最优构象。
所有试验均平行3次, 结果以平均值± 标准差表示, 用线性回归方程计算抑制动力学常数, 软件Origin 2018作图。
在酶抑制剂研究中, 常采用半数抑制浓度(IC50)评价抑制剂对酶的抑制效果, 数值越小其抑制能力越强, 其抑制率计算公式如式(1)
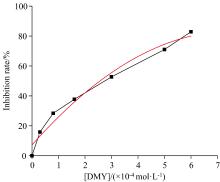
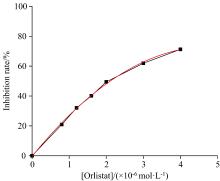
式(1)中: A为对照试验组, B为样品试验组, a为对照空白组, b为样品空白组。Orlistat与DMY对PL的抑制作用(图2和图3)显示, 在一定浓度范围内, 二者均对PL的活性呈剂量依赖性抑制, IC50分别为2.1× 10-6和2.6× 10-4 mol· L-1(表1)。DMY的抑制效果虽然没有化学合成药物Orlistat强, 而DMY作为无毒副作用的天然活性产物, 在开发酶抑制剂方面仍具有很大的潜力。研究表明, 黄酮类化合物中的白杨素[16]、 柚皮素[17]、 槲皮素[18]、 杨梅素[19]均以竞争性抑制PL活性, 其IC50分别为8.21× 10-4、 2.41× 10-3、 2.32× 10-2和1.18× 10-3 mol· L-1, 即抑制效果均弱于藤茶中的DMY, 分析认为可能是该分子B环结构(3'、 4'和5'位)上连接有更多数量的羟基, 以及C环中C2=C3位的双键饱和增强了分子结构温度, 更容易通过氢键和疏水作用与PL结合, 从而提高了PL的抑制能力。之前的研究发现, 黄酮类化合物在发挥生物活性时往往会表现出协同或拮抗作用, 有研究发现[16]DMY与杨梅素以2∶ 1的浓度组合比1∶ 1或1∶ 2的浓度组合表现出更强的抑制活性, 与DMY更强的抑制能力一致[13], 反映黄酮类结构对抑制活性的影响。
| 表1 DMY-PL体系的IC50和作用类型 Table 1 IC50 and interaction type from DMY in inhibiting PL |
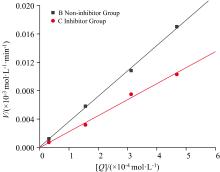
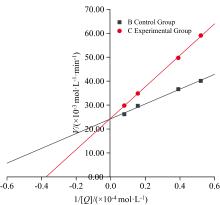
抑制剂对PL的抑制作用可分为可逆型抑制和非可逆型抑制, 当含抑制剂的曲线和不含抑制剂的曲线相交于原点, 并且加入抑制剂后斜率变小, 则为可逆型抑制; 非可逆型抑制则为平行直线, 不相交于原点[20]。由图4, 抑制剂组和无抑制剂组拟合曲线经过原点, 加入抑制剂后斜率变小, 表明DMY对PL的抑制类型为可逆型抑制, 可与PL以非共价键结合导致酶活力降低。
可逆型抑制可分为竞争性、 反竞争性和非竞争性抑制3种类型[21]。非竞争性抑制是抑制剂与酶活性中心之外的区域结合, 促使Vmax减小, Km不变; 竞争性抑制是抑制剂与底物争夺酶活性中心的结合位点, 阻碍与之结合降低酶的活性, 促使Km增大, Vmax不变。采用抑制动力学方程判断抑制作用类型, 其中方程与X轴截距=-
式(2)中: [Q]为DMY的质量浓度, mg· mL-1,
| 表2 DMY对PL的动力学参数 Table 2 Thedynamic parameter from DMY in inhibiting PL |
2.3.1 荧光猝灭机理及作用机制
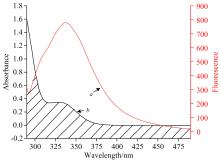
荧光光谱可以进一步探究DMY与PL之间的相互作用。PL因含有芳香族残基色氨酸(Trp)、 酪氨酸(Tyr)和苯丙氨酸 (Phe)残基, 分别在348、 303和283 nm附近激发光的激发下产生荧光峰, Phe的荧光强度很低, 因此自发荧光主要由Trp和Tyr产生, 其强度及位置会受到残基微环境的影响。图6(a, b)为不同浓度下DMY-PL相互作用的荧光光谱, PL在339 nm处有最大发射波长, 随着DMY质量浓度增大, PL的荧光强度逐渐降低, 荧光峰的位置从339 nm红移到355 nm(293 K), 即发生了荧光峰位移和荧光猝灭现象, 可能是DMY使PL中的Trp附近的微环境发生了改变。
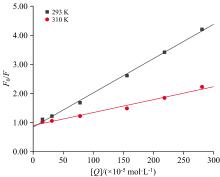
荧光猝灭可分为静态猝灭、 动态猝灭两种方式[22]。前者是荧光基团与猝灭剂形成了不发光的非荧光复合物, 后者是荧光基团通过碰撞与猝灭剂相互作用, 导致能量发生转移。当外界温度升高时, 分子碰撞加剧, 动态猝灭强度增大, 猝灭常数也随之增大。反之, 外界温度升高, 分子扩散运动增强引起复合物的稳定性下降, 静态猝灭程度减小, 猝灭常数减小。荧光猝灭遵循Stern-Volmer方程[23]。
式(3)中: F0和F分别为加入DMY前后PL的荧光强度; KSV为动态猝灭常数; [Q]为DMY的质量浓度; Kq为双分子碰撞过程猝灭常数; τ 0为无抑制剂时荧光分子的平均寿命, 取10-8 s。图7为不同温度下DMY-PL的Stern-Volmer曲线, 结果显示F0/F对[Q]呈线性负相关, KSV随着温度的升高而降低, 表明DMY对PL的荧光猝灭类型为静态猝灭。由表3, Kq=1.2× 1012 L· mol-1· s-1(293 K)和Kq=0.44× 1012 L· mol-1· s-1(310 K), 均远大于猝灭剂对荧光分子最大动态扩散猝灭常数阈值(2.0× 1010 L· mol-1· s-1)[24], 进一步证明DMY对PL的荧光猝灭方式是静态猝灭。
| 表3 曲线Stern-Volme和相关参数 Table 3 Linear equations Stern-Volmer and related parameters |
2.3.2 结合常数和结合位点
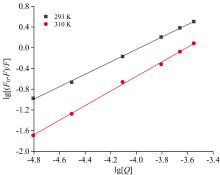
采用静态猝灭双对数公式[25], 由图8计算DMY与PL相互作用的结合常数(Ka)和结合位点数(n)。
式(4)中, F0, F, Q物理意义同式(2), 结合常数Ka和结合位点n结果见表4。由表4可知, DMY与PL的结合常数Ka分别为5.76× 104 L· mol-1(293 K)和11.93× 104 L· mol-1(310 K), 结合位点n分别为1.20(293 K)和1.41(310 K)。
| 表4 不同温度下DMY-PL的Ka和n Table 4 Ka and n values for DMY-PL at different temperatures |
结合位点约为1, Ka随温度的升高而升高, Kq值均大于2.0× 1010 L· mol-1· s-1, 表明DMY与PL可能存在一个较强的结合位点, 且随温度升高形成的基态复合物越稳定, 从而发生静态猝灭。
2.3.3 热力学参数和作用力
根据Van’ t Hoff定律[26], 由热力学参数可判断DMY与PL之间的相互作用力类型。
式(5)—式(7)中, R=8.314 J· mol-1· K-1; Ka1为293 K下的Ka; Ka2为310 K下的Ka; T1为293 K; T2为310 K; Δ H为焓变; Δ G为吉布斯自由能; Δ S为熵变。DMY-PL的热力学参数见表5, 根据Ross理论[27], 在293和310 K下, 热力学参数Δ G< 0, Δ S> 0、 Δ H> 0(见表5), 表明两者由于疏水作用力自发结合成更稳定的配合物, 导致过程中熵增大, 可能是由于DMY上的酚羟基与PL活性位点上的疏水氨基酸残基形成非共价键所致。
| 表5 不同温度下DMY-PL的热力学参数 Table 5 The modynamic parameters of DMY-PL at different temperatures |
根据Fö rster非辐射能量转移理论, 当一个荧光基团(供体)与另一个猝灭基团(受体)距离r< 7 nm时, 能量表现为受体的吸收光谱与供体的发射光谱重叠, 则受体与供体之间存在非辐射能量转移[28]。
式(8)—式(10)中, E为转移效率, F和F0为加入DMY和不加入时PL的荧光强度; r为结合距离、 R0为临界能量转移距离、 J为供体和受体的光谱面积重叠积分;
同步荧光色谱可以单独确定DMY对PL特定氨基酸残基微环境的变化。当波长差Δ λ =15 nm和Δ λ =60 nm时, 分别表示Tyr和Trp残基的光谱特征, 同时最大发射波长的位置及强度受其微环境的极性影响。图10(a, b)结果显示, 随着DMY浓度的增加, Tyr残基最大发射波长蓝移1 nm, 荧光强度下降了81.06%; Trp残基最大发射波长红移2 nm, 荧光强度下降了78.77%, 即PL中Tyr和Trp附近的环境发生了变化, 导致PL的构象发生改变。
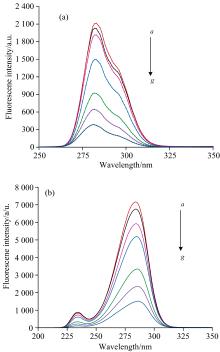
紫外光谱法是一种简单而有效的检测抑制剂与酶是否形成复合物的方法, 可用于研究DMY对PL二级结构的影响。PL因含有芳香族氨基酸Trp和Tyr, 在280 nm处存在最大吸收峰。图11中, 随着DMY的加入, PL的最大吸收峰值逐渐增强(a→ e), 最大吸收波长从206 nm红移到210 nm, 表明加入DMY后与PL存在着相互作用, 改变了PL的二级结构, 可能因DMY的π * 空轨道与PL碱基对的π 轨道耦合, 导致发生π → π * 跃迁使能量降低。
三维荧光光谱可多维度的描述化合物的分子结构, 以及吸收光谱、 发射光谱的信息变化, 可用于进一步证实PL的二级结构及发光基团微环境是否发生变化。peaka为瑞利散射峰(λ ex=λ em, F), peak1和peak2为荧光特征峰(2λ ex=λ em, F), 分别是多肽骨架结构荧光特征峰及Tyr、 Trp残基的荧光特征峰。图12为DMY-PL相互作用前(a)后(b)的三维立体荧光光谱。加入DMY后, peak1由(230.0 nm/340.0 nm, 2 715)变化为(230.0 nm/350.0 nm, 1 320), peak2由(285 nm/350.0 nm, 5 905)变化为(280 nm/355 nm, 3 429)。即加入DMY后, peak1和peak2的最大发射波长分别红移10和5 nm, 荧光强度分别下降51.38%和41.93%, 表明PL微环境极性增大, 疏水性减弱, 亲水性增强, 导致构象发生改变, 与同步荧光光谱结果一致。随着DMY加入peaka的荧光强度增加, 可能是DMY与PL形成配位复合物, 使PL分子之间结合的更加紧密, 分子粒径增大, 散射效应增强。
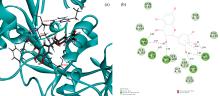
分子对接是一种可以获得酶与抑制剂相互作用的结合位点和作用力类型的理论模拟技术, 可用于直观描述DMY-PL的抑制机理。根据对接后的最低结合自由能够确定最佳结合方式, 结合自由能越小, 酶与抑制剂结合越紧密。
图13为DMY-PL作用的3D(a)和2D(b)分子对接结构图。DMY分子镶嵌于PL的活性中心口袋的催化腔中, 并与PL周围的氨基酸残基THR78、 GLU179、 LEU213、 ALA178形成范德华力; 残基HIS263与A环C5—OH形成氢键, 残基TYR114与B环C4'—OH形成分子内氢键, 残基PHE215与C环C3—OH形成氢键、 残基SER152与C环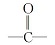 形成氢键, 键长分别4.81、 3.42、 4.63和4.57 nm; 氨基酸残基PHE77、 PHE215、 ILE209、 PRO180、 TYR114形成疏水作用力。DMY与PL通过疏水作用力、 氢键和范德华力形成稳定的复合物, 使PL的氨基酸微环境和构象发生改变, 与热力学判断结果一致。
形成氢键, 键长分别4.81、 3.42、 4.63和4.57 nm; 氨基酸残基PHE77、 PHE215、 ILE209、 PRO180、 TYR114形成疏水作用力。DMY与PL通过疏水作用力、 氢键和范德华力形成稳定的复合物, 使PL的氨基酸微环境和构象发生改变, 与热力学判断结果一致。
相关研究发现, PL的催化活性中心是由氨基酸SER152、 ASP176、 HIS263组成的三联体结构[29]。能与三聚体结合的化合物对PL的抑制活性有重要作用, 其中Ser152是脂肪分解活性最重要的残基, 任何对SER152的化学修饰都会破坏其活性。DMY对黄酮类化合物中的白杨素、 槲皮素、 杨梅素具有更强的抑制能力, 可能是DMY与PL的活性催化位点SER152、 HIS263结合形成, 导致底物p-NPL及其他物质无法与PL结合, 从而引起酶活力降低, 符合竞争性抑制作用特点, 与抑制动力学结果一致。已有研究表明黄酮类化合物对胰脂肪酶的抑制活性涉及不同的相互作用类型, 如π -堆积、 疏水作用、 与水分子或与特殊氨基酸残基(催化活性中心氨基酸)的结合形成氢键、 氢键的数目、 键长都是影响脂肪酶活性的重要因素。DMY的环状结构含有一个羟基和5个酚羟基, 容易与PL中Phe、 Tyr、 Ile、 Ser等疏水性氨基酸生成氢键和疏水作用力, 使结合的复合物更加稳定, 从而降低了酶活性。分子对接最佳结合模式结果显示, DMY-PL的最低结合自由能Δ G为-32.310 1 kJ· mol-1, 与310 K下Δ G为-30.127 kJ· mol-1荧光结果相近。
研究表明DMY对PL具有较好的抑制作用, 抑制类型为竞争性抑制, 猝灭机理为静态猝灭, DMY与PL以1∶ 1结合形成稳定的复合物, 根据热力学参数Δ G< 0, Δ S< 0、 Δ H< 0, 表明维持复合物构象的稳定主要是疏水作用力, 且为自发进行。计算结果中结合距离r=1.475 nm, 表明DMY与PL存在非辐射能量转移, 同步荧光光谱、 紫外-可见吸收光谱及三维荧光光谱分析表明, DMY使PL的氨基酸残基微环境及二级结构发生了改变, 进而导致酶构象发生了变化。分子对接结果显示, 疏水作用力、 氢键和范德华力共同保持DMY-PL复合物的稳定, 与PL催化活性中心氨基酸残基SER152, HIS263结合, 阻止其他物质进入催化活性中心, 从而降低酶活性。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|