作者简介: 张 妍, 1989年生,浙江科技大学浙江省废弃生物质循环利用与生态处理技术重点实验室讲师,天津科技大学轻工技术与工程专业博士后 e-mail: 15122753563@163.com
开发农林废弃物高值化利用路径与“深入推进能源绿色低碳转型”国家重大战略需求高度契合。 实验探索农业废弃物玉米秸秆中纤维素组分常压酸(H3PO4)催化多元醇[丙二醇(PG)与二甘醇(DEG)混合液]液化反应路径为研究目标, 了解酸催化多元醇作用条件下的木质生物质液化反应机理。 采用傅里叶红外光谱(FTIR)、 凝胶渗透色谱(GPC)、 核磁共振波谱(NMR)及热重分析(TGA)对不同反应时间下纤维素液化所得生物油的化学基团、 分子量及其分布、 分子结构、 热解等进行了分析。 FTIR检测表明, 不同反应时间所得生物油具有相似FTIR特征; 液化初期, 纤维素降解生成了较多的烃类、 醚类和含羰基化合物; 液化后期, 纤维素中的糖类降解产物、 羟基或烯烃与PG/DEG反应生成了难溶于1,4-二氧六环的有机物。 GPC分析表明, 随着液化的进行, 纤维素分子链发生断裂程度加剧, 降解生成低分子量(LMW)物质越来越多, 降解反应占主导地位; 而当反应时间达到某一值时, 其降解产物与PG/DEG发生聚合反应产生越来越多的大分子量物质, 使生物油的分子量不再降低, 即聚合反应占主导地位。1H- 和13C-NMR表明, 纤维素在液化作用下发生降解使得分子链断裂, 仍保留了部分葡萄糖单元结构; 随着液化反应的进行, 这些结构单元再次发生转化产生LMW化合物; 反应继续进行时, 这些产物之间或与PG/DEG之间可进行聚合反应, 形成结构趋于一致、 性质逐渐稳定的新物质。 TGA分析结果: 生物油中含有70%~85%碳数小于25和5%~10%碳数高于25的化合物, 最终残炭率随着反应时间的延长先降低再升高。 实验通过研究纤维素在多元醇液化过程中的结构变化, 揭示其液化的反应历程, 为探索秸秆全组分的液化机理奠定理论基础。
The development of high-value utilization paths for agricultural and forestry waste was highly consistent with the major strategic demand to “further promote green and low-carbon energy transformation”. In this paper, the objective was to investigate the pathway of propanediol (PG) and diethylene glycol (DEG) liquefaction catalyzed by phosphoric acid of cellulose from corn stalk at atmosphere pressure, aiming at understanding the mechanism of lignocellulosic biomass liquefaction reaction under the action of acid-catalyzed polyhydroxy alcohols. The chemical groups, molecular weight and distribution, molecular structure, and pyrolyzation of cellulosebiofuels were analyzed by Fourier transform infrared spectroscopy (FTIR), nuclear magnetic resonance spectra (NMR), gelpermeation chromatography (GPC), and thermo gravimetric analysis (TGA). FTIR showed that the biofuels had similar FTIR characteristics. At the early liquefaction stage, cellulose degradation produced more hydrocarbons, ethers, and carbonyl compounds. At the later stage of liquefaction, the carbohydrate degradation products, hydroxyl or olefin in cellulose, reacted with PG/DEG to generate organic matter insoluble in 1, 4-dioxane. GPC explained that with the progress of the reaction, the breakage degree of the cellulose molecular chain would be aggravated, and more and more low molecular weight (LMW) substances were generated by degradation. However, when the reaction time reached a certain value, the degradation products reacted with PG/DEG to produce larger molecular weight substances, resulting in the molecular weight of biofuel no longer being reduced. Results from1H- and13C-NMR presented that cellulose was degraded under liquefaction, and the molecular chain was broken, but part of the glucose structure was still preserved. With the reaction, these structural units were transformed again to produce LMW compounds. When the reaction continues, polymerization reactions could occur between these products or with PG/DEG, forming new substances with consistent structures and gradually stable properties. The results of TGA showed that the biofuel contained 70%~85% compounds with carbon number less than 25 and 5%~10% compounds with carbon number more than 25. In conclusion, this paper revealed the liquefaction reaction process of cellulose by studying the structural changes in the liquefaction process of polyhydric alcohols, which laid a theoretical foundation for exploring the liquefaction mechanism of corn stalk whole components.
随着化石能源的日益短缺, 可再生木质生物质资源的利用越发受到重视[1]。 常压液化技术是高效利用生物质的主要方法[2], 最大限度将其转化为液态有机物加以利用[3]。 确定不同液化条件下生物质主要成分的反应路线、 活性基团产生途径和生成物的结构与分布至关重要, 是控制液化路径必备的理论依据。
目前对常压液化技术的研究取得一定的成果[4]。 纤维素是生物质主要化学成分之一, 其反应速度对生物质整体液化效率起决定性作用[5]。 Yamada等研究了纤维素在酸催化乙二醇(ethylene glycol, EG)液化实验, 结果发现纤维素在液化早期阶段降解产生大量EG-葡糖苷, 延长反应时间, 这些糖苷发生分解, 生成乙酰丙酸[6]。 其选用聚乙二醇(polyethylene glycol, PEG)和碳酸乙烯酯(ethylene carbonate, EC)分别作为液化剂, 在常压硫酸催化液化温度为140或150 ℃下考察了纤维素的液化降解。 结果表明当使用PEG或EC时, 其分解反应有相同的机理: 首先纤维素发生液化降解形成大量的葡萄糖苷; 然后这些糖苷发生分解产生乙酰丙酸盐和不溶于水的部分; 葡萄糖苷和乙酰丙酸的转化率很大程度上取决于液化剂分解的反应条件。
相对于常压液化技术及应用研究的现状, 有关其反应机理探索的现状还不够全面和深入, 为目前相关液化技术提供的理论支撑和技术支持的力度有限, 有待于进一步努力。 本工作对从玉米秸秆中分离的纤维素在不同液化反应过程中进行酸催化多元醇液化实验, 采用FTIR、 GPC、 NMR、 TGA等测试手段对液化后所得生物油进行检测分析, 考察在液化过程中纤维素的结构变化, 以此推测纤维素多元醇液化的反应路径。
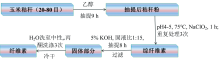
原料: 由20~80目玉米秸秆中分离纤维素, 其分离过程如图1所示[7]。 分离纤维素中含有82.50%纤维素、 12.17%半纤维素及0.64%木质素。
主要试剂: 浓磷酸、 丙二醇(propylene glycol, PG)、 二甘醇(diethylene glycol, DEG)、 无水乙醇、 1, 4-二氧六环、 亚氯酸钠、 氢氧化钾、 丙酮为分析纯, 溴化钾为色谱纯, 试剂均购自天津市江天化工技术有限公司。 四氢呋喃、 聚苯乙烯(色谱纯)购自国药集团化学试剂有限公司。 氘代丙酮(色谱纯)购自美国剑桥同位素实验室。
主要仪器: PARR-4848型高压反应釜(帕尔仪器公司, 美国); Waters 1515型凝胶渗透色谱仪(安捷伦科技公司, 美国); Q50型热重分析仪(岛津公司, 日本); 650型傅里叶变换红外光谱仪、 AV Ⅲ 400M型核磁共振波谱仪(布鲁克公司, 德国)。
1.2.1 纤维素的液化
将m0(g)纤维素加入反应釜, 再加入催化剂H3PO4(用量10%)和液化剂(DEG∶ PG=1∶ 2), 液固比为5∶ 1, 混合均匀后进行液化实验。 当系统温度增至170 ℃开始计时, 达到预设反应时间后, 冷却至室温。
1.2.2 液化得率的测定[8]
用80%的1, 4-二氧六环混合液洗涤溶解液化产物并转移, 经搅拌、 离心后, 上层溶液40 ℃旋蒸回收溶剂, 获生物油。 下层固体残渣经回收溶剂、 去离子水反复洗涤至洗涤液无色, 105 ℃恒重m1(g)。 式(1)计算液化得率Y(%)。
1.2.3 生物油的表征
1.2.3.1 傅里叶变换红外光谱表征
对纤维素及其生物油的化学基团进行分析, 采用KBr压片法[9], 在分辨率为4 cm-1、 扫范围为4 000~400 cm-1下共扫描16次, 样品与KBr的质量比为1∶ 100。
1.2.3.2 凝胶渗透色谱表征
生物油的重均分子量(Mw)、 数均分子量(Mn)采用在凝胶色谱仪检测, -G.2000HHR色谱柱和-G.1000凝胶柱, 检测器是折射指数检测器, 标定物聚苯乙烯, 测定时间25 min, 流速1.0 mL· min-1, 取10 mg样品溶于10 mL四氢呋喃, 进样量50.00 μ L, 柱温为40 ℃。
1.2.3.3 1H核磁共振表征
取约10 mg生物油溶于0.5 mL氘代丙酮中, 频率扫描8次。 得到的谱图采用MestReNova软件进行分析。
1.2.3.4 13C核磁共振表征
取约100 mg生物油溶于0.5 mL氘代丙酮中, 采样条件为: 30° 脉冲, 采样时间1.4 s, 弛豫时间2 s, 扫描时间为12 h, 频率扫描约2万次[10]。
1.2.3.5 热重分析表征
约5 mg生物油, 高纯氮气为载气, 以升温速率10 ℃· min-1使温度从30 ℃升到600 ℃[11], 获得热失重曲线(TG)和失重速率曲线(DTG)。
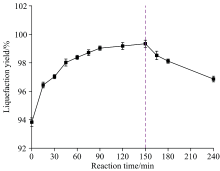
图2为反应时间对纤维素液化得率的影响。 随着反应时间的延长, 液化得率呈先升高后降低的趋势。 当反应时间从0 min增加到150 min时, 纤维素的液化得率从93.83%上升至99.34%, 随着反应时间的增加, 使得纤维素、 H3PO4和多元醇PG/DEG接触更充分、 混合更均匀, 导致液化反应速率增大, 促进了纤维素液化反应进程; 即PG/DEG自由基可以与纤维素降解生成的中间产物发生缩合, 促进纤维素降解液化生成小分子物质。 继续延长反应时间至240 min, 液化反应速率变慢, 液化得率也随之减小到96.86%, 分析认为延长反应时间使液化产物之间发生聚合反应, 即PG/DEG自由基可以与生成的液化产物间发生缩合、 环化、 聚合等反应, 转化成固体残渣导致残渣率的上升。 因此可将150 min之前液化称为液化得率上升阶段; 150 min之后, 属液化得率下降阶段。
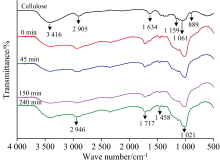
图3是纤维素及其在反应时间为0、 45、 150和240 min所得生物油的傅里叶变换红外光谱(FTIR)。 与纤维素FTIR对比, 其生物油在889 cm-1出现较为明显的源于β -糖苷键C1— H弯曲振动峰, 此峰强度随反应时间的延长逐渐减弱甚至消失, 分析认为糖类参加反应产生了难溶于1, 4-二氧六环的有机物[12]; 生物油在3 416 cm-1对应O— H伸缩振动峰, 此峰强度随反应时间的延长明显减弱, 分析认为纤维素中的羟基或烯烃与多元醇反应生成了小分子化合物; 生物油在2 946 cm-1出现甲基、 亚甲基C— H伸缩振动峰, 与纤维素在2 905 cm-1的峰相比, 峰强度减弱并略沿着高频方向转移, 表明纤维素降解生成的小分子物质与PG/DEG发生反应产生新物质, 导致纤维素含有的C— H数量降低; 纤维素分子链上部分氢键在液化体系中遭到破坏, 从而使其吸收峰沿着高频方向转移。 生物油在1 458 cm-1出现CH2对称弯曲振动峰的强度随反应时间的延长明显增强, 由于纤维素在液化过程中降解生成了较多的烃类, 使得CH2数量增多; 纤维素在1 634 cm-1的峰由共轭C=O伸缩振动引起, 生物油在此峰的强度减弱, 并在1 717 cm-1出现较强的源于糖类非共轭C=O双键伸缩振动峰[13], 说明生物油中含有很多不饱和含氧化合物[14], 这是碳水化合物在液化反应过程中降解产生了大量的羰基和羧基类以及共轭双键中其中一处双键断裂导致的。 生物油不存在1 159 cm-1源于与β -(1-4)-糖苷键联接的C— O— C伸缩振动峰和1 061 cm-1源于C(3)位上的C— O弯曲振动峰, 但其转移至1 021 cm-1出现源于C— O— C伸缩振动强峰, 表明纤维素在液化过程中发生剧烈降解使糖苷键连接的C— O— C和C— O脱落, 形成大量的醚类。 生物油在不同反应时间下有相似的FTIR特征, 说明生物油含有相似的官能团。
表1为纤维素在不同反应时间(0、 45、 150和240 min)所得生物油的Mw、 Mn和多分散性(Mw/Mn)。 在液化得率上升阶段, 随着反应时间的延长, 生物油分子量Mw/Mn从1.71减小到1.28, Mw从325降至200, Mn从190降至155; 表明纤维素在液化过程中生成液体产物的分子量分布趋于均一化, 即生物油分子量分布越来越窄, 分散程度越来越低, 分子量越来越小; 分析认为液化初期, 纤维素分子间、 分子内的氢键会发生断裂、 脱水, 生成含有羰基的活性纤维素, 使聚合度下降; 随着反应的进行, 这些活性纤维素降解生成的低分子量(low molecular weight, LMW)物质越来越多, 降解程度越来越大, 此阶段以降解作用为主。 150 min时, Mn和Mw最小, 表明纤维素明显降解生成小分子, 此时降解程度最大。
| 表1 不同反应时间下生物油的Mw、 Mn和Mw/Mn Table 1 Average molecular weight and polydispersity of biofuels at different reaction time |
液化得率下降阶段时, Mw/Mn保持1.28, Mw从200增至239, Mn从155增至186; 分析认为降解产物在酸中与PG/DEG进一步发生聚合, 形成分子量较大的化合物, 致使生物油分子量上升, 分散度不再降低, 即聚合反应愈来愈强。
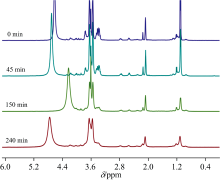
图4为反应时间为0、 45、 150和240 min纤维素液化所得生物油的1H-NMR。 在化学位移δ 2.07 ppm峰是溶剂氘代丙酮体现。 在δ 3.37 ppm处, 反应时间为0、 45和150 min所得生物油均存在β -D-葡萄糖峰, 其峰面积为2.14、 1.79和1.09个质子, 而在240 min所得生物油中未出现此峰, 表明在液化得率上升阶段, 纤维素发生降解使分子链断裂, 但仍保留部分葡萄糖单元, 随反应时间的延长, 这些单元降解程度逐渐增大; 到液化得率下降阶段, 这葡萄糖单元再次发生转化。 四组生物油在1.50~0.85 ppm均存在烃类质子峰, 其峰面积为4.29、 3.76、 2.43和2.23个质子, 即随着反应时间的延长, 此区域内的峰强度逐渐减弱; 表明纤维素在液化过程中发生降解生成大量CH2等烃类; 随着反应的进行, 这些烃类可与PG/DEG或是互相结合发生聚合生成大分子物质。 四组生物油在4.80~4.00 ppm均存在α 、 β 、 γ 碳上氢的峰, 其峰面积为8.90、 9.97、 12.29和10.91个质子, 表明在整个液化反应都伴随着纤维素降解反应, 其生成具有此结构的化合物或生成的LMW化合物与PG/DEG反应形成此结构的物质; 但随着反应的进行, 产生的LMW化合物发生再聚合, 形成结构趋于一致、 性质逐渐稳定的新物质。
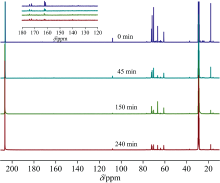
图5表示反应时间为0、 45、 150和240 min液化所得生物油的13C-NMR。 在δ 29.26和206.63 ppm的峰属于溶剂氘代丙酮。 四组生物油在160~120 ppm没有发现明显的峰, 表明生物油中几乎不含芳香C。 在180~160和40~10 ppm存在多种峰, 分别代表羧基和烷烃上的C[15], 说明纤维素液化过程中产生了酸和LMW烷烃。 80~60 ppm出现纤维素及其葡萄糖C引起的峰; 表明纤维素在液化初期发生降解形成糖环依然存在的低聚糖; 随反应的进行, 低聚糖再次转化(如开环反应)生成了5-羟甲基糠醛、 乙酰丙酸等, 与生物油的1H-NMR结果一致。
液化得率下降阶段, 随反应时间的延长, 180~160、 80~60和40~10 ppm区域内的峰强度逐渐减弱, 可能是由于纤维素降解产生的LMW产物部分参加聚合反应生成残余物。
图6表示反应时间为0、 45、 150和240 min纤维素液化所得生物油的TG曲线(a)和DTG曲线(b)。 生物油热解过程分四个阶段[10]: 第一阶段(30~150 ℃)主要是水、 轻石脑油和炼油气等碳数小于10化合物的挥发, 此阶段四组生物油的失重率依次约为20%、 23%、 33%及20%; 第二阶段(150~350 ℃)主要是重质油、 煤油、 柴油等碳数为10~25化合物的热解[16], 此阶段其失重率依次约为55%、 60%、 44%和54%; 第三阶段(350~450 ℃)是润滑油和重燃料油等碳数为25~35化合物的热解, 此阶段其失重率依次约为3%、 2%、 3%和3%; 第四阶段(450~600 ℃)是蜡、 胶质及沥青等碳数大于35物质的热解[16], 此阶段其失重率依次约为2%、 3%、 3%和5%。 四组生物油在350~600 ℃的失重率所占比例较少, 约为5%、 5%、 6%和8%, 表明随反应的进行, 纤维素液化所得生物油中含有碳数高于25的化合物的比例逐渐增大。 四组生物油的残炭率依次约为19.5%、 11.5%、 17.3%和18.4%, 可能是液化初期, 纤维素液化不完全, 含有未液化的部分, 使得0 min生物油的残炭率最高; 随液化反应的进行(45 min), 纤维素大部分降解成LMW化合物, 此时残炭率最低; 到了液化得率下降阶段时, 随着反应时间的延长, 纤维素降解形成的LMW化合物与PG/DEG发生了聚合反应, 使得残炭率增加。
丙二醇(PG)是一种供氢溶剂, 纤维素大分子在高温和PG/DEG作用下发生了自由基反应, 经过脱水、 C— O— C断裂生成了葡聚糖, 葡聚糖在液化体系中经一系列的反应如开环、 脱水、 异构化和羟醛缩合等, 生成的产物中存在C=C、 C=O、 — CHO键。 随反应进行, 体系中自由基如CH3· 、 H· 和HO· 等促使葡聚糖中存在的C— O、 C— C和— OH等化学键发生断裂, 形成多种醇、 酸、 直链酮类以及自由基等; 这些自由基之间或其与产生的醇、 酸、 酮之间可再次作用生成环酮类或含有— OH和— CH3等直链酮类; 这些环酮物质可通过开环、 与自由基缩合、 环化等反应, 生成了芳香族酮类; 这些芳香族酮类进一步经过裂解、 脱羰、 异构化等反应生成醇类、 酸类等物质。 在H· 影响下, 酮类可以通过脱羰、 氧化等化学反应生成酸类, 这些物质和醇类发生酯化反应形成酯类。 以上是生物油中存在的醇、 酸、 酮以及酯类有机化合物的反应路径, 为木质生物质液化产物制备化学品提供了理论基础, 促进了生物质资源的高值化利用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|