作者简介: 翁文婷,女, 1979年生,泉州师范学院化工与材料学院教授 e-mail: wendywwt@163.com
以海藻酸钠(SA)为碳源, 引入邻苯二胺(oPDA)为助剂, 采用一步水热合成法制备新型的氮掺杂碳化聚合物点SA-oPDA CPDs。 该CPDs溶液在352 nm波长激发下, 于462 nm处有蓝绿色荧光发射信号, stokes shift可达到110 nm, 并显示出良好的光稳定性和激发波长不依赖性, 荧光量子产率为16.9%。 碳化聚合物点保留有海藻酸钠聚合链的特征, 通过静电吸附组装技术, 与壳聚糖形成复合发光薄膜, 具有发光器件可应用潜力。 该碳点水溶液对pH值极具敏感性, 随着溶液环境由酸性变化到碱性, 荧光强度增加的同时伴随着荧光发射峰位置从465 nm蓝移突变至425 nm, 相应碳点的表面荷电状态由正电荷变化为负电荷。 结构和形貌表征, 在高温碳化过程中, 该碳点内部形成碳化发光中心, 外层表面共存来源于邻苯二胺和海藻酸钠的胺基和羧基。 在溶液环境中, 碳点的带电状态随溶液pH值的变化而变化, 出现类似两性电解质的荷电性质, 并在pH 6~7存在等电点。 这可能是由于碳点表面羧基的解离和胺基的质子化的共同作用, 并导致溶液表现出发光可调性。 CPDs在pH 6.80的溶液环境下与铅离子结合后, 溶液发射的荧光从蓝色变化为蓝绿色, 可实现对一定浓度铅离子的明显可视化响应。 研究表明还原性的药物对该碳点荧光信号有明显的猝灭效应。 槲皮素对碳点的荧光猝灭程度在7.9×10-6~7.7×10-5 mol·L-1浓度范围内, 可呈现方程为 I0 /I=0.878 8+1.689 7×10-6 cQue的线性响应, 相关系数 r2=0.974 8, 检出限LOD=1.7×10-6 mol·L-1。
Novelty luminous carbonized polymer dots (CPDs) were synthesized by rapid and facile hydrothermal carbonization of sodium alginate (SA) and o-phenylenediamine (PDA). The SA-oPDA CPDs reveal a large Stokes shift up to 110 nm under the excitation wavelength at 352 nm and emission wavelength at 462 nm. The synthetic CPDs exhibited bright blue fluorescence with a fluorescence quantum yield of 16.9% and excellent photostability and excitation wavelength independence. Just for the characteristics of the alginate polymerization chain, the SA-oPDA CPDs also demonstrated the practical feasibility of establishing the fluorescent films by self-assembled chitosan polyelectrolyte molecular with electrostatic adsorption. Thus, it has great potential application in light-emitting devices. Meanwhile, the SA-oPDA CPDs were found to have extraordinary amphoteric charge adjustability by pH value. With the change of solution environment from acidic to alkaline, the position of the fluorescence emission peak changed from 465 to 425 nm, and the surface charge of the carbon point changed from positive charge to negative charge. The structure and morphology characterization showed that during the high-temperature carbonization process, the polymer is carbonized to form a luminescent carbon core and contains hydroxyl, amine, and carboxyl on the surface of CPDs. Due to the active protonation/deprotonation of amino or carboxyl groups, the CPD solution exhibits luminescence tunability with pH alterations. The SA-oPDA CPDs exhibited an amphoteric nature with the isoelectric point between pH of 6 and 7, respectively. After the CPDs were combined with lead ions in the solution environment at pH 6.80, the fluorescence emitted by the solution changed from blue to blue-green, which could realize an obvious visual response to a certain concentration of lead ions. The experimental results also showed that the reduced drug, especially quercetin(Que), had a significant quenching effect on the fluorescence signal of CPDs. The degree of fluorescence quenching had a good linear relationship with the concentration of quercetin in the range of 7.9×10-6~7.7×10-5 mol·L-1. The equation was I0 /I=0.878 8+1.689 7×10-6 cQue, correlation coefficient r2=0.974 8, and the LOD of detection was 1.7×10-6 mol·L-1.
荧光碳点作为一种新型的碳纳米材料, 2004年在分离和纯化单壁碳纳米管时被意外发现, 受到越来越多研究者的关注[1]。 根据碳核及其表面状态的差异, 碳点可分为石墨烯量子点(graphene quantum dots, GQDs)、 碳纳米点(carbon nanodots, CNDs)和碳化聚合物点(carbonized polymer dots, CPDs)[2, 3]。 CPDs的概念和形成机理是最近几年由Yang等提出[4, 5, 6]。 作为一类特殊的碳点, 碳化聚合物点不仅继承了传统碳点优异的化学稳定性和高发光性能, 而且形成的高分子链外层结构, 使其具有良好的生物相容性和成膜性[7, 8, 9, 10]。
碳化聚合物点的优异特性主要得益于高分子聚合物碳源分子的分子结构, 天然高聚物中的多糖类聚合物常用做碳源合成有特殊性能的CPDs[11, 12, 13, 14]。 其中, 海藻酸盐因为表面富含— COOH、 — OH等官能团, 常用来研制纳米复合膜[15, 16, 17, 18]。 但是直接以海藻酸盐作为聚合物碳源, 制备的聚合物碳点发光性能较弱, 可以通过添加辅助性化学物来获得特殊发光性能。
近年来的研究中, 通常将带有辅助基团的有机小分子作为助剂引入碳源中, 使CPDs具有中心碳核与外界聚合物链相互交联的特殊结构, 提升聚合物碳点的发光特性[19, 20]。 在各种可用于制备氮掺杂CPDs的有机氮源中, 二取代的苯胺类化合物具有独特的结构优势。 由于苯环上的两个取代胺基在碳化交联结构中, 能起到连接柔性聚合物链的桥梁作用, 并且在苯基和碳杂原子键之间形成电荷转移界面, 有利于产生电子能级, 有助于CPDs的可调谐发光行为[21, 22]。 另外, 氨基、 羟基等亲水性基团的存在使得CPDs具有良好的可络合性和生物相容性, 可与金属离子产生较强的界面相互作用, 极大程度提升CPDs的应用领域[23, 24, 25]。
本研究以邻苯二胺(o-phenylenediamine, oPDA)和海藻酸钠(sodium alginate, SA)为碳源, 通过水热反应法一步制得碳化聚合物点(SA-oPDACPDs)。 获得的CPDs具有相比于单一碳源合成的碳点较高的发光性能, 荧光量子产率为16.9%。 随着溶液环境中pH的变化, 粒子表面呈现可调性的正负电荷转换。 通过形貌和成分分析, 推测出该CPDs表面可能共存着大量的氨基和羧基, 才导致其具有类似氨基酸分子结构一样的两性性质, 存在等电点。 相应溶液的荧光发射峰由酸性向碱性变化时发生明显蓝移约40 nm。 对该碳点的成膜性质进行初步探究, 发现其保留有海藻酸钠的聚合物性能, 能与壳聚糖分子直接组装形成发光膜, 具有发光薄膜器件的潜在应用性。 在特定pH值条件下, 铅离子对该碳点的荧光信号有明显的猝灭效应并伴随着发射峰的改变, 可实现铅离子的肉眼可视化鉴别。 该碳点的荧光信号对还原性的药物也具有最敏感性响应, 其荧光猝灭程度与槲皮素药物的浓度呈现良好的线性关系。 I0/I=0.878 8+1.689 7× 10-6cQue的线性响应, 检出限LOD=1.7× 10-6 mol· L-1 (3SD/K)。 可建立对槲皮素药物含量的检测提供一种简单易行的新方法。
海藻酸钠[SA, 粘度: (200± 20) mpa· s]; 壳聚糖(CS, 粘度> 400 mpa· s); 邻苯二胺(oPDA)均购自中国阿拉丁化学试剂有限公司。 芸香苷(Rutin)和槲皮素(Que)标准品购自上海如吉生物科技有限公司; 其余试剂均为分析纯。
F-7000荧光分光光度计(日本日立公司); UV-2600分光光度计(日本岛津公司); TECNAI G2 Spirit TWIN场发射透射电子显微镜(美国FEI 公司); Versaprobe-Ⅱ X射线光电子能谱仪(日本ULVAC-PHI公司); Nicolet iS 10 傅里叶变换红外光谱仪 (美国Thermo Fisher Scientific公司); Zeta PALS 激光粒度仪(美国Brookhaven 仪器公司)。
1.2.1 荧光碳化聚合物点的制备和纯化
准确称取0.1 g海藻酸钠和0.05 g邻苯二胺, 加入超纯水完全溶解, 用盐酸和氢氧化钠溶液调节溶液pH值为4, 定容至15 mL。 将其转移至聚四氟乙烯的内衬中并密封于反应釜内, 置于160 ℃的烘箱中反应10 h。 制备的碳化聚合物点标记为SA-oPDA CPDs。 取乙二胺代替邻苯二胺, 同等条件下合成的碳化聚合物点标记为SA-EDA CPDs。
1.2.2 CPDs的性能及表征
将所制备的CPDs溶液透析去除原料后, 均匀滴在多孔碳膜上, 烘干后进行TEM形貌表征, 所得图像使用Nano measure软件分析处理。 将透析处理后的荧光碳点溶液浓缩后真空干燥, 得到棕黄色固体, 在FL-IR光谱仪和X射线光电子能谱仪上进行基团结构分析。 称取碳化聚合物点配制成1 g· L-1水溶液中, 用不同pH值的B-R缓冲溶液稀释至相同浓度溶液, 采用Zeta电位仪表征碳点表面电荷状态。 CPDs溶液的相对荧光量子产率时以硫酸奎宁(0.05 mol· L-1 H2SO4, Φ =0.55)为对照品进行测定并计算。
1.2.3 金属离子的响应
移取200 μ L SA-oPDA CPDs溶液, 分别加入3 mL不同pH的B-R缓冲溶液, 加入5 mL浓度为1× 10-4 mol· L-1的不同金属离子溶液, 用超纯水定容至10 mL, 考察不同pH条件下金属离子对CPDs的荧光强度的响应情况。 同此操作, 将不同浓度的铅离子溶液加入到含有碳点的不同pH的B-R缓冲溶液中, 测定系列溶液的荧光光谱和紫外灯下的实验现象, 考察并分析铅离子对碳点的特异性结合作用。
1.2.4 发光性聚合物点薄膜的制备
将壳聚糖溶解于醋酸水溶液中配制成3%(wt)溶液, 超声搅拌至均相透明溶液。 将溶液注入塑料培养皿并没过FTO玻璃表面, 在50~60 ℃条件下烘干成膜。 将FTO/CS薄膜在6%氢氧化钠溶液中浸泡, 醋酸中和, 并用纯水清洗至中性。 将干燥薄膜浸泡在SA-oPDACPDs溶液3 h, 取出用纯水清洗后烘干, 获得FTO/CS/CPDs薄膜。 将膜一侧朝向入射光并调整入射光与其表面的夹角约为50° , 测量薄膜的荧光光谱。
1.2.5 药物的含量检测
移取200 μ L SA-oPDA CPDs溶液中, 分别加入1 mL 1× 10-3 mol· L-1的谷胱甘肽、 盐酸多巴胺、 马来酸乙酰丙嗪、 槲皮素(醇溶)、 芦丁(醇溶)、 盐酸氯丙嗪、 DL-高胱氨酸、 氟尼辛葡甲胺、 5’ 腺嘌呤核苷酸和VB12溶液, 用pH值为7.96的B-R缓冲溶液定容至10 mL。 以不加药物为空白对照液, 考察不同药物对碳点的响应情况。 同此操作, 以不加槲皮素溶液的碳点体系为初始溶液, 测定荧光强度I0。 随后再加入不同浓度的槲皮素溶液, 摇匀后测定荧光强度In, 考察CPDs在不同浓度的槲皮素作用下荧光强度的变化, 以乙醇溶剂代替药物溶液进行空白对照实验。
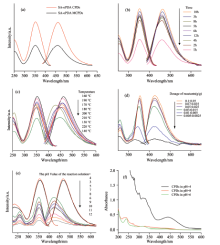
探究制备碳化聚合物点的合成条件和合成方法, 水热合成法的原料配比、 反应时间和合成方法对合成CPDs的荧光发射峰的位置没有影响[如图1(a— d)]。 反应液的酸碱度能使碳点的发光性能发生明显改变, 结果如图1(e)所示, 荧光发射强度在pH为4和5之间出现突变, 发射峰位置蓝移了近50 nm。 在pH 4条件下合成CPDs溶液的UV-Vis光谱中[如图1(f)], 显示出多个吸收峰, 一个是在235 nm处的尖锐吸收峰, 另一个是在320 nm附近的宽吸收峰, 这些吸收峰归因于芳香环中C=C的π — π * 电子跃迁和C=O的n— π * 跃迁。 而在440 nm处出现了一个显著的吸收峰, 可能是由于羰/胺基的π — π * 跃迁官能团引起。 随着溶液随着pH的升高, 质子化的胺基去质子化, 导致吸收峰强度明显降低。 推测, 可能是不同酸碱条件下合成的碳核表面保留有类胺基团结构, 导致CPDs对溶液pH环境的敏感性。
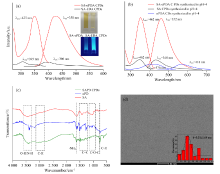
分别以邻苯二胺和乙二胺为助剂测得CPD的荧光光谱, 对比结果如图2(a)所示。 SA-EDA CPD溶液的颜色较深, 在紫外灯照射下也呈现蓝色荧光, 但是发光效果较弱, 最佳荧光激发/发射波长分别为307和398 nm。 而SA-oPDA CPD在350 nm波长激发下, 于425 nm处有最强荧光发射峰, 荧光强度增强了近10倍。 分析认为邻苯二胺的苯环结构引入, 共轭结构形成的π 电子有利于电子能级的跃迁, 导致荧光发射峰波长较大, 发光强度更高。
SA-oPDA CPDs的荧光光谱如图2(b)所示, 在352 nm波长激发下, 荧光发射峰出现红移至462 nm处, 斯托克位移可达到110 nm。 发光强度比相同条件下单海藻酸钠碳源合成的SA CPDs和单邻苯二胺碳源合成的oPDA CPDs增强了4~5倍。
为了验证碳点的结构组成, 将SA-oPDA CPDs和原料(SA和oPDA)进行红外光谱表征。 结果如图2(c)所示, CPDs在3 270 cm-1附近的吸收峰表明结构中存在O— H和N— H的伸缩振动, 与SA的羟基吸收峰特征相似。 另一个特征吸收峰出现在1 630 cm-1, 可能是由于— NH2的变形振动形成。 在1 590~1 462 cm-1之间出现的密集精细结构峰段对应的是邻苯二胺的芳香环C=C的特征性伸缩振动。 1 033和1 126 cm-1则是归因于C— O— C的拉伸振动。 在754和615 cm-1出现的尖锐峰型是由C— C的伸缩振动和取代苯的C— H键的面外变形振动引起。 进一步验证在碳化过程中形成的CPDs存在类苯胺结构。
采用高分辨率透射电子显微镜(TEM)研究了SA-oPDA CPDs的尺寸和形貌。 如图2(d)所示, SA-oPDA CPDs容易均匀分散在水中, 显微形貌呈球形, 粒径分布均匀, 无明显晶格结构。 使用Nano measurer软件进行分析, 得到该聚合物点平均粒径为3.21 nm。
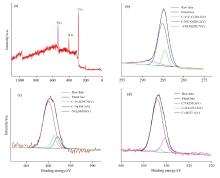
在图3(a— d)X射线光电子能谱数据进一步证实了SA-oPDA CPDs的化学组成。 在285.1、 399.7和532.5 eV处有3个明显的峰, 分别对应于C1s、 N1s和O1s的结合能[图3(a)]。 从分辨出的C1s谱可以看出, C元素的化学状态分别由C— C/C— N键(284.5 eV)、 C=O键(285.2 eV)、 C— O键(288.7 eV)组成。 O1s峰呈现出三个明显的峰, 以530.3、 531.5和532.1 eV为中心, 分别归属于C=O、 C— O— C和C— O。 N1s光谱中397.9、 398.7和400.0 eV的峰分别对应于O=C=N、 C— N和N— H键。 XPS结果与FTIR分析结果一致, 证实CPDs表面有丰富的羧基、 羟基和氨基结构。
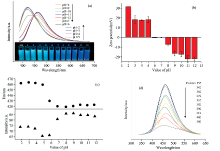
图4(a)呈现了不同pH值的水溶液环境中SA-oPDA CPDs溶液在352 nm波长下激发的荧光光谱, 紫外灯下碳点溶液颜色的荧光发射从蓝绿色变化为蓝色(内插图)。 变化趋势如图4(c)所示, CPDs的荧光强度在pH 2~4范围内保持稳定, 在pH 5时迅速下降, 从pH 6.0逐渐增大到pH 8.0时为最大值, 并保持稳定直至pH为12。 发射峰位置也呈现相对一致的变化趋势, 在pH> 5后从460 nm蓝移至425 nm。 有趣的是, 不同pH溶液中SA-oPDA CPDs的Zeta (ζ )电位在对应的突变点附近, 呈现出荷电性质的差异, 如图4(b)所示。 在酸性条件下显示正的ζ 电位, 在碱性条件下显示负的ζ 电位, 在pH 6~7的情况下, 该值接近于零, 出现类似两性高聚物一样的等电点。 当激发光源的波长从302到402 nm变化时, CPDs的发射光谱几乎没有激发依赖性, 在455~465 nm处呈现稳定发射[图4(d)]。 这些光谱特征与报道[26]的单邻苯二胺合成的碳点有很大的差异, 可证明pH调控发射波长的特性不是归因于邻苯二胺碳源, 而是引入海藻酸钠后两者共同作用的结果。
由以上结果可推测, 在高温碳化过程中, CPDs内部形成碳化发光中心, 外层表面共存大量来源于邻苯二胺和海藻酸钠的胺基和羧基。 随着溶液环境pH的增加, 碳点表面羧基的解离和胺基的质子化共同作用, 导致CPDs出现类似两性电解质的荷电可调性, 并在pH 6~7存在等电点, 从而导致不同的发光现象。
SA-oPDA CPDs特殊表面结构必然会导致其对金属离子有特异响应。 考察几种常见的金属离子对CPDs荧光信号的影响, 如图5(a, b)所示。 在酸性条件下(pH 3.78), CPDs溶液在紫外线照射下呈现蓝绿色, 加入金属离子前后并无明显变化。 结合Zeta (ζ )电位的讨论结果, 可能是由于此条件下, CPDs提供了正电荷表面状态, 因静电相斥作用而不利于与金属离子的结合。 而在弱碱性条件下(pH 6.80), CPDs溶液在紫外线照射下因呈蓝色, 当加入Pb2+后, 溶液颜色肉眼可见的变为蓝绿色。 该实验结果有助于研究金属离子与聚合物点表面结合位点的作用过程, 可作为研究纳米粒子对金属离子的吸附和释放的参考模型。
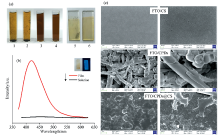
由于SA-oPDA CPDs具有可调性的表面荷电状态, 在制备薄膜过程中可据此选择合适的高分子化合物。 将CPDs与不同类型的聚电解质溶液混合, 考察其稳定性。 结果如图6(a)所示。 在CPDs溶液中加入阴离子高聚物PSS和SA(1和2), 碳点与带负电荷的易产生静电吸附作用而形成肉眼可见的絮状沉淀。 而与阳离子高聚物CS和PDDA(3和4)之间, 因带相同电荷相斥而形成较均匀稳定的溶液。 制备出的复合薄膜FTO/CPDs@CS (6)明显较FTO/CPDs@PDDA(5)更为均匀。 最优化条件下制备的发光薄膜FTO/CPDs@CS的荧光光谱和紫外灯下图像如图6(b)所示, 薄膜在溶液中的荧光发射波长稳定在425 nm, 取出薄膜后水溶液中没有荧光信号。 扫描电镜显微表征图像如图6(c)如示, 壳聚糖制备的薄膜FTO/CS在测试条件下出现明显开裂, 而FTO/CPDs可观察到碳点保留有碳化颗粒和纤维结构, 两者经静电吸附作用形成的复合薄膜FTO/CPDs@CS形成较致密的薄膜表面, 具有较好的强度, 在电子束作用下不会出现裂纹。 说明经过高温水热法制备的聚合物碳点具有一定的成膜性, 能与壳聚糖形成稳定的复合发光薄膜, 不易脱落游离到溶液环境中。
SA-oPDA CPDs对特定的药物分子有响应, 可作为荧光探针建立药物含量测定新方法。 实验结果如图7(a)所示, 在pH 7.96条件下, 具有还原性成分的药物对碳点的荧光信号猝灭程度均大于20%, 其中还原性较强的槲皮素、 芦丁及谷胱甘肽的猝灭值大于50%, 尤以槲皮素药物响应值最大。 在7.9× 10-6~7.7× 10-5 mol· L-1的范围内, SA-oPDA CPDs的荧光强度的猝灭程度与槲皮素浓度呈现良好的线性关系[见图7(b)], 加入槲皮素前后荧光发射峰波长基本不变。 响应工作曲线如图7(c)所示, 线性方程I0/I=0.878 8+1.689 7× 10-6cQue, 相关系数r2=0.974 8, 检出限LOD=1.7× 10-6 mol· L-1。 以同体积乙醇溶液代替槲皮素溶液进行平行对照实验, 结果随着乙醇用量的增加, CPDs的荧光强度几乎不变, 并不影响槲皮素对SA-oPDA CPDs的响应效果。
以海藻酸钠为主要碳源, 采用一步水热法制备了具有特殊发光性能的碳化聚合物点SA-oPDA CPDs。 该聚合物碳点具有特有的表面两性电荷pH可调性, 实验结果可推测与CPDs表面的两性共存基团有关, 具有激发波长非依赖性和较好的成膜性能。 在pH 6.80条件下, 碳化聚合物点可实现对Pb(Ⅱ )离子的可视化响应。 在pH值为7.96 B-R缓冲溶液中, CPDs对还原性药物槲皮素具有敏感响应, 荧光发射信号的猝灭程度与槲皮素浓度在7.9× 10-6~7.7× 10-5 mol· L-1的范围内呈现良好的线性关系, 测定的拟合线性方程为I0/I=0.878 8+1.689 7× 10-6cQue, 可建立一种基于荧光光谱检测槲皮素含量的简易方法。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|