作者简介: 沈 英, 女, 1982年生, 福州大学机械工程及自动化学院教授 e-mail: yshen@fzu.edu.cn
叶黄素是天然的抗氧化剂, 对人体健康有多种益处, 异养小球藻具有叶黄素纯度和产量均较高的优势, 而小球藻叶黄素产量主要取决于生物质产量和叶黄素含量两个因素。 传统的光密度法测生物质产量和高效液相色谱法测叶黄素含量存在操作复杂、 时效性低等不足。 为了快速、 无损测定小球藻生长过程中叶黄素含量变化, 搭建可见-近红外双模式快照式多光谱成像检测系统, 根据光谱响应区域, 分别利用可见光相机获取叶黄素光谱信息, 近红外相机获取生物质光谱信息, 构建含有生物质量和叶黄素含量信息的可见-近红外双模式多光谱数据集。 针对系统所使用的快照式多光谱相机光谱范围宽、 波长数量少的特征波长选取问题, 提出一种结合序列浮动前向选择的改进型连续投影算法(mSPA); 将mSPA与常规的连续投影算法、 遗传算法及随机蛙跳三种波长选择算法作对比分析后, 构建了基于特征波长的多元线性回归和极限学习机模型; 最后, 利用生物质产量和叶黄素含量的最佳预测模型生成小球藻叶黄素产量的可视化分布图。 结果表明, 在利用近红外、 可见光相机分别检测小球藻生物质、 叶黄素量时, mSPA得到的特征波长数均较少, 并具有最高的预测精度。 生物质量与叶黄素含量的最佳模型均为mSPA筛选特征波长后建立的极限学习机模型, 对应的预测集决定系数分别为0.947和0.907, 预测集均方根误差分别为0.698 g·L-1和0.077 mg·g-1, 剩余预测偏差分别为3.535和3.338, 模型的预测能力较好。 可视化分布实现了直观监测小球藻叶黄素产量的变化, 有助于后续实际生产中在线检测叶黄素产量。 mSPA在快照式多光谱检测小球藻生物质含量及叶黄素含量中, 通过对排序波长逐个评估以选择出最佳特征波长组合, 有效地避免了特征波长的错选、 漏选, 提高了模型的预测精度, 为快照式多光谱成像技术应用提供新的波长选择思路。
Lutein is a natural antioxidant that has numerous benefits for human health. Heterotrophic Chlorella sorokiniana has the advantage of high purity and production of lutein. In contrast, the production of lutein in Chlorella sorokiniana mainly depends on two factors: biomass productivity and lutein content. However, conventional approaches such as the optical density method for measuring biomass productivity and high-performance liquid chromatography for measuring lutein content suffer from drawbacks, including complex procedures and limited timeliness. A visible near-infrared dual-mode snapshot multispectral imaging detection system was constructed to rapidly and non-destructively determine the variations in lutein production during the growth process of Chlorella sorokiniana. Based on the spectral response range, the visible camera was used to obtain the spectral information image of lutein content, and the near-infrared camera was used to obtain the spectral information image of biomass productivity to build a visible near-infrared dual mode multispectral dataset containing biomass productivity and lutein content information. To address the issue of wide spectral range and limited wavelengths in the snapshot multispectral camera used in the system, a novel approach combining sequential floating forward selection with a modified successive projections algorithm (mSPA) was proposed. A comparative study was conducted, evaluating mSPA against successive projections algorithm, genetic algorithm, and random frog algorithm for wavelength selection. Multiple linear regression and extreme learning machine models were constructed based on the selected feature wavelengths. Finally, the optimal predictive models for biomass productivity and lutein content were used to generate a visualization distribution map of lutein production in Chlorella sorokiniana. The results indicated that when using near-infrared and visible cameras for biomass productivity and lutein detection in Chlorella sorokiniana, the mSPA algorithm consistently yielded fewer feature wavelengths for both biomass productivity and lutein and achieved the highest prediction accuracy. The optimal models of biomass productivity and lutein content were established using the mSPA-selected feature wavelengths in combination with an extreme learning machine. The corresponding coefficients of determination for the prediction sets were 0.947 for biomass productivity and 0.907 for lutein, with root mean square errors of 0.698 g·L-1 and 0.077 mg·g-1 and residual prediction deviations of 3.535 and 3.338, respectively. The models demonstrated good predictive capabilities. The visualization distribution successfully achieved intuitive monitoring of lutein production variations in Chlorella sorokiniana, which is beneficial for online detection of lutein content in practical production scenarios. The mSPA algorithm, employed in the snapshot multispectral detection of biomass productivity and lutein content in Chlorella sorokiniana, effectively avoided the incorrect selection and omission of feature wavelengths by evaluating each sorted wavelength individually, thereby improving the prediction accuracy of the models. This approach provides a new wavelength selection strategy for applying snapshot multispectral imaging technology.
叶黄素是一种羟基类胡萝卜素, 主要存在于高等植物和藻类等光自养生物中[1], 因具有较强的抗氧化、 抗炎和着色特性, 在化妆品、 食品添加剂、 保健品等领域广泛应用[2, 3, 4]。 以小球藻为代表的一些微藻被认为是潜在的叶黄素来源, 利用富含叶黄素的微藻生产叶黄素时, 生物质和叶黄素含量是影响其产值的重要指标, 两者的同时测定有利于开展对不同培养条件下微藻生长与叶黄素积累的研究, 以获取更高的叶黄素产量[5]。 常规的测定方法专业性强、 操作步骤繁琐、 检测耗损率高且易造成化学试剂的污染[6]。 因此, 探究一种快速、 无损测定微藻生物质量及叶黄素含量的方法对促进微藻叶黄素规模化培育生产具有重要意义。
光谱成像技术作为一种结合光谱分析和计算机视觉的无损检测技术, 可同时获取样本的图像信息与光谱信息, 实现“ 图谱合一” [7], 为小球藻生物质量及叶黄素含量的检测提供了新的思路。 在已有的研究中, 蒋璐璐等[8]采用高光谱成像技术结合化学计量学方法, 实现了对小球藻、 球等鞭金藻和螺旋藻生物量的预测及可视化分析, 其中, 小球藻生物量在0.250~0.412 g· L-1范围内的预测相关系数为0.950。 Shao等[9]通过可见/近红外透射光谱对螺旋藻的类胡萝卜素进行检测, 验证了光谱技术检测微藻类胡萝卜素的可行性。 但针对微藻类胡萝卜素中叶黄素的光谱检测研究很少。
随着光谱传感器的发展, 具有视频速率和超便携优势的快照式多光谱成像相机引起广泛关注[10]。 快照式多光谱相机的光谱范围宽, 波长数量少, 筛选出合适的特征波长组合至关重要。 连续投影算法(successive projections algorithm, SPA)能够将光谱变量按照共线性排序, 根据设定的判别条件可选择出具有最小共线性的变量组合, 从而去除冗余信息[11]。 Wu等[12]通过多光谱成像对瘦肉片中的骨碎片进行分类, 采用SPA从19个波长中筛选出7个特征波长, 基于特征波长建立的模型比全光谱模型效果更好。 序列浮动前向选择(sequential floating forward selection, SFFS)是一种特征浮动增减算法, 能够从空集开始加入或者剔除特征, 迭代得到最佳特征子集[13]。 Quinzá n等[14]在研究多光谱检测非侵入性黑色素瘤病变过程中, 利用SFFS从55个波长中选择了9个特征波长建立预测模型, 分类正确率达到100%。 可以发现, SPA和SFFS在多光谱特征波长选择上的优势, 但单独SPA在经共线性排序选择的波长组合中不一定全都包含物质光谱信息[15], 仅用SFFS这种智能优化算法存在输入顺序需要反复迭代, 计算量大等问题[16]。
以不同生长时期的小球藻为研究对象, 搭建双模式可见-近红外快照式多光谱成像系统采集样品不同波长范围光谱信息, 可见光(visible, VIS)相机用于检测叶黄素含量, 近红外(near-infrared, NIR)相机用于检测生物质含量; 在SPA的基础上结合SFFS, 提出了改进的连续投影算法(modified successive projections algorithm, mSPA)优选特征波长, 构建了小球藻生物量及叶黄素含量的预测模型, 进而获取叶黄素产量分布的可视化, 为实现其快速检测提供可靠技术方案及理论依据。
小球藻(Chlorella sorokiniana FZU60)藻种由福建省海产品废弃物综合利用工程技术研究中心提供, 采用Mann and Myer's培养基培养, 培养温度30 ℃、 光照强度 250 μ mol· m-2· s-1, 以0.15 vvm速率通入浓度2.5%的CO2作为碳源, 以200 r· min-1的速率进行磁力搅拌。
1.2.1 光谱成像系统搭建
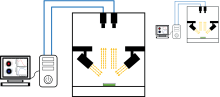
因异养小球藻浓度高, 透射光谱成像的噪声较大, 所以均采用漫反射形式。 高光谱图像采集系统主要由双利合谱GaiaField-V10E内置推扫高光谱相机、 卤素灯、 暗箱及计算机等部件组成, 其中, 高光谱相机波长范围在386~1 035 nm, 光谱分辨率为2.8 nm。 快照式多光谱图像采集系统如图1所示, 由快照式多光谱相机(XIMEA, MQ022HG IM SM4× 4 VIS、 MQ022HG IM SM5× 5 NIR)、 卤素灯、 暗箱、 样本平台和计算机等部件组成。 其中VIS相机可获得480~635 nm光谱范围内13个波段的光谱图像, 光谱分辨率约为10 nm, 单波段图像分辨率为512× 272 pixels; NIR相机可获得在665~950 nm光谱范围内25个波段的光谱图像, 光谱分辨率约为10 nm, 单波段图像分辨率为409× 217 pixels。 VIS和NIR相机镜头均采用35 mm定焦镜头(Edmund, #67-714)。
1.2.2 样本制备及生物质含量、 叶黄素含量测量
叶黄素作为类胡萝卜素的一种, 在进行光谱分析时, 易与其他类胡萝卜素的光谱信号重叠, 为了确定叶黄素的有效光谱测量波段, 参考Qu等[17]分析叶绿素a吸收光谱峰值的方法, 取一定量的叶黄素标准溶于95%乙醇溶液配置成5、 25和50 μ mol· L-1三个浓度的叶黄素标准品溶液, 采集并分析其高光谱曲线。 小球藻培养过程中, 每隔24 h取一次样, 测定该阶段的生物质含量、 叶黄素含量, 并进行多光谱图像的采集, 取样周期共7 d, 对于高浓度藻液进行适当稀释, 每个样本采集两次取平均, 共计112个样本。
生物质含量采用文献[5]所述的分光光度计比对法测量, 叶黄素含量采用文献[18]所述高效液相色谱仪检测法进行测量。 小球藻叶黄素含量由生物质产量与叶黄素含量乘积获得。
1.2.3 光谱图像的采集及校正
采用高光谱系统依次采集叶黄素标准品溶液、 乙醇溶剂、 水以及小球藻三种浓度梯度的高光谱图像, 相机镜头与载物台相距30 mm, 卤素灯距载物台150 mm, 光源入射角度与竖直方向成45° 夹角, 曝光时间5.2 ms。 通过快照式多光谱系统采集小球藻样本的漫反射光谱图像, 设置镜头距载物台450 mm, 卤素灯距载物台350 mm, 为避免样本光照的不均匀及局部过曝, 统一调整光源入射角度与竖直方向成30° 夹角, VIS和NIR多光谱相机的曝光时间分别为2.0和8.0 ms, 为保证样本的一致性, 两台相机同时拍摄。 为消除光源分布不均及相机暗电流噪声的影响, 须对采集的样本光谱图像进行黑白校正, 全白图像、 全黑图像分别通过采集反射率99%的聚四氟乙烯板和盖上相机镜头来完成, 校正公式如式(1)[19]
$R=\frac{\ \ \ \ \ {{I}_{\text{raw}}}\ \ \ -\ \ \ {{I}_{\text{dark}}}\ \ \ \ }{{{I}_{\text{white}}}\ \ \ -\ \ \ {{I}_{\text{dark}}}}\ \ \ \ $(1)
式(1)中, R为校正后的光谱图像; Iraw为校正前原始光谱图像; Idark为关闭光源的全黑图像; Iwhite为标准白板图像。 获取图像后, 为减少样本背景信息的干扰, 通过ENVI 5.1(ITT Visual Information Solutions, United States)软件提取感兴趣区域(region of interest, ROI), ROI取样本光谱图像正中央50× 50 pixels, 以该区域内的像素平均值作为样本光谱反射率, 实验数据建模分析主要通过Matlab R2020a(The Math Works, Natick, USA)软件来完成。
1.3.1 特征波长的选择
光谱检测中会存在无效甚至干扰的冗余波长, 利用合适的波长选择算法可以降低维数, 在一定程度上提升模型的速度和精度。 常规的波长选择算法大多以高光谱数据为导向, 起到快速消除大量冗余或逐一对单个波长寻优的作用[20], 快照式多光谱相机波长数量较少, 特征波长的选择需要逐一评估形成最佳波长组合。 SPA是一种前向循环选择算法, 通过投影排序与回归分析得到特征波长组合, 可降低特征波长组合的共线性, 在光谱的定性和定量分析中应用广泛[21]。 但该算法缺乏任一波长对特征波长组合的有效性判断, 导致选中的特征波长组合中含有冗余或缺失关键性变量, 而SFFS可以在不断的正向检查和反向消除过程中获取最佳特征子集。 设计的mSPA算法是对SPA的回归分析部分采用SFFS改进, 具体算法流程如图2所示。
mSPA算法由为波长投影排序和波长集合优选两部分组成。 首先通过SPA循环计算随机选定的波长在未选入波长上的投影, 保证新选入的波长与原有波长组合共线性最低, 重复操作, 得到所有波长的投影排序。 而后, 根据波长排序依次将对应列向量输入波长集合优选部分, 如图2中红色区域, 利用SFFS交叉验证评估该波长对于集合所建立的预测模型精度是否增加, 若增加, 则保留该波长, 否则考虑下一个波长, 为避免在添加波长后陷入局部最优状态, 在入选新的波长后进行消除操作, 若删除任一波长使得模型的精度提高, 则删除该波长, 保留新的波长子集W, 记录当前的RMSECV。 当RMSECV不随波长变量的输入降低时, 将该波长子集作为mSPA筛选的最优波长组合。 为验证该算法在快照式多光谱波长选择的优势, 实验选择了SPA、 遗传算法(genetic algorithm, GA)[22]、 随机蛙跳(random frog, RF)[23]作为对比算法。
1.3.2 模型的建立与评价指标
为构建目标组分与光谱信息间的回归预测模型, 实验采用线性建模方法多元线性回归(multiple linear regression, MLR)和非线性建模方法极限学习机(extreme learning machine, ELM)建立小球藻生物质产量及叶黄素含量的预测模型。 MLR结构简单, 可用于多个自变量的回归分析, 是光谱数据建模的经典线性方法[24]; ELM 是一种单隐含层前馈神经网络算法, 具有较强的非线性映射能力, 学习效率高[25]。
根据不同组分、 波长选择算法及建模方法分别建立模型, 利用量化的评价指标对不同模型精度进行比较, 以预测集决定系数
采用随机划分[27]的方法划分样本集, 为减小单次随机划分对模型结果的影响, 以多次随机抽样控制生物质含量和叶黄素含量的预测集样本均包含在校正集样本范围内, 校正集、 预测集的平均值和标准差的差值尽可能小, 进而保证样本均匀分布, 具有代表性。 将112个小球藻样本按3∶ 1的比例划分校正集和预测集, 样本划分结果如表1所示, 得到校正集样本84个、 预测集样本28个, 预测集样本均包含在校正集样本范围内, 校正集和预测集的平均值(标准差)接近, 说明样本划分合理。
| 表1 样本集划分后小球藻生物质含量和叶黄素含量的统计结果 Table 1 Statistical results of biomass content and lutein content of Chlorella sorokiniana after sample set division |
叶黄素标准品溶液样本及乙醇溶剂的光谱曲线如图3所示, 与乙醇溶剂的光谱曲线相比, 叶黄素标准品溶液在388~525 nm存在多个波峰、 波谷, 并且在不同浓度梯度的叶黄素中, 光谱反射率与叶黄素含量呈显著负相关, 变化趋势基本一致, 排除样本异常, 故该区域内包含较为丰富的叶黄素光谱信息, 且可发现随着叶黄素的浓度的增大, 反射率越低, 说明光谱的吸收更强烈; 在950~1 030 nm范围内的微小变化, 可能是叶黄素中的O— H键所造成的, 但光谱信号非常弱。 实验结果说明叶黄素光谱响应强的波段集中在可见光区域, 这与邹小波等[28]研究中所述色素检测波段大都在集中在可见光区域一致, 因此, 本实验采用VIS相机检测小球藻叶黄素含量。
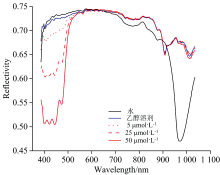 | 图3 水、 乙醇溶剂及5、 25、 50 μ mol· L-1叶黄素标准品溶液的高光谱曲线Fig.3 Original spectral curves of 5, 25, 50 μ mol· L-1 lutein standard solutions and ethanol solvent |
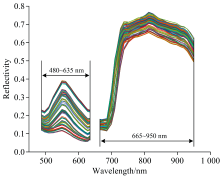
图4、 图5分别是低、 中、 高三种浓度梯度的小球藻高光谱曲线以及NIR与VIS两台快照式光谱相机采集的所有小球藻样本光谱曲线。 在图4中, 不同光谱曲线形状相似, 随着小球藻浓度升高, 光谱反射率曲线整体逐渐下降, 在388~520 nm范围出现波谷, 主要是细胞内类胡萝卜素(包含叶黄素)的吸收产生的[9], 这也与叶黄素标准品的反射光谱峰谷区相近。 图5中500 nm附近同样也出现色素吸收波谷。 640~705 nm范围光谱反射率与叶绿素含量密切相关, 图4和图5在这个范围内均有明显的波谷, 藻液中水的O— H键伸缩振动会在950 nm附近产生波谷。 叶绿素含量可以很好的反映生物质产量[8], 因此选择NIR相机检测小球藻的生物质产量。
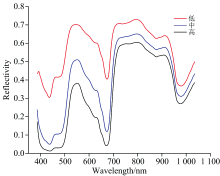 | 图4 低、 中、 高三种浓度的小球藻高光谱曲线Fig.4 Hyperspectral curves of Chlorella sorokiniana samples with different concentrations (low, medium, and high) |
如图6所示, 为mSPA选择特征波长的过程(以生物质含量为例)。 波长经投影排序后逐个迭代选择, 随着迭代次数的增加, RMSECV逐渐减小直至不变, 当迭代次数为16时, RMSECV首次达到最小值0.277, 此时的波长组合即是mSPA优选特征波长的结果。 经mSPA、 SPA、 GA及RF选择生物质含量和叶黄素含量光谱特征波长的结果如表2所示。 在665~950 nm的生物质含量特征波长中, 四种算法所选择的波长集中在710 nm, 位于叶绿素的吸收区附近[29], 并且mSPA和GA筛选的波长相对更少。 在488~635 nm的叶黄素含量特征波长中, mSPA优选出5个波长, 所有算法均选择出497、 523 nm这两个波长, 这与叶黄素所在的388~525 nm吸收区相关, 说明这两个波长包含着小球藻叶黄素关键光谱信息。
| 表2 生物质含量和叶黄素含量的光谱特征波长选择结果 Table 2 Spectral feature wavelengths selection results of both biomass content and lutein content |
为了分析特征波长选择算法对建模的影响, 分别对比了mSPA与全波长, SPA、 GA、 RF三种常用特征选择算法, 表3所示为采用不同特征波长选择算法的MLR建模。 对于生物质含量模型, mSPA用7个波长建立的模型精度最高, 模型的
| 表3 生物质含量和叶黄素含量的特征波长MLR建模结果 Table 3 MLR modeling results band on feature wavelengths of both biomass content and lutein content |
同理, 采用ELM对生物质含量和叶黄素含量的全波长和特征波长建立模型, 结果如表4所示。 在生物质含量和叶黄素含量的预测效果上, mSPA所建立的模型精度仍最高,
| 表4 生物质含量和叶黄素含量的特征波长ELM建模结果 Table 4 ELM modeling results based on feature wavelengths of both biomass content and lutein content |
基于mSPA筛选出的光谱特征波长, 分别从VIS和NIR图像中提取特征波长对应的特征图像, 并根据相机位置固定, 采用提前配准得到的变换矩阵实现各波段图像像素点的对齐, 避免因相机视角不同而造成的差异, 得到配准后特征图像的感兴趣区域, 以最佳预测模型ELM计算出图像逐个像素点的生物质含量及叶黄素含量。
叶黄素含量(mg· L-1)可表示为生物质含量(g· L-1)和叶黄素含量(mg· g-1)图像上对应像素点的乘积, 生成不同培养周期下的小球藻叶黄素含量可视化分布伪彩图, 如图7所示。 从蓝色到红色表示含量逐渐升高, 颜色越红, 产量越高。 整体上, 小球藻叶黄素含量表现出随着培养时间的增加而增加, 并且藻体分布不均匀, 藻细胞聚集现象明显。 在实际生产中, 小球藻叶黄素的产量需要综合分析生物质含量和叶黄素含量这两个因素, 培养初期生物质含量升高而叶黄素含量低, 培养末期, 生物质含量平缓而叶黄素含量提升[31]; 不同的培养方式对微藻的生物质含量和叶黄素含量影响也不同, 例如自养条件下, 微藻生长缓慢, 可积累较高的叶黄素含量, 通过异养培养则可明显提高生物质含量, 但又会导致叶黄素含量降低[32]。 结果表明NIR-VIS快照式多光谱联用可快速检测叶黄素产量的变化, 对培养过程中营养素补充、 搅拌、 通气等操作进行有效指导, 同样还可以根据叶黄素产量来判断收获时间, 提高经济效益和生产效率。
采用自行搭建的可见-近红外双模式快照式多光谱成像系统, 以影响小球藻叶黄素产量的生物质含量和叶黄素含量为研究对象, 提出特征波长选择算法mSPA, 实现对小球藻叶黄素含量的可视化检测。 根据光谱响应区域, 确定NIR、 VIS相机分别检测小球藻生物质含量和叶黄素含量, 对比mSPA与SPA、 GA、 RF四种波长选择算法, MLR和ELM两种建模方法。 结果表明, 经mSPA筛选波长建立的MLR和ELM模型均优于全波长和另外三种算法, 并且生物含量和叶黄素含量的最优模型均为mSPA-ELM。 对于生物质量预测模型,
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|