作者简介: 刘会俏, 女, 1998年生, 信阳师范大学化学化工学院副教授 e-mail: liuhq@xynu.edu.cn
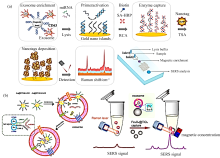
表面增强拉曼散射(SERS)因其灵敏度高、 非侵入性、 多路检测等特点, 已广泛应用于生物医学检测。 研究发现微小核糖核酸(miRNAs)的异常表达与多种疾病有关, miRNAs已成为一种新型的生物标志物。 开发简单、 灵敏、 可靠的miRNAs检测方法, 对miRNAs的生物学功能研究、 医学诊断、 疾病治疗和靶向药物研究具有重要意义。 目前, 与核酸信号放大策略相结合的纳米SERS探针, 用于miRNAs检测表现出较高的灵敏度。 然而实际样本中成分复杂, 易产生背景信号, 干扰检测结果; 分离纯化过程繁琐, 增加了检测时间。 近年来, 研究者们通过结合其他技术来优化检测, 提高样本检测通量、 简化操作、 减少分析时间、 提高分辨率。 该论文主要介绍了基于SERS技术的miRNAs检测方法的最新进展, 讨论了技术融合的优势与必要性, 并总结了基于SERS技术的miRNAs检测用于临床检测还存在的问题, 旨在为设计新型快速灵敏可靠的miRNAs SERS检测平台提供参考。
Surface-enhance Raman scatting (SERS) has been widely used in biomedical detection due to its high sensitivity, non-invasive, multi-channel detection and other characteristics. The abnormal expression of microribonucleic acid (miRNAs) has been found to be associated with a variety of diseases, and miRNAs have become a novel biomarker. The development of simple, sensitive and reliable miRNAs detection methods is of great significance for studying biological function, medical diagnosis, disease treatment and targeted drug research of miRNAs. Nano-SERS probes combined with nucleic acid signal amplification strategy showed high sensitivity for miRNAs detection. However, the components in the actual samples are complex, resulting in background signal interference detection results, and the tedious separation and purification process increases the detection time. Researchers have recently combined other techniques to optimize detection, improve sample throughput, simplify operations, reduce analysis time, and improve resolution. This paper mainly introduces the latest progress in miRNAs detection method based on SERS technology, discusses the advantages and necessity of technology fusion, and summarises the existing problems of miRNAs detection based on SERS technology for clinical detection, aiming to provide a reference for the design of a new fast, sensitive and reliable miRNAs detection platform.
拉曼光谱是一种重要的光谱分析手段, 常用来研究分子结构及物质分析。 拉曼光谱分析的优点在于检测快速、 准确、 无需复杂的样品制备甚至可以直接测量、 水的干扰小且不损害样品[1]。 表面增强拉曼散射(surface-enhanced Raman, SERS)是在普通拉曼散射基础上发展起来的一种技术, 继承了拉曼光谱的大部分优点, 并且显著提高了信噪比, 可用于痕量分析[2, 3]。 基于SERS的检测方法能够提供更丰富的化学分子的结构信息, 可实现实时、 原位探测, 而且灵敏度高、 数据处理简单、 准确率高, 是非常强有力的痕量检测工具, 在生物标志物检测、 食品安全、 细胞成像等方面都有广泛的应用[4, 5, 6, 7]。
microRNAs(miRNAs)是一类存在于真核生物的内源性非编码成熟RNA短序列, 通过与信使RNA特异性结合调控基因表达, 参与个体生长发育、 细胞增殖分化、 免疫反应、 肿瘤侵袭等多种生命过程[8, 9]。 miRNAs的异常表达与多种疾病的发生发展密切相关, 可作为一种新型生物标志物[10, 11, 12]。 通过miRNAs的定量检测, 对疾病进行的早期诊疗和预后, 可以极大的提高生存率。 常规miRNAs的检测方法有Nortern印记法[13]、 微阵列[14, 15]、 荧光法[16, 17, 18]、 电化学检测[19, 20, 21, 22]、 RT-qPCR法[23, 24]等。 这些方法都有其局限性, 如Nortern印记法操作复杂, 微阵列灵敏度低, 电化学检测选择性较差, 荧光信号易受光漂白, RT-qPCR前处理复杂、 易污染等缺点, 不利于miRNAs的快速灵敏检测。 基于SERS的检测技术具有高灵敏度、 高信噪比、 抗光漂白等特点, 并且满足无损检测、 多路检测、 原位检测的要求, 在实际生物样品的miRNAs检测中表现出巨大的潜力[25]。
基于SERS技术的miRNAs检测发展迅速, 通过设计等离子体纳米结构与核酸信号放大策略相结合的纳米探针, 提高了检测灵敏度[8, 26]。 本文概述了SERS增强机理和SERS探针的构造, 分析了高灵敏SERS传感器的构建要点, 重点论述了SERS传感平台与微流控、 电化学、 荧光等技术融合以优化miRNAs检测的最新研究, 展望了该技术的前景与用于临床检测和即时诊断亟待解决的问题。
1974年Fleischmann等[27]观察到SERS现象, 用粗糙银电极表面上吡啶吸附量增加来解释拉曼增强现象, 但Van Duyne实验发现吡啶分子因吸附量增加不足以达到105~106的增强[28], 从而提出还有一种与粗糙表面相关的特殊效应— — SERS效应。 经过多年的研究发现SERS增强是由电磁场增强(EM)和化学增强(CE)共同作用。 关于电磁场增强机理, 目前已经研究的较为成熟, 化学增强原因复杂, 现阶段还没有统一的定论。
电磁场增强机理在SERS增强中起主要作用, 与等离子体共振有关。 如图1(a, b)所示, 在入射光的照射下, 金属表面的自由电子发生集体振荡, 入射光的频率与自由电子的振荡频率相匹配时, 发生相互作用, 导致入射光发生散射或共振吸收, 即表面等离子体共振(SPR); 当共振发生在更小的等离子体纳米颗粒上时, 即局域表面等离子激子基元共振(LSPR), 电磁场强度显著增强[29]。 SERS增强因子近似与局域电场强度的四次方成正比。 金属纳米粒子间缝隙处电磁场较强, 增强因子高达1011, 通常被称为“ 热点” 。 该处电磁增强是由等离子体纳米粒子发生电磁耦合引起的, 作用范围只有几纳米, 超出这个区域, SERS效应迅速减弱。 通过增加“ 热点” 或将分析物局限在“ 热点” 处可以显著提高检测物的分析信号[30]。
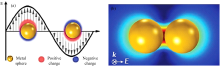 | 图1 (a)LSPR效应图; (b)金纳米粒子(AuNPs)周围电磁场分布图[29]Fig.1 (a) LSPR effect map; (b) Electromagnetic field distribution map around gold nanoparticles[29] |
化学增强机制比较复杂, 主要是从金属基底与吸附分子之间的相互作用来解释。 主要有三种增强过程: (1)分子激发共振, (2)吸附到金属表面时, 分子极化率的非共振变化, (3)电荷转移共振[28, 31, 32]。 第一种机制涉及到直接激发吸附分子的最高已占据分子轨道-最低未占据分子轨道跃迁, 类似于共振拉曼效应。 使用在可见光范围内具有电子共振的分析物可以实现极高的SERS增强。 第二种机制涉及到被吸附分子和金属表面之间的基态化学相互作用, 由于分子的变化而导致更高的拉曼极化率和分子组分的振动模式。 这一过程对分子的几何形状、 局部环境和分子-金属相互作用的强度比较敏感。 取决于分子的官能团, 偏向于更强的供电子基团。 第三种机制是基于吸附分子金属络合物的形成, 这意味着分子能级在费米能级附近的再分配, 这可以导致电荷转移电子态的形成[33]。 当激光能量与这个新形成的电荷转移态相匹配时, 就会发生共振, 实现拉曼增强。 这种跃迁可以从分子到金属, 也可以反过来发生, 这取决于被吸附分子的电子结构相对于金属的费米能级[34]。
拉曼报告分子标记的SERS探针产生增强的拉曼信号可以间接反映被分析物的数量, 是SERS传感器的关键组成部分。 通常贵金属纳米颗粒作为SERS探针基底, 拉曼报告分子提供特定的光谱信号用于示踪, 壳层结构保护探针能够在复杂生物环境中稳定存在, 在其外部修饰能与目标生物分子特异性匹配的靶向配体, 特异性检测生物分子的SERS探针即制备完成[35, 36]。
金、 银纳米颗粒是最常用的SERS探针基底材料, 其化学组成、 结构、 大小等都会对SERS探针的性能产生影响。 通常设计有沟壑、 缝隙、 孔洞、 针尖、 壳层等有利于“ 热点” 增加的结构作为SERS探针基底。 用以提供特征信号的拉曼报告分子应满足以下要求: 一是具有大的拉曼散射截面和易区分的拉曼峰, 能够提供具有较强的拉曼信号用以示踪; 二是要能紧密吸附在SERS基底上, 以保证稳定的信号输出。 拉曼报告分子通过化学吸附(化学键)或者物理吸附(静电引力、 包覆等)吸附在SERS基底上。 拉曼分子通常具有N、 S等元素或共轭结构的有机分子, 其含有的孤对电子或共轭电子对有助于与金属基底发生电荷转移。 大多数生物分子在指纹区域(< 1 800 cm-1)与拉曼分子易发生谱峰重叠, 拉曼信号难以完全解析, 影响SERS检测结果的准确性。 含炔基、 氰基、 叠氮(N3)、 氘和金属羰基的化合物在细胞静默区(1 800~2 800 cm-1)具有特征峰, 该区域内大多数生物分子不产生拉曼散射信号, 避免了样品本征信号干扰。 因此, 静默区拉曼分子标记的探针可用于细胞内生物分子的检测示踪。 用于稳定探针并防止拉曼报告脱离的保护层可以是二氧化硅, 也可以是大分子聚合物或生物分子等。 Li等[37]提出了一锅法制备纳米探针的通用方法, 通过多巴胺水解生成具有强附着力的聚多巴胺原位合并拉曼分子于SERS基底表面, 不受拉曼染料化学结构的限制。 最后, 靶向配体可以通过Michael加成结合到聚多巴胺表面。 根据检测生物分子的不同, 靶向配体为抗体(抗原)或者核酸序列。 一个探针上可修饰多种生物分子和多种拉曼分子, 构成用于多元检测的SERS探针。
SERS传感器结构通常为“ 三明治” 型或“ 发卡” 型。 “ 三明治” 结构的传感器是通过目标miRNA将检测基底与SERS探针连接起来, 探针与基底之间的电磁增强“ 热点” , 使拉曼分子的SERS信号显著增强。 检测基底为固态基底(玻璃片、 硅片等)或分散的微粒(金属纳米颗粒、 磁球等)。 前者在固态基底表面检测, 后者可直接在液相中检测。 “ 发卡” 结构的SERS传感器, 则是将拉曼分子标记的捕获“ 发卡” 核酸(具有颈环结构的核酸)固定在SERS探针上。 通过与目标miRNA杂交, 调节颈环结构的开合, 使拉曼分子与SERS基底距离发生变化, 从而产生增强(近)或减弱(远)的SERS信号。 由于实际样本(细胞、 组织和生理液体)中的miRNAs具有低丰度、 高度同源、 易降解等特点, 传统的SERS探针用于miRNAs的精确检测在灵敏度和选择性方面还存在一定的不足。 核酸扩增是进行基因检测的重要方法, 利用DNA或RNA序列的复制和积累, 可实现信号放大。 在SERS传感器探针设计中引入核酸扩增, 能有效提高检测的特异性和灵敏度。 目前, 用于miRNAs检测的SERS传感器大多数是将带标记的SERS探针与核酸扩增的信号放大策略相结合。
2.2.1 酶辅助核酸扩增策略
酶辅助扩增成本较高, 但特异性好, 效率高。 聚合酶链式反应是使用最广泛的酶辅助扩增手段, 但需要变温才能复制, 依赖于热循环仪。 滚环扩增(RCA)是一种恒温酶辅助扩增技术, 能够克服温控设备的依赖, 在DNA聚合酶的作用下, 引物与环状DNA模板结合后延伸, 生成含有大量目标基因的长单链DNA。 将酶扩增的产物与SERS探针结合, 研究者构建了多种高灵敏miRNAs传感器[38, 39]。 级联放大是整合两种及以上扩增方法的技术, 通过巧妙的设计使上一级扩增反应的产物触发下一级的扩增反应, 可以达到与某些指数放大技术相当的灵敏度。 Liang等[40]基于“ 三明治” 结构的生物素-链霉亲和素系统和级联扩增, 构建了miRNA-21检测的SERS传感平台。 结果表明, 级联扩增的检出限为38.02 fmol· L-1, 比没有级联放大检测体系的检出限(97.81 pmol· L-1)降低了三个数量级。
2.2.2 无酶核酸扩增策略
无酶信号放大技术是一种十分经济、 简便的核酸扩增方法, 具有高灵敏度、 高度序列依赖性、 自动化等特点, 需要设计严谨的自组装体系以减少非特异性扩增。 Zhou等[41]利用具有较高序列依赖性和特异性的立足点介导的链位移置换反应实现对miRNA-21 fmol· L-1级的灵敏检测。 杂交链式反应(HCR)是一种新型的等温扩增技术, 它利用分子识别和杂交反应依次打开多个发卡探针, 形成长双链聚合物, 得到累计信号, 实现选择性检测靶分子的目的。 Liu等[42]通过HCR触发原位热点组装, 将多个热点聚集在一起, 从而显著提高标签的亮度, 最终实现miRNA-21的单分子检测。 催化发夹自组装(CHA)是一种经济高效的无酶扩增技术, 具有快速信号放大、 背景底、 周转率高等优点, 通过利用靶体循环实现信号放大。 Si等[43]采用CHA设计了多靶标miRNAs同步检测的SERS传感阵列。 该SERS传感阵列能够在缓冲液、 血清和细胞RNA提取物中检测多种与癌症相关的miRNAs。
SERS传感器根据拉曼信号强度变化与待测miRNAs浓度的关系分为信号增强型、 信号衰减型和比率型。 信号增强型SERS传感器原理是目标miRNA触发互补核酸序列杂交, 使拉曼报告分子标记的SERS探针与SERS基底之间的距离减小, 产生电磁场增强。 通过纳米粒子自组装, 利用SERS探针之间产生的“ 热点” , 提高拉曼信号强度, 在miRNAs的检测中广泛应用[29, 44]。 与信号增强型相反, 信号衰减型是通过剪切酶或者核酸序列之间的碱基互补配对使拉曼报告分子远离增强基底, 导致SERS强度减弱甚至猝灭。 Wen等[45]将外切酶辅助靶循环扩增与等离子体耦合增强效应相结合, 构建了信号衰减型SERS传感平台, 用于miRNA-21的超灵敏检测。 拉曼报告分子标记的金纳米星探针与金修饰硅纳米线阵列衬底上的硫代适配体共价连接, 由于衬底和探针之间耦合电磁场的作用, 产生增强的拉曼信号。 靶标miRNA与适配体杂交形成双链, 外切酶特异性水解适配体/miRNA双链上的适配体, 导致探针与衬底分离, 等离子体耦合效应减弱, 拉曼信号强度减弱。
常规的SERS检测方法用单一拉曼信号评估目标物的含量, 易受不可控因素的影响, 如探针与SERS基底之间的非特异性吸附可能导致假阳性结果, 背景干扰等原因使得检测结果重复性较差。 比率检测是一种消除大多数干扰的理想方法, 以提供更精确的测量。 比率型SERS传感器通过引入内部标准或比值法, 可以减少背景干扰, 提高检测结果的稳定性和可靠性, 为miRNAs分析提供强大助力。 Chen等[46]设计了一种比例式传感平台, 用于miRNA-21灵敏和可重复性检测。 将4-氨基苯硫酚(4-ATP)用作校正内标分子固定在SERS探针上, 罗丹明6G(R6G)修饰在发卡核酸链上, 当目标miRNA出现时触发CHA循环, R6G标记核酸链被4-ATP标记的SERS探针捕获。 来自R6G标记的SERS信号强度增加, 而来自4-ATP的SERS信号相对保持不变。 有效避免了工作条件和样品干扰产生的信号波动。 Liu等[47]提出了一种基于MXene/二硫化钼(MoS2)@AuNPs的协同校准SERS策略, 实现对miRNA-182的超灵敏检测。 通过选择MXene/MoS2自身的三个特征拉曼峰(分别为MoS2的382和402 cm-1, MXene的611 cm-1)作为基准, 而不是额外的分子信标, 线性拟合优度可达0.999 5, 显著高于单峰或双峰标定情况, 提高了检测精度。
血液、 血清、 尿液等生理液体是最常见的临床检测样本[48], 能够提供微创或无创检测。 由于实际样本的复杂性, 如果分子探针中没有抗干扰成分, 则可能出现假阳性信号[49]。
Zhang等[50]采用核壳探针提供有效屏障, 通过将薄层硅壳包覆在金纳米粒子表面抵抗血清蛋白吸附干扰, 防止蛋白质诱导的拉曼分析物与金纳米粒子的解离, 提高了血清溶液中miRNAs检测SERS信号的再现性。 疾病早期核酸标志物丰度低, 单模检测容易出现漏诊或误诊。 各种光学和电学生物传感器与信号放大策略耦合来检测核酸已成为这一问题的潜在解决方案。 多模式核酸检测基于两种及以上不同的检测技术, 能够减小SERS衬底不均匀引起信号波动的影响, 提供多样化的检测路径, 检测结果相互印证, 提高检测的准确性和可靠性。 Ma等[51]提出了一种基于双SERS模式并结合微流控技术的miRNAs检测新方法。 如图2(a, b, c)所示, 该研究采用多孔阳极氧化铝包覆Au纳米颗粒作为双特异性核酸酶(DSN)辅助目标循环扩增的反应器和灵敏检测miRNA的初级检测器。 通过降低一次检测器的SERS信号和增加二次检测器的信号来保证准确性, 即双SERS检测策略。 微流控-双SERS检测策略可以极大降低单一检测模式下的假阳性或假阴性的可能, 通过集成不同探针同时检测生理液体中的多种miRNAs。 电化学分析是一种简易且响应快速的分析方法, 监测来自整个电极而不是微观区域的电化学信号, 具有更好的稳定性。 SERS与电化学结合的双模生物传感器, 可以提高检测结果的可靠性。 Zhai等[52]提出了一种新型原位的SERS/电化学双模生物传感器, 用于检测人血清中胃癌相关基因miRNA-106a。 该传感器对区分miRNA-106a和单碱基错配核酸有良好的选择性, 具有SERS和电化学传感模式的线性校准曲线, 检出限分别为67.44和248.01 fmol· L-1。 Song等[53]设计了一种耦合CHA信号放大策略的SPR/SERS双模等离子体生物传感器。 靶标miRNA-652存在时, 4-巯基苯甲酸(4-MBA)标记的探针2与6-羧基x罗丹明(ROX)标记的发卡DNA H2结合, 触发探针2与探针1形成网络结构, 致使暗场显微镜(DFM)图像的颜色变化和增强的SERS效果。 通过提取DFM图像中暗场颜色的积分光密度实现SPR传感, 通过ROX和内标4-MBA分子的比值SERS信号实现miRNA传感。 人血清中miRNA检测验证SPR和SERS均具有良好的线性校准曲线, 检出限低至42.5和2.91 fmol· L-1。 多模式分析可以一定程度上提高结果的可靠性, 但不同检测技术的检测结果可能存在差异, 需要设置合理的误差标准。 同时, 基于不同技术和原理的生物标志物的分析依赖于对不同的仪器进行操作, 目前同一样品的原位同步多模式分析仍需探索。
 | 图2 基于微流控的双SERS检测平台示意图[51] (a): 微流控SERS生物传感器制备; (b): 4-MBA编码核壳SERS标签制备过程及在AAO/Au阵列上的固定化过程; (c): 基于miRNA-21的AAO/Au和AAO/Au@Ag阵列结合DSN辅助靶循环扩增策略的拉曼光谱测量Fig.2 Schematic diagram of double SERS detection platform based on microfluidic[51] (a): Preparation of microfluidie SERS biosensor (the right inst shows the multilayer structure of chip from bottom to top); (b): The preparation process of 4-MBA encoded cor-shell SERS nanotags and the immobilization process of SERS nanotags on AAO/Au array; (c): Raman measurements of miRNA-21 besed AAO/Au and AAO/Au@Ag array |
快速检测一直是核酸检测的重要需求。 试纸条法是快速检测生理液体中靶标含量的常用方法。 Li等[54]将SERS与侧流层析(LFA)试纸条结合, 可在1小时内实现对血清中双喉鳞状细胞癌相关基因miRNA-106b和miRNA-196b的超灵敏、 选择性和可靠测定。 Mao等[55]将SERS-LFA试纸条与CHA信号放大策略相结合, 仅30 min就实现了非小细胞肺癌患者尿液中miRNA-21和miRNA-196a-5p的检测。 该试纸条对靶标miRNAs表现出高特异性和良好的重复性, 为即时诊断提供了方案。
近年来, 人工智能同检测技术的结合为快速检测打开了新世界。 Lin等[56]首次使用超疏水平台和深度学习(DL)算法的无标签血清SERS检测系统, 用于乳腺癌、 乙肝病毒、 白血病患者和正常志愿者血清的高通量筛查。 该系统以铝平板为支撑平台, 采用超疏水槽防止咖啡环效应, 避免了血液和SERS热点不均匀分布导致的SERS信号波动。 首先将滴在超疏水平台上的浓缩血清, 与凹槽中心金纳米颗粒结合, 通过自动高通量拉曼光谱仪获得SERS数据。 然后, 用DL算法来探索血清诊断信息和分类不同的血清样本。 超疏水系统与移动平台上的拉曼光谱仪结合, 实现了快速、 智能的样品检测。 使用正常组(n=183)和患者组(n=443)的血清SERS信号来评估DL模型, 对它们进行分类的准确率最高为100%。 当SERS与DL相结合时, 其对外支撑测试集的诊断准确率为98.6%。 该方法是一种很有前景的高通量、 快速、 无标签的疾病筛查工具, 为大规模样本分析指明方向。
由于外泌体生物膜可以保护miRNAs免受体液中细胞RNA核酸酶的降解, 外泌体miRNAs已成为癌症早期诊断和预后理想的非侵入性生物标志物来源。 但是外泌体中组成复杂, miRNAs的含量低, 又受到生物膜的保护, 通常需要经过复杂的离心纯化过程, 给miRNAs的检测带来不便。
Zhao等[57]提出了一种在线检测外泌体miRNAs的方法, 极大简化了操作过程。 如图3(a)所示, 该工作利用微流控平台将外泌体的富集、 在线裂解和miRNA检测集成在一个系统中, 通过外泌体裂解释放的miRNA激活捕获探针, 触发RCA反应, 产生大量长单链DNA, 驱动辣根过氧化物酶催化酪胺修饰纳米标签沉积产生“ 热点” , 实现级联信号放大。 该方法避免了如超离心、 超滤等繁琐的工作流程, 减少了样品消耗, 提高了定量精度。 Jiang等[58]采用一种外泌体miRNA的原位检测途径, 无需裂解外泌体。 如图3(b)所示, 锁核酸修饰的Au @DTNB进入外泌体与目标miRNA组装以诱导形成“ 热点” , 产生SERS信号。 添加Fe3O4@TiO2纳米颗粒, 通过TiO2和生物膜的亲和相互作用富集外泌体, 经磁吸作用实现外泌体分离。 基于该平台, 可以直接原位鉴定目标miRNA, 检出限为0.21 fmol· L-1。 该方法能从正常对照中识别出胰腺导管腺癌患者, 其准确率为99.6%。
肿瘤相关miRNAs表达水平的改变与肿瘤负荷和恶性进展有关。 细胞中的miRNAs可以提供更全面的信息, 包括数量、 位置、 调控网络和动态变化。 因此, 细胞内miRNAs的监测和检测对于早期癌症发现和医学诊断尤为重要。 Sun等[59]首次将SERS探针与针灸相结合, 用于无创检测和监测活细胞和体内脑脊液中的miRNA-21-5p。 Ma等[60]建立了一种基于互反信号放大(RSA)探针的SERS-微流控方法。 通过RSA探针的特殊设计, 将信号绝对值求和, 提高分析精度, 减少空白值; 同时引入目标触发的自组装DNA酶循环反应, 增强了两类SERS信号的变化, 提高检测灵敏度。 利用微流控技术, 高效混合和富集提高了DNA酶自组装循环反应的速率, 提高了响应值。 微流控的引入避免了复杂耗时的程序, 提高了检测的灵敏性和特异性, 为生物分子芯片的检测和研究开辟了新途径。
细胞中miRNAs的检测能够反映出一定数量细胞中miRNAs表达的整体水平, 但是对于单个细胞中miRNAs的含量和并不能精确评估。 基于单细胞成像技术的miRNAs检测对疾病的诊断和预后提供了思路。 Cao等[61]利用金纳米笼(GNC)SERS探针实现了骨髓间充质干细胞(BMSC)分化中成骨生物标志物(miRNA-144-3p)的长期监测和成像。 成骨诱导剂处理BMSC使其分化为骨细胞过程中, 仅在经历成骨分化和未分化的BMSC中观察到miRNA-144-3p强烈且随时间变化的SERS反应, 成骨细胞中则没有。 SERS成像对于细胞间异质性的研究有重要意义。 荧光分子成像技术是观察细胞内基因表达的一般策略。 近年来, SERS与荧光双模式检测平台用于细胞内miRNAs的测定和示踪已成为研究的热点。 Lv等[62]通过荧光和拉曼多通道成像进行亚细胞分析, 获得了细胞膜粘蛋白(MUC1)、 细胞内miRNA-21和细胞内活性氧(ROX)的表达谱, 实现了活细胞中多种癌症生物标志物的共成像。 Zhang等[63]设计了一种荧光-SERS双信号智能比率探针(BSR)用于细胞内miRNA定量分析。 如图4(a)所示, 荧光-SERS互补成像, 通过SERS反向信号比响应和无酶信号放大, 实现了信号放大与降低黑值, 获得了更精确的成像对比。 该方法成功用于准确追踪和定量MCF-7细胞中的miRNA-203, 实现了对探针的动态实时监测和对miRNA的精确成像。 Wang等[64]将SERS-荧光双模动态监测策略且与光动力疗法相结合, 构建了一种新型双模式诊断纳米系统(DTN)。 激活后该系统能够对肿瘤进行原位荧光成像和目标的SERS绝对定量。 在荧光成像指导下, 可利用核心-卫星结构和MnO2纳米片负载的光敏剂卟啉进行协同光疗, 如图4(b)所示。 小鼠的体内和体外实验结果验证了该策略的可行性, 为肿瘤SERS-荧光双模式诊断和有效的肿瘤治疗提供了新思路。 Liu等[65]研制了一种SERS和荧光的双模DNA机器探针的新型多功能系统。 通过miRNA-21触发的细胞内ATP加速循环反应, 通过DNA结构开关交替使用荧光和SERS信号, 实现了负载在DNA中CG碱基对上两种抗癌药物(anti-miRNA-21和Dox)定向按需释放和miRNA的精确SERS检测和荧光成像, 为诊疗一体化平台的构建提供了新方案。
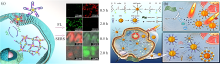 | 图4 (a)基于BSR探针对细胞中miRNA进行双模式成像和反向信号比定量的原理图[63]; (b)DTN纳米系统应用于细胞内miRNA双模式监测和协同光疗[64]Fig.4 (a)Schematic of dual-mode imaging and reverse signal ratio quantification of miRNAs in cells based on BSR probes[63]; (b)DTN nanoparticles are used for dual mode monitoring of intracellular miRNA and collaborative phototherapy[64] |
SERS技术以其独特的光谱特性和高灵敏度、 高分辨率等优点, 在miRNA检测中发挥出巨大优势。 随着灵敏度的提高, 传感器的可靠性可能会被牺牲。 极高的灵敏度意味着非常容易受到来自污染物或复杂样品中其他分析物的高背景光谱信号的影响, 给SERS检测的实际应用带来困扰。 使用多种传感器检测同一目标分析物, 协调各自的优势和弥补彼此的不足, 是实现准确可靠检测的一条有效途径。 用于实际检验的样本通常成分复杂, 分离提纯过程繁琐, 无形中增加了检测时间。 原位检测方法和一体化集成模式可节约时间, 为大规模检测提供支持。 目前, SERS技术的检测平台不仅能够同时检测多种miRNAs, 实现血清和细胞裂解液等生物样品中miRNAs的定量检测, 更发展了原位检测的方法测定外泌体和细胞中的miRNAs。 随着研究的不断深入, 基于SERS技术的miRNAs诊疗一体化平台也被开发出来, 有望实现疾病相关miRNAs的检测成像与疾病治疗的同步进行。 SERS技术在miRNAs检测方面的应用总结如表1所示, SERS技术在多种miRNAs的同时定量分析、 多光谱技术的联合检测、 即时检测、 在线检测等方面仍具有很大的研究潜力。 要实现这些构想, 还有一些问题亟待解决。 一是用于快速现场检测便携式拉曼光谱仪虽具有轻便、 采样方式灵活等特点, 但光谱范围小, 分辨率也有待提高。 二是多技术联用融合效果因设计和集成程度不同而有较大差异, 有待进一步优化。
| 表1 SERS传感器用于miRNAs检测的研究 Table 1 Research of SERS sensors used for miRNAs detection |
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|