作者简介: 李昱珩,女, 1998年生,西北大学文化遗产学院及联合实验室、重点实验室硕士研究生e-mail: 202020528@stumail.nwu.edu.cn
皮胶、 蛋类和奶类作为彩绘文物中常见的胶结材料, 在我国古代存在混合使用的工艺。 为探究这类混合胶料体系内部各组分的相互作用与其在光热老化条件下的稳定性, 深入了解彩绘文物的劣化机理, 使用扫描电子显微镜、 傅里叶红外光谱仪以及热重-差示扫描量热仪等分析方法, 对鸡蛋-皮胶、 牛奶-皮胶与牛奶-鸡蛋三种混合胶料的稳定性与蛋白质二级结构进行了表征。 结果表明, 以上胶料经过混合后, 热稳定性与光稳定性相较单一胶料均显著升高。 红外光谱显示, 样品经过老化之后谱峰加宽, 波数范围位于1 600~1 700 cm-1之间的蛋白质特征谱带酰胺Ⅰ带向低波数方向移动。 酰胺Ⅰ带高斯拟合结果显示, 随着混合比例的变化, 混合胶料中有序结构的含量呈现出先升后降的趋势, 在有序结构含量最高的样品中, 无规卷曲结构含量也达到较低的水平。 同时, 鸡蛋-皮胶的混合比例介于1∶1~1∶2之间时, 有序结构的含量高于任意单一胶料, 最高可达64.87%, 其稳定性最强。 经过老化的胶料蛋白质二级结构含量均发生变化, 有序的α-螺旋结构整体呈现下降趋势, 无规卷曲结构则明显上升, 而几种混合胶料α-螺旋结构的含量依旧高于单一胶料, 可见混合胶料具有更强的稳定性。 热重分析结果同样表明, 老化前后混合胶料的热稳定性均高于单一胶料, 推测是因为混合体系中蛋白质与蛋类、 奶类中的脂质相结合, 蛋白质与脂质的相互作用进一步促进了蛋白质结构稳定性的提升。 本研究从稳定性的角度分析了彩绘文物中的混合胶料, 为研究古代胶料的老化机理和保护方法提供了参考。
Animal glue, eggs, and milk were often mixed in ancient China as cementitious materials in painted cultural relics. To explore the interaction of mixed binders and the stability under light aging conditions, to understand the deterioration mechanism of polychrome relics, the stability and protein secondary structure of egg-animal glue, milk-animal glue, and milk-egg mixed binders were characterized by Scanning electron microscopy, FTIR and TG analysis. The results showed that after mixing, the above binders’ thermal stability and light stability were significantly increased. The infrared spectrum results show that spectral peak broadening after aging of the sample, and the amide Ⅰband of the protein characteristic spectrum with a wavenumber range between 1 600~1 700 cm-1 shifts towards the wavenumber direction. The Gaussian fitting results of the amide Ⅰband show that with the change of mixing ratio, the content of ordered structure in the mixed binders shows a trend of first increasing and then decreasing. In the samples with the highest ordered structure content, the random curl structure content also reaches a lower level. At the same time, when the mixing ratio of egg and animal glue is between 1∶1 and 1∶2, the content of the ordered structure is higher than any single binders, with a maximum content of 64.87%, indicating its strongest stability. The content of the secondary structure of protein in the aged binders has changed. The α-helix structure shows a downward trend, while the random curl structure shows a significant increase. The α-helix structure in several mixed binders is still higher than that of a single binder material, indicating that the mixed binders have a certain degree of stability. The results of Thermogravimetric analysis also showed that the thermal stability of the mixed binders before and after aging was higher than that of the single binders, presumably because the protein in the mixed system combined with the lipid in eggs and milk and the interaction between protein and lipid further promoted the stretching and rearrangement of protein molecular structure, which improved the stability. From the stability perspective, the reason for the mixed-use of adhesive materials in painted cultural relics was explained, providing a reference for studying ancient adhesive materials’ aging mechanism and protection methods.
彩绘文物反映着古代社会手工业的发展, 通常具有极高的价值, 是考古研究的珍贵佐证。 文物的彩绘层一般由颜料与胶粘剂共同构成, 蛋白胶料就是以蛋白质为主要成分的一类胶粘剂。 以皮胶、 骨胶和蛋清等为代表的蛋白胶料在古代壁画、 建筑彩画和彩绘陶器中的应用十分普遍, 作为文物中最常见的一类胶结物质, 这些天然蛋白胶料在我国已有至少3 500多年的应用史, 同时目前国内外对于彩绘文物的研究证明, 混合使用两种或两种以上蛋白类胶料的工艺也很常见。 例如19世纪特兰西瓦尼亚的玻璃画被鉴别出蛋类、 动物胶、 牛奶与亚麻籽油等材料的使用[1]; 玻利维亚圣母玛利亚教堂的壁画被确认使用了动物胶打底, 蛋类和亚麻籽油混合调制颜料的工艺[2]; 秦兵马俑的彩绘中同样存在蛋类与动物胶的混合胶料[3], 颐和园建筑彩画中使用的胶结材料也为动物胶与蛋类的混合物[4]。
作为一种有机成分, 蛋白质胶料在面临长期埋藏和出土后暴露于大气环境等情况时易发生老化降解, 这是诱发彩绘文物病害的重要原因。 因此, 研究彩绘文物蛋白胶料的老化机理, 对彩绘文物的保护修复具有重要意义。 目前关于文物蛋白胶料的研究大多只关注单一胶料的老化, 或颜料中金属离子对蛋白质的影响, 在混合胶料工艺的基础之上对有机组分内部的相互作用则少有研究。 Lluveras-Tenorio等对中世纪蛋彩画颜料中亚麻籽油、 蛋清和乳香树脂的混合物进行了分析, 并提出蛋白质与油脂发生共聚、 影响蛋白质鉴定的假设[5], 其他研究领域也有学者提出牛奶中乳清蛋白与脂质或发生光氧化加和。 就总体而言, 尚未能系统且深入地考虑到文物中多种蛋白胶料混合的影响。 本文使用扫描电子显微镜、 红外光谱以及热重分析等方法, 对我国彩绘文物中几种常见混合胶料的稳定性进行了表征, 并对其作用机理进行初步阐释, 为彩绘文物的修复与保护提供一定参考。
按照《齐民要术》记载工艺熬制猪皮胶, 根据壁画制作传统工艺, 配制9%胶液, 涂刷于载玻片上自然风干后得到样品A0; 将鸡蛋(市售)搅拌均匀后利用纱布过滤, 配制30%胶液, 涂刷于载玻片上自然风干后得到样品E0; 将纯牛奶(市售)自然风干后得到样品M0。
将9%皮胶、 30%鸡蛋胶以牛奶, 分别按照1∶4、 1∶2、 1∶1的比例两两混合, 避光条件下自然风干后, 得到混合胶料样品, 鸡蛋-皮胶、 牛奶-皮胶、 牛奶-鸡蛋分别为EA、 MA、 ME。 将以上样品置于紫外灯下老化(辐照强度225 W·m-2, 老化时间720 h), 得到老化组样品。
扫描电镜分析使用FEI公司生产的Quanta FEG 450型场发射环境扫描电子显微镜, 模式采用SE模式, 电压20 kV, 束斑直径为4.0。 使用导电胶将将样品固定在靶台上, 喷金100 s后观察。
红外光谱分析使用德国Bruker公司生产的LUMOS傅里叶红外光谱仪。 扫描次数为64次, 扫描范围为4 000~500 cm-1, 分辨率为4 cm-1。
热重分析使用METTLER TOLEDO热重-差示扫描量热仪, 吹扫气和保护气为N2, 吹扫流量50 mL·min-1, 升温速率10 ℃·min-1, 从室温升至650 ℃。
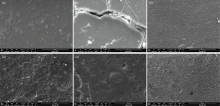
使用扫描电镜分别对老化前后样品进行观察, 在图1(a—f)中可以看到, 样品A0表面相对致密, 无孔隙, 褶皱状纹理分布较为分散。 样品E0表面平整, 能够观察到断面的凝胶网状结构。 样品M0表面分布有大量的颗粒结构, 是牛奶中的乳脂肪球。 经过混合之后, 样品EA的表面呈现粗糙的褶皱状, 纹理遍布整个表面, 并且有转变为边缘规则的圆片状凸起的趋势。 样品MA表面存在少量的褶皱状纹理, 部分褶皱聚集成团簇, 随机分布于表面。 样品ME更加接近M0的形貌, 表面可隐约看到脂肪球的结构, 线条状凸起的纹理将颗粒结构连成一体。
图1(EA, MA, ME)三种混合样品已经难以看出混合之前各自的形貌特征, 甚至表现为全新的形貌, 说明混合胶料体系中的两种胶结材料之间产生了相互作用, 而并非仅发生混合分散。 鸡蛋与牛奶分别含有疏水性较强的卵磷脂与甘油三酯, 混合导致体系中的油相与水相相作用, 形成了样品ME表面的颗粒结构。 皮胶的主要成分则为胶原蛋白, 蛋白质是表面活性剂的一种, 研究证明, 胶原蛋白具有一定的乳化性, 并且随着浓度上升乳化性与乳化稳定性逐渐增强, 因此在混合体系中能够起到乳化剂的作用, 使混合胶液中原本互不相溶的组分形成较为稳定的乳状液, 产生样品EA、 MA中非均相系统形貌。 吸附理论认为胶水的黏性来源于界面间的分子内聚力[6], 而混合胶料这种粗糙的褶皱状表面, 由于具有更大的比表面积和三维空间结构, 因此结合位点更多, 粘附性更强。
使用红外光谱对紫外老化前后的胶料样品进行观察, 结果如图2(a—f)所示, 样品的特征峰集中在1 000~3 500 cm-1之间, 主要吸收峰位于1 163、 1 647、 2 925以及3 422 cm-1附近。 对比标准谱库可知, 3 422与2 925 cm-1处分别表征N—H伸缩振动以及—CH2—的不对称伸缩振动, 形成蛋白类物质特有的酰胺A带与酰胺B带。 1 600~1 700 cm-1之间表征羧基中—C=O—的伸缩振动, 形成特征吸收谱带酰胺Ⅰ带。 1 150~1 350 cm-1为N—H弯曲振动与C—N伸缩振动峰, 形成蛋白质特征吸收带酰胺Ⅲ 带[7]。 而1 744 cm-1附近较强的尖峰则代表脂羰基中C=O伸缩振动, 是脂肪的特征吸收峰[8]。 经过紫外老化之后, 酰胺A带与酰胺Ⅰ带变化最为显著, 特征峰的强度降低、 吸收频率向低波数方向移动, 且谱峰加宽, 说明紫外光照射破坏了分子间氢键, 导致蛋白质二级结构发生变化。
 | 图2 蛋白胶料红外光谱结果 (a): A0; (b): E0; (c): M0; (d): EA; (e): MA; (f): MEFig.2 The IR spectra of proteinaceous binders (a): A0; (b): E0; (c): M0; (d): EA; (e): MA; (f): ME |
酰胺Ⅰ带代表酰胺羰基沿多肽骨架的振动[9], 较酰胺A带、 酰胺B带以及酰胺Ⅲ 带对蛋白质二级结构的变化更加敏感[10], 在解析构象归属方面的研究也已较为成熟。 为表征混合胶料的光稳定性, 对各样品红外光谱图中酰胺Ⅰ带进行拟合, 并对二级结构归属进行划分, 1 610~1 637 cm-1表征β -折叠结构, 1 637~1 645 cm-1为无规则卷曲, 1 645~1 660 cm-1为α-螺旋结构, 1 660~1 715 cm-1对应β -转角结构[11], 各样品二级结构含量见表1。 对比老化前后蛋白质二级结构的相对含量可发现, 各样品中α-螺旋结构含量显著降低、 β -转角结构上升, 并且无规卷曲结构普遍降低, 说明经过紫外光照射后胶料中蛋白质发生氧化变性, 肽链内以及肽链之间的氢键断裂, 原本有序的螺旋结构发生解旋转变为无规卷曲, 或通过再折叠向β 结构转变。 观察混合胶料的结果发现, 胶料的混合使有序结构α-螺旋与β -折叠的含量上升。 在单一胶料中, 样品A0的有序结构为58%, E0中的有序结构占55%左右, M0中有序结构含量为34%。 而在经过混合后, 鸡蛋-皮胶类混合胶料中的有序结构总含量升高至60%左右, 样品EA(1∶1)最高, 有序结构占比64.87%, 其次为样品EA(1∶2), 含有63.12%; 牛奶-皮胶类样品中有序结构含量介于50%~59%之间, 牛奶-鸡蛋类样品中有序结构的含量约为40%~56%。 随着混合比例的改变, 有序结构的含量呈现出先升后降的趋势, 在有序结构含量最高的样品中, 无规卷曲结构含量也达到较低的水平。 因此认为, 以上三种混合胶料存在最适混合比例, 促进肽链之间形成氢键, 进而使蛋白质二级结构的稳定性达到最优。
| 表1 蛋白胶料红外光谱酰胺Ⅰ带拟合结果 Table 1 Results of fitting the amide Ⅰregion of FTIR spectra of proteinaceous binders |
蛋白质是几种胶料样品中最主要的干物质成分, 皮胶中含有大量的的胶原蛋白, 鸡蛋以卵清蛋白、 卵黄高磷蛋白等为主[12], 牛奶中的蛋白质以酪蛋白等乳蛋白为主[13], 蛋类与奶类中也含有较大占比的脂质。 有研究证明, 在自然条件下, 蛋白质与脂质可以通过氢键、 共价键、 疏水作用以及静电作用发生结合[14], 胶料的氧化会导致混合胶料体系中蛋白质羰基含量上升, 而鸡蛋中的卵磷脂含有C18、 C18∶1等丰富不饱和脂肪酸[15], 氧化断裂后自由基的产生, 会进一步促进蛋白质的氧化修饰[16], 因此混合胶料二级结构的含量发生了变化。 Mestdagh等也指出, 油脂在蛋白质的交联中起到了催化的作用, 即使在常温避光的条件下, 该混合体系中蛋白质的构象依旧会发生变化[17]。 对比单一胶料与混合胶料二级结构含量, 发现经过老化之后混合胶料有序结构的含量仍基本高于单一胶料, 是由于静电作用等因素导致脂肪与蛋白质的亲脂性区域发生了相互作用[18], 形成脂质-蛋白质大分子, 进而导致蛋白质内结构伸展重排[19], 进一步使蛋白质的结构更加稳定。
胶料样品的热重曲线与微分热重曲线如图3(a—f)所示。 与A0、 E0、 M0的微分热重曲线对比, 三种混合胶料的峰形基本相似, 但峰数与失重温度发生显著变化。 样品EA热降解过程出现两次明显的失重, MA与ME均有三次明显失重, 且不同样品的失重率存在差异。 由图3可知, 100 ℃以下为样品中水分的挥发, 样品含水率为5%左右, 失水速率在65 ℃附近达到最大, 经过拐点之后, 随着失重速率降低曲线趋于平缓, 分别在200与285 ℃附近再次出现拐点。 200 ℃以上为牛奶中糖类的分解, 生成乳酸和少量甲酸, 285 ℃之后则发生蛋白质与脂质的裂解碳化[20]。 蛋白质热裂解速率在330 ℃附近达到最大, 之后失重速率开始降低, 直至400 ℃附近出现拐点, 热裂解反应终止, 样品质量趋于稳定, 总失重达到80%左右。 蛋白胶料样品的失重率及热转变参数如表2所示, θ1代表蛋白质热裂解发生的起始温度, 用于表征样品热稳定性, θ2表示最大降解吸热温度, θ3表示反应终止温度。 发现老化前后混合胶料的失重峰温度均得到提升, 说明混合胶料的热稳定性高于单一胶料。 M0样品的θ1显著高于E0与A0, 但加入牛奶的两种混合胶料, 其θ1反而低于皮胶-鸡蛋混合胶料, 可见添加牛奶的效果相对较差。 混合胶料热裂解反应机理未发生显著变化, 但热稳定性有所提高。
| 表2 蛋白胶料热转变参数和热降解的质量损失百分比 Table 2 Thermal transition parameters and percentage mass loss of thermal degradation steps of protein binders |
利用扫描电镜、 红外光谱以及热重分析的方法, 对我国古代彩绘文物中几种常见蛋白胶料混合样品的稳定性进行了表征, 发现混合胶料体系内存在相互作用使其表面形貌转变为粗糙的状态, 同时也使胶料蛋白质的二级结构稳定性得到提升。 在光老化的条件下, 胶料的有序结构含量普遍降低, 但混合胶料中有序结构的含量依旧高于单一胶料, 热重分析同样表明, 皮胶、 鸡蛋与牛奶三者中任意两者经过混合之后的热稳定性均提高, 其中皮胶与鸡蛋的混合比例介于1∶1与1∶2之间时, 性能达到最优。 实验认为, 混合胶料稳定性的提高, 是由于混合体系中蛋白质与脂质间相互作用, 蛋白质结构的改变使胶料的热稳定性与光稳定性得到提升。 从传统胶料性能的方面解释了将两种或以上蛋白类胶料混合使用的原因, 为彩绘文物的保护与原工艺修复提供了参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|