作者简介: 杨 瑞, 2000年生, 河北科技大学环境科学与工程学院硕士研究生 e-mail: yr849481104@163.com
为了提升藻叶绿素荧光对痕量三嗪类除草剂的检测效果, 以蛋白核小球藻、 铜绿微囊藻和斜生四链藻为试验藻种, 通过水样叶绿素荧光仪(WATER-PAM-WALZ)测量四个藻叶绿素荧光动力学参数 Fv/Fm、 Y(Ⅱ)、 NPQ和 qP作为毒性评价指标, 研究微藻对阿特拉津、 扑草净与特丁通三种三嗪类除草剂毒性的响应时间和甲乙基化植物油对藻荧光法检测除草剂生物毒性的增敏效果。 实验结果显示: ①蛋白核小球藻、 铜绿微囊藻和斜生四链藻对三种除草剂的生物毒性最佳响应时间分别为20、 10和10 min; 增敏效果最显著时甲乙基化植物油浓度分别为0.25%、 0.5%和0.25%。 ②斜生四链藻对三种除草剂的响应敏感性最高, 而铜绿微囊藻对除草剂的适应性和抗性较强, 在20 μg·L-1的扑草净暴露下, 实验组斜生四链藻和蛋白核小球藻的 Fv/Fm抑制率均达到23%, 而铜绿微囊藻 Fv/Fm抑制率只达到8%。 ③甲乙基化植物油的作用下, Y(Ⅱ)和NPQ对除草剂的毒性响应灵敏度最高。 40 μg·L-1的扑草净对斜生四链藻Y(Ⅱ)抑制效果达到了56%, 对 Fv/Fm抑制率最高达到41%, 是对照组的2.5倍, 而除草剂浓度至200 μg·L-1时, 三种藻类NPQ值均提升了1.5倍以上, 参数值 qP的响应程度受甲乙基化植物油的增敏效果较小。 实验结果表明甲乙基化植物油扩大了除草剂与藻细胞的接触面积, 增强了除草剂的渗透力, 提升了藻荧光对除草剂的毒性响应, 可降低除草剂的检出限值。 研究中首次将甲乙基化植物油应用于藻荧光法检测三嗪类除草剂中, 并且在甲乙基化植物油的作用下, 藻荧光法表现出良好的检测效果, 解决了某些情况下叶绿素参数响应不灵敏的问题, 为快速、 灵敏地检测环境中的痕量三嗪类除草剂的生物毒性提供了一种新的方法。
In order to improve the sensitivity of the algal chlorophyll fluorescence method for the detection of trace herbicides, the optimal response time of microalgae to the toxicity of three triazine herbicides (Atrazine, Prometryn and Terbumeton) was investigated, as well as the sensitization effect of methyl-ethyl vegetableoil on the biological toxicity of herbicidesdetected by algal fluorescence method were further studied. In addition, four chlorophyll fluorescence kinetic parameters of Fv/Fm, Y(Ⅱ), NPQ and qP were measured by WATER-PAM-WALZ as the toxicity evaluation index, and Chlorella proteinacea, Microcystis aeruginosa and Scenedesmus obliquus were adopted as the test algae. Therefore, the results were as follows: ①The optimal biotoxic response times of Chlorella proteinosa, Microcystis aeruginosa, and Scenedesmus obliquus were to the three herbicides 20, 10 and 10 min, respectively. Moreover, the most effective concentrations of methyl-ethyl vegetable oil were 0.25%, 0.5% and 0.25%, respectively. ② Scenedesmus obliquus had the highest sensitivity to the three herbicides, while Microcystis aeruginosa was more adaptable and resistant to herbicides. Under 20 μg·L-1 Prometryn exposure, the Fv/Fm inhibition rates of both Scenedesmus obliquus and Chlorella proteinosa were up to 23%, while that of Microcystis aeruginosa only reached 8%. ③Y(Ⅱ) and NPQ showed the highest sensitivity to herbicide toxicity under the treatment of methyl-ethyl vegetable oil. Besides, the inhibitory effect of 40 μg·L-1 Prometryn on Y(Ⅱ) of Scenedesmus obliquus was 56%, and the inhibition rate of Fv/Fm was up to 41%, which was 2.5 times that of the control group. However, when exposed to 200 μg·L-1 herbicide, the NPQ values of the three algae increased by more than 1.5 times, and the qP was less affected by methyl-ethyl vegetable oil. Hence, the above results demonstrated that the contact area between herbicide and algae cells was enlargedby methyl-ethyl vegetable oil, and the penetration of herbicide was enhanced, which improved the toxic response of algae fluorescence to herbicide as well as reduced the detection limit of herbicide. In this study, we first utilized methyl-ethylated vegetable oil to detect triazine herbicides using the algal fluorescence method. The results demonstrated that the algal fluorescence method exhibited a highly effective detection capability when combined with methyl-ethylated vegetable oil. This approach successfully addressed the issue of insensitive responses observed in chlorophyll parameters in certain cases. As a result, a novel and rapid method for sensitively detecting trace triazine herbicides' biotoxicity in the environment has been established.
三嗪类除草剂是使用最为广泛的除草剂之一[1], 其可以通过迁移、 径流等渠道进入自然水体, 污染水生环境并对人类健康造成损害[2, 3]。 三嗪类除草剂已被证实会对水生生物造成明显的急性毒性, 损伤鱼类等物种的肾脏功能和呼吸系统, 降低孵化率; 还对动物和人类的免疫系统造成损害, 扰乱生殖系统和内分泌系统, 严重危害人体健康[4, 5, 6, 7]。
藻细胞中的叶绿素分子会产生叶绿素荧光, 荧光的变化直接反映出藻进行光合作用时的生理状态[8], 而藻荧光法是通过测量微藻光合活性的变化而快速、 灵敏地检测环境中有害物质的方法。 Schreiber[9]制造了世界首台调制荧光仪PAM-101用来测量浮游藻产生的叶绿素荧光, 在2001年通过ToxY-PAM对叶绿素荧光的参数特性进行测量和分析, 对除草剂敌草隆的检出限达到0.1 μ g· L-1。 近年来, 诸多研究采用藻荧光法作测量除草剂对环境和生物的综合影响: Wang等[10]通过分析三角褐指藻的最大量子产率(Fv/Fm)揭示了阿特拉津与扑草净混合物对光合机制的影响; Daniela等[11]使用PhytoPAM-ED探究了吡氟草胺胁迫下有效量子产率[Y(Ⅱ )]的变化, 发现近头状尖胞藻的光合速率在两周内逐渐恢复, 说明藻类对除草剂毒性具有一定的适应性。 Macedo等[12]以Fv/Fm检测到除草剂苯达松的最低响应浓度为2.81 mg· L-1, 远低于藻生长抑制法测得的浓度22.5 mg· L-1。 荧光参数的种类和意义繁多, 但参数之间的敏感性不同, Roberta等[13]对比了Y(Ⅱ )、 非光化学猝灭系数(NPQ)和基础荧光(F)在重金属胁迫下的响应灵敏度, 发现NPQ是处于急性暴露时反应最快的参数, 因此被确定为最有效的预警参数。 Hu等[8]研究了12种荧光参数对敌草隆的敏感性, 发现5 min内, NPQ比Fv/Fm的响应灵敏度要高80%以上, 这项研究为筛选敏感的荧光参数来检测除草剂提供了基础数据。 除草剂在环境中一直以低浓度存在, 低浓度、 高灵敏性检测一直是除草剂检测方法研究的方向, 相比开发更精密的荧光检测仪器, 进一步提高荧光参数对除草剂毒性的响应灵敏度是一种简便、 快速有效的技术手段。
甲乙基化植物油是一种天然植物提取物, 具有乳化性强、 易在水中分散、 使用安全无污染残留等特点, Wang等[14]曾使用甲基化植物油增效温室草莓中的杀菌剂, 从而减少了农药添加量; 陈奕璇等[15]曾利用植物油Aero-mate 320, 改变了农药的理化性质, 提高了药液的沉积使用率。 研究中首次将甲乙基化植物油应用于藻荧光检测法中可显著提高藻对除草剂的荧光响应, 甲乙基化植物油与水中的除草剂混合后会增强除草剂在藻细胞膜上的渗透性, 同时扩大除草剂与藻细胞之间的接触面积, 使水中的痕量除草剂更容易附着在藻细胞上, 与甲乙基化植物油对除草剂作用于绿色植物细胞时的机理一致[16]。 因此探究甲乙基化植物油对藻荧光法检测除草剂的增敏效果, 从而达到更快速及灵敏地分析除草剂的生物毒性。
本研究以蛋白核小球藻、 斜生四链藻和铜绿微囊藻作为试验藻种, 通过分析Fv/Fm、 Y(Ⅱ )、 光化学猝灭系数(qP)和NPQ四个藻叶绿素荧光参数的变化, 探究甲乙基化植物油对藻叶绿素荧光法检测阿特拉津、 扑草净、 特丁通等三嗪除草剂生物毒性的增敏作用, 开发一种提升藻荧光法检测三嗪类除草剂生物毒性灵敏度的方法应用于水环境的监测。
叶绿素水样荧光仪(WATER-PAM-WALZ)、 光照培养箱(MGC-450BP)、 高压灭菌锅等。
实验室供试藻种: 蛋白核小球藻(FACHB-5)、 铜绿微囊藻(FACHB-315)、 斜生四链藻(FACHB-12)(藻种均购自中国科学院武汉水生生物研究所淡水藻种库)。
培养基: BG-11(青岛海博生物技术有限公司)。
甲乙基化植物油(又称英伏腾, 含量100%, 购买于澳大利亚维多利亚化学品公司, 已商品化)。
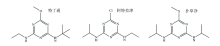
三嗪类除草剂: 特丁通标准品(Terbumeton)纯度为98.5%、 阿特拉津标准品(Atrazine)纯度为98%、 扑草净标准品(Prometryn)纯度为98%(均购自于农业管理部环境生态研究所)三种除草剂结构式具体如图1。
1.3.1 敏感藻的培养与除草剂溶液的配制
藻种复苏后转接在经过高温灭菌的BG-11培养基中, 转接比例为1∶ 5, 转接后微藻初始密度为1× 106cells· mL-1, 微藻置于(25± 1) ℃的光照培养箱中培养。 蛋白核小球藻与斜生四链藻的光照强度为2 000~2 500 Lux, 铜绿微囊藻光照强度为1 200~1 400 Lux, 光暗比例为光: 暗(12 h∶ 12 h)。 每天随机调换培养瓶的位置, 并摇晃培养瓶3~5次, 让其受光均匀并使微藻悬浮, 对数期的藻类繁殖迅速、 对外界污染物敏感, 以下所有实验均选取对数期藻进行。
根据预实验结果, 将阿特拉津、 扑草净、 特丁通三种除草剂的浓度梯度设置为 0、 20、 40、 60、 80、 100、 150、 200 μ g· L-1, 实验组在配制除草剂的同时加入甲乙基植物油。
1.3.2 微藻对除草剂响应时间的确定
由于自身细胞结构和耐受性的不同, 微藻对除草剂毒性的响应时间有明显差异, 为了确定微藻对除草剂的最佳响应时间, 将时间序列设置为0、 2、 5、 10、 20和30 min。 在三种除草剂浓度为100 μ g· L-1时通过水样叶绿素荧光仪(WATER-PAM-WALZ)测量微藻的Fv/Fm, 每个时间均平行测量三次, 取三次测量的Fv/Fm的平均值作图。 Fv/Fm越低代表藻细胞受到除草剂毒性胁迫越强, 从而分析出微藻对不同除草剂毒性的时间依赖效应。
1.3.3 甲乙基化植物油浓度的确定
根据预实验结果, 将甲乙基化植物油的浓度梯度设置为: 0、 0.1%、 0.25%、 0.5%、 0.75%+1%, 将每种除草剂浓度设置为100 μ g· L-1, 分别和不同浓度的甲乙基化植物油混合最佳毒性响应时间, 再经10 min暗处理后, 测定微藻的Fv/Fm, 从而确定Fv/Fm抑制率最大时的甲乙基化植物油的浓度, 将其作为检测除草剂和分析除草剂生物毒性的最佳浓度。 实验中每个藻样设置三组平行实验, 并计算三次测量的平均值进行分析。
1.3.4 叶绿素荧光动力学参数的测量
水样叶绿素荧光仪(WATER-PAM-WALZ)可快速而灵敏地评估微藻的光合活性, 实验选取的Fv/Fm、 Y(Ⅱ )、 qP、 NPQ四个荧光动力学参数可直接由水样叶绿素荧光仪测量。 微藻的PSⅡ 光合速率由Fv/Fm与Y(Ⅱ )反映, Fv/Fm与Y(Ⅱ )是评价微藻光系统受到胁迫时最常用的指标[17]。 qP表示PSⅡ 中处于开放状态的反应中心的比例, NPQ是光系统里由热耗散引发, 作为光能过剩的高效探针, NPQ的升高代表色素分子无法完全利用吸收到的光能, 即色素发生损伤[18]。 测量前, 每种微藻均与除草剂混合至毒性最佳响应时间, 以便精确地分析除草剂对光合机制造成的实际影响, 测量开始前使藻样经过10 min的暗适应; 在加入甲乙基化植物油的条件下重复上述实验, 每组藻样设置三组平行实验。
1.3.5 叶绿素荧光动力学参数抑制率的计算
采用抑制率来分析荧光参数Fv/Fm、 Y(Ⅱ )、 qP和NPQ对除草剂的毒性响应规律, 计算公式如式(1), 但藻类受到胁迫时NPQ往往会上升, 因此在计算NPQ的抑制率时, 实验组和对照组的顺序相反。
式(1)中, X0为对照组的叶绿素荧光参数; Xi为实验组的叶绿素荧光参数。
由图2(a)表示, 蛋白核小球藻对阿特拉津和扑草净的毒性响应时间曲线变化趋势一致, Fv/Fm在10 min内显著降低, 而后趋于稳定, 而在扑草净胁迫下, 20 min时Fv/Fm降至最低, 故除草剂和蛋白核小球藻混合20 min时是分析除草剂生物毒性的最佳时间。 图2(b)表示, 扑草净和特丁通暴露下, 10 min时铜绿微囊藻Fv/Fm值达到最低, 在20和30 min时, Fv/Fm值有微小提升, 说明随着除草剂作用时间的延长, 铜绿微囊藻有一定的适应性, 而阿特拉津对铜绿微囊藻抑制最大时为20 min时, 但与10 min暴露下相比差异较小, 故铜绿微囊藻暴露在除草剂的最佳时间为10 min。 由图2(c)可知, 除草剂胁迫下, 斜生四链藻的Fv/Fm值在0~10 min呈现显著下降, 10 min时到达最低后趋于平稳, 说明在除草剂暴露时间达到10 min时对斜生四链藻光合系统损伤最显著。
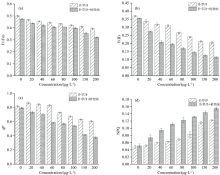
甲乙基化植物油的浓度大小对微藻检测除草剂时的增敏效果有关键影响, 浓度过高或过低时增敏效果达不到预期效果, 且易导致成本浪费。 由图3(a)所示, 特丁通和扑草净暴露下, 蛋白核小球藻Fv/Fm在甲乙基化植物油浓度为0.25%时下降至最低, 而阿特拉津胁迫下, Fv/Fm值在浓度为0.5%时最低, 但与浓度为0.25%时差异不大, 说明此时甲乙基化植物油可以与除草剂充分混合并使其附着细胞膜和渗透进藻细胞的能力达到最大, 考虑到检测效果和实际应用情况, 采用蛋白核小球藻检测除草剂时甲乙基化植物油的浓度为0.25%最适。 由图3(b)和(c)可, 甲乙基化植物油浓度为0.5%时, 铜绿微囊藻响应灵敏度最高, 而斜生四链藻检测三种除草剂时甲乙基化植物油的浓度为0.25%时效果最显著。
2.3.1 甲乙基化植物油对蛋白核小球藻检测阿特拉津生物毒性的增敏效果
通过水样叶绿素荧光仪测量得到在不同浓度除草剂胁迫下对照组和实验组四个荧光参数的变化, 如图4, 阿特拉津胁迫下实验组与对照组蛋白核小球藻的荧光参数值Fv/Fm、 Y(Ⅱ )、 qP均下降, 而NPQ值明显增加(p< 0.05), 说明蛋白核小球藻的光合系统和光合色素均受到不同程度的损伤。 阿特拉津在浓度20~80 μ g· L-1时, 对照组小球藻的Fv/Fm值没有随着浓度增大而明显降低, 但实验组中Fv/Fm的抑制率最高达到了34%, Georgi等[19]使用PAM-101/103荧光计测量蛋白核小球藻对1 mg· L-1的阿特拉津的毒性响应, Fv/Fm的抑制率只达到了25%, 低于甲乙基植物油条件下蛋白核小球藻Fv/Fm的抑制率。 Y(Ⅱ )和qP在低浓度阿特拉津暴露下就表现出显著的抑制作用, 40 μ g· L-1时, 实验组Y(Ⅱ )的抑制率就达到47%, 而qP抑制率是对照组的1.5倍, 由于甲基化植物油增强了游离除草剂的附着能力, 对以Y(Ⅱ )和qP作为指标检测低浓度的阿特拉津有显著的增效作用。 20~40 μ g· L-1时, 对照组的NPQ出现了降低现象, 低浓度的阿特拉津没有直接破坏光合色素, 在浓度超过60 μ g· L-1时光合色素的结构才受到损伤, 但在甲乙基化植物油的作用下, 除草剂渗透力增强, 40 μ g· L-1的阿特拉津就对光合色素表现出了明显的毒性效应。
2.3.2 甲乙基化植物油对蛋白核小球藻检测扑草净生物毒性的增敏效果
从图5可知, 扑草净对蛋白核小球藻的生物毒性与阿特拉津相似, 低浓度时对照组NPQ的值并没有明显变化, 但在200 μ g· L-1时对照组NPQ的值比0 μ g· L-1时增加了60%, 而实验组则增加了83.4%, 并且实验组的Fv/Fm、 Y(Ⅱ )、 qP抑制率也明显高于对照组(p< 0.05), 扑草净在150 μ g· L-1时Fv/Fm抑制率比对照组增加了22%, 而Y(Ⅱ )抑制率提升最显著时出现在浓度为60 μ g· L-1, 甲乙基化植物油的增敏效果达到了31.3%, 极大地提升了扑草净对藻细胞的毒性效应, Y(Ⅱ )可以作为检测低浓度扑草净的最灵敏的指标。
2.3.3 甲乙基化植物油对蛋白核小球藻检测特丁通生物毒性的增敏效果
由图6表示, 特丁通浓度在20~80 μ g· L-1时, 实验组与对照组蛋白核小球藻的Fv/Fm、 qP、 NPQ变化差异并不明显, 但浓度升至200 μ g· L-1时, 实验组的Fv/Fm抑制率明显高于对照组, Fv/Fm抑制率较对照组提升了16%, NPQ抑制率提升了13%, 说明甲乙基植物油提升了高浓度特丁通在藻细胞表面的停滞性。 实验组的Y(Ⅱ )在0~200 μ g· L-1均表现出敏感的响应效果, 以80 μ g· L-1时响应最显著, 抑制率达45%, 是对照组的2倍, 蛋白核小球藻对低浓度特丁通的毒性响应较弱, 但在甲乙基化植物油的作用下, Y(Ⅱ )仍可以作为检测痕量特丁通最有效的指标。
2.4.1 甲乙基化植物油对铜绿微囊藻检测阿特拉津生物毒性的增敏效果
由图7所示, 200 μ g· L-1的阿特拉津浓度使对照组Fv/Fm抑制率达到22%, 实验组Fv/Fm抑制率达到了34%。 阿特拉津对实验组铜绿微囊藻荧光参数qP与NPQ抑制率显著高于对照组(p< 0.05), 但0~40 μ g· L-1时对照组的qP值出现了上升趋势, 说明低浓度的阿特拉津刺激了铜绿藻囊藻的光系统的光化学反应, 但在甲乙基化植物油的作用下实验组qP已经出现了胁迫效应, 40 μ g· L-1时实验组比对照组的qP抑制率高出32%, 而NPQ值增加了30%, 阿特拉津对NPQ的负面效应显著高于Fv/Fm。
2.4.2 甲乙基化植物油对铜绿微囊藻检测扑草净生物毒性的增敏效果
图8显示, 铜绿微囊藻对低浓度扑草净有很高的适应性, 浓度高于100 μ g· L-1时, 实验组Fv/Fm值出现了明显下降, Fv/Fm抑制率以200 μ g· L-1扑草净暴露下最为显著(p< 0.05), 达到32%。 Y(Ⅱ )对扑草净的敏感性高于阿特拉津, 在浓度为60 μ g· L-1时, 实验组Y(Ⅱ )抑制率是对照组的2倍, 甲乙基化植物油加强了扑草净对铜绿微囊藻细胞膜的渗透性, 从而抑制了铜绿微囊藻的实际光能转换效率。 与阿特拉津相似, 扑草净胁迫下铜绿微囊藻的qP也表现出了低浓度抑制, 高浓度促进的现象, 浓度越高qP值越低, 实验组抑制率最高达到52%, 而NPQ对扑草净的响应灵敏度优于其他参数, 在甲乙基植物油作用下检测低浓度扑草净时尤为明显。
2.4.3 甲乙基化植物油对铜绿微囊藻检测特丁通生物毒性的增敏效果
如图9所示, 铜绿微囊藻对三种除草剂的敏感性相似, 在特丁通的影响下, 实验组与对照组的Fv/Fm值没有明显差异, 实验组Y(Ⅱ )、 qP和NPQ对特丁通毒性的敏感性显著高于对照组(p< 0.05), 尤其是20~60 μ g· L-1, Y(Ⅱ )、 qP抑制率最高提升了25.5%与29%, NPQ值升高趋势也优于对照组, 甲乙基植物油显著提升了铜绿微囊藻对三嗪类除草剂的毒性响应灵敏度。
2.5.1 甲乙基化植物油对斜生四链藻检测阿特拉津生物毒性的增敏效果
在甲乙基化植物油的作用下, 实验组Fv/Fm、 Y(Ⅱ )与对照组相比显著降低, 如图10所示, 斜生四链藻对阿特拉津自身有一定适应性, 但随浓度的升高Fv/Fm抑制效果逐渐增大, 且显著高于对照组(p< 0.05), 200 μ g· L-1时, 甲乙基化植物油增敏效果达到了24%, 而在相同的浓度下使用硫酸铵作为增敏剂, 斜生四链藻的Fv/Fm抑制率为10%, 但仍显著低于甲乙基化植物油增敏时的响应灵敏度。 实验组和对照组斜生四链藻的qP值随着浓度增大而下降的趋势逐渐减小, 说明阿特拉津在一定浓度范围内对qP值的胁迫效应已经到达极限, qP对低浓度阿特拉津依然具有较好地响应灵敏度。 20~100 μ g· L-1的阿特拉津胁迫下斜生四链藻光合色素的损伤较小, 在150~200 μ g· L-1时, 实验组NPQ值才明显增加, 表明在甲乙基化植物油的作用下, 高浓度阿特拉津更容易进入藻细胞内从而使光合色素进一步破坏。
2.5.2 甲乙基化植物油对斜生四链藻检测扑草净生物毒性的增敏效果
斜生四链藻对扑草净比阿特拉津更加敏感, 如图11所示扑草净浓度为20~80 μ g· L-1时, 甲乙基化植物油使实验组中扑草净对Y(Ⅱ )抑制率提升了1.5倍, 而浓度达到200 μ g· L-1时, 实验组中Y(Ⅱ )值下降了80%, 表明Y(Ⅱ )对扑草净的响应灵敏度优于其他参数值, Fv/Fm抑制率也是对照组的3倍, NPQ增加量是对照组的2倍, 说明甲乙基化植物油使扑草净分子更容易渗入藻细胞PSⅡ 系统, 增强了光合胁迫效应, 光合色素也受到明显损伤, 从而导致斜生四链藻光合速率的显著降低。
2.5.3 甲乙基化植物油对斜生四链藻检测特丁通生物毒性的增敏效果
由图12所示, 对照组的斜生四链藻参数Fv/Fm值在整个浓度梯度的特丁通胁迫下下降并不明显, 抑制率最高为16%, 而实验组Fv/Fm抑制率为41.5%, 显著高于对照组(p< 0.05), 特丁通对Y(Ⅱ )的毒性抑制效果显著高于qP, 在甲乙基化植物油的作用下, 60 μ g· L-1的特丁通就对Y(Ⅱ )的抑制效果达到了50%, 说明低浓度特丁通就对光系统Ⅱ 表现出明显损伤, 抑制了实际光能转换效率, 而随着qP值的下降, 光系统Ⅱ 吸收光能后用于光化学反应的比例也不断降低, 实验组NPQ值在200 μ g· L-1特丁通的胁迫下比对照组增加了23%, 比0 μ g· L-1时增加了66%。 表明甲乙基化植物油与除草剂结合使藻细胞光合机制受到明显损伤, 更多的除草剂分子能进入细胞中阻断光合作用电子的传递, 藻荧光响应显著提升, 对环境中痕量除草剂的检测更快速和灵敏。
基于藻荧光检测法, 探究三种微藻对三嗪类除草剂的毒性响应时间, 分析甲乙基化植物油对荧光参数Fv/Fm、 Y(Ⅱ )、 qP与NPQ检测除草剂生物毒性的增敏效果, 并对甲乙基植物油的作用机理和四种参数响应灵敏度进行分析与对比。
(1)分析出不同藻类对三种三嗪类除草剂的时间依赖关系, 蛋白核小球藻、 铜绿微囊藻与斜生四链藻的最佳毒性响应时间分别为10、 20和10 min, 增敏效果最显著时甲乙基化植物油的浓度分别为0.25%、 0.5%和0.25%。
(2)三种微藻对除草剂均有显著的荧光响应, 斜生四链藻的响应敏感性最高, 而铜绿微囊藻对除草剂有较好的抗性和适应性, 阿特拉津和扑草净的毒性效果相似且均大于特丁通。
(3)甲乙基化植物油扩大除草剂与微藻细胞的接触面积, 促进除草剂渗入细胞膜, 提高除草剂在藻细胞表面的停滞性。 在不改变除草剂浓度和化学性质的条件下提升了藻荧光法对痕量除草剂生物毒性的检测效果; 以扑草净胁迫下斜生四链藻荧光参数的变化最显著: Fv/Fm抑制率最大可提升3倍, 而此时铜绿微囊藻Fv/Fm的抑制率最高只达到对照组的1.5倍。 甲乙基化植物油对以Y(Ⅱ )和NPQ作为检测痕量乃至高浓度除草剂的毒性指标增敏效果最显著, Y(Ⅱ )最高抑制率可达到79%, NPQ值增加2倍, 可作为检测三嗪类除草剂的最有利指标。
甲乙基化植物油可以提升叶绿素荧光参数对痕量三嗪类除草剂毒性响应的灵敏度, 但甲乙基化植物油要制成标准试剂来实际应用于水体中的除草剂检测仍需进一步的测试, 探究甲乙基化植物油在藻液中的配比和共存以此来提高检测除草剂时的持续性和稳定性。 未来更多种类的增敏剂将会被开发并应用于藻荧光法中, 从而提升对更多种类的除草剂与其他污染物生物毒性的响应灵敏度。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|