作者简介: 王晨雨, 女, 1996年生, 天津农学院食品科学与生物工程学院硕士研究生 e-mail: wangchenyu_9@163.com
植物多酚被称作人类健康的“第7类营养素”, 在医药、 食品和营养保健等多个领域受到广泛关注。 红心猕猴桃果皮(RKP)中多酚含量丰富, 是提取植物多酚的优良原料, 但常被视为加工废料遭弃用。 该研究拟通过脉冲超声(PU)辅助天然深共晶溶剂(NADES)提取RKP多酚, 并通过荧光光谱和紫外-可见光谱探究RKP中重点多酚—原儿茶酸(PCA)抑制低密度脂蛋白(LDL)氧化功效及其与牛血清白蛋白(BSA)的相互作用机制。 结果表明, NADES对RKP多酚的提取率显著高于常规溶剂(如水或乙醇)。 在超声功率400 W、 料液比1﹕40(g·mL-1)、 温度70 ℃、 提取20 min及含水率20%( ω/ω)条件下, 所筛选的6种NADES溶剂中, 氯化胆碱-乙二醇组合提取率最高(29.84 mg GAE/g DW)。 光谱实验结果表明, PCA具有较强的DPPH自由基清除能力, 清除率最高可达94.39%。 PCA能够显著延长LDL氧化过程中共轭二烯(CD)生成的延滞时间及达到峰值时间, 有效抑制脂质氧化过程中脂褐素及总荧光产物生成, 减少LDL氧化过程中色氨酸(Trp)及赖氨酸(Lys)残基的氧化修饰, 显示出对LDL氧化极强的抑制效果。 多光谱法对PCA与BSA相互作用研究发现, 两者之间存在相互作用, 具有较强的亲和力, 且只有一个结合位点, 疏水作用力在相互作用过程中起主要作用; 相互作用后酪氨酸(Tyr)周围微环境几乎不发生改变, 而Trp周围微环境极性降低、 疏水性增加; 三维荧光光谱进一步证明二者之间存在相互作用, 并由此引起蛋白质结构发生变化; 综合荧光光谱和紫外-可见光谱的实验结果, PCA与BSA相互作用猝灭机理为静态猝灭。 该研究为开发RKP及PCA提供参考。
Plant polyphenols, known as “Category 7th nutrients” for human health, have received widespread attention in many fields, including medicine, food and nutrition. However, red-fleshed kiwifruit peel (RKP), which contains many polyphenols and is known as an excellent raw material for extracting plant polyphenols, is often discarded as a by-product. First, the polyphenols were extracted by pulsed ultrasound (PU) assisted with natural deep eutectic solvent (NADES) from RKP. Subsequently, protocatechuic acid (PCA), the critical polyphenolin RKP, was selected to investigate the inhibition effect on low-density lipoprotein (LDL) oxidation and to investigate the interaction mechanism with bovine serum albumin (BSA) by fluorescence spectroscopy and UV-Vis spectroscopy. The results were as follows: The extraction rate of polyphenols by NADES was significantly higher than that of conventional solvents. Among the 6 kinds of NADES solvents screened, the highest extraction rate of polyphenols from RKP (29.84 mg GAE/g DW) was obtained with choline chloride-ethylene glycol under the conditions of ultrasonic power of 400 W, material-to-liquid ratio of 1∶40 (g·mL-1), temperature of 70℃, extraction time of 20 min and water content of 20% ( ω/ω). PCA had a strong scavenging ability on DPPH radicals, with the highest scavenging rate of 94.39% in the results of the spectroscopic experiments. PCA could significantly prolong the delay time of conjugated diene (CD) production and peak value during LDL oxidation, effectively inhibit the production of lipofuscin and total fluorescent products during lipid oxidation and reduce the oxidation of tryptophan (Trp) residues and oxidative modification of lysine (Lys) residues during LDL oxidation. These spectroscopic experiments showed a strong inhibition effect on LDL oxidation. The interaction between PCA and BSA was studied, and the following results were obtained using multispectral techniques. The interaction and the strong affinity between PCA and BSA occurred; there was only one binding site, and the hydrophobic force played a major role in the interaction process. The microenvironment around Tyrosine (Tyr) was almost unchanged after the interaction, while a reduction of polarity and enhanced hydrophobicity around Trp residues occurred. The interaction between these two molecules was further verified in the three-dimensional fluorescence spectra, and the protein structure of BSA was changed after this interaction occurred. The quenching mechanism of interaction between PCA and BSA was static quenching according to these fluorescence and UV-Vis spectra experiments. This study provides new insights for the development of RKP and PCA.
红心猕猴桃是我国特有品种, 营养丰富, 具有抗氧化、 抗癌、 抗衰老等功能[1]。 在猕猴桃加工过程中产生大量果皮副产物, 造成严重的环境污染和资源浪费, 而果皮为猕猴桃抗氧化性最强部位、 含有丰富的具有抗氧化、 抗炎、 抗动脉硬化等功效的酚类物质[2]。 目前多酚提取技术主要包含溶剂提取、 超声辅助提取和微波辅助提取[3]等。
天然低共融溶剂(natural deep eutectic solvent, NADES)是一类新型绿色溶剂, 具有生物可降解、 组成灵活、 稳定性高等优势, 显示出从植物原料中提取多酚的潜力[4]。 与平板式超声相比, 聚能式脉冲超声(pulse-ultrasound, PU)能量传递效率高、 对原料细胞结构的破坏作用强[5]。 目前未见采用PU辅助NADES提取红心猕猴桃果皮(red-fleshed kiwifruit peel, RKP)多酚的相关报道。
低密度脂蛋白(low density lipoprotein, LDL)是体内脂类主要载体, 极易氧化生成氧化型低密度脂蛋白(oxidized-low density lipoprotein, Ox-LDL)。 Ox-LDL是引起动脉粥样硬化的重要因素, 有效抑制Ox-LDL生成是预防动脉粥样硬化发生的关键。 原儿茶酸(protocatechuic acid, PCA)是一种存在于如猕猴桃等植物中的酚酸[6]。 但目前PCA对LDL氧化的抑制效果尚不清楚。
外源小分子通过消化、 吸收进入体内先与人血清白蛋白(human serum albumin, HSA)结合后再运输到靶器官发挥生理作用, 而小分子与HSA之间的相互作用可能会改变蛋白质构象、 从而影响运输过程; 同时牛血清白蛋白(bovine serum albumin, BSA)与HSA有76%的同源性、 来源广泛, 是研究小分子与白蛋白相互作用的常用模式蛋白[7]。 PCA与BSA相互作用及其作用机制尚不明确。
本研究首先通过PU辅助NADES提取RKP多酚; 通过AB-8树脂对RKP多酚进行富集、 纯化后采用液质联用鉴定组分; 通过多光谱技术研究PCA清除DPPH自由基、 抑制LDL氧化功效及其与BSA相互作用。 为开发RKP多酚及PCA提供了参考。
RK购自六盘水凉都猕猴桃产业股份有限公司, 产地贵州六盘水; PCA(≥ 97.0%)购自上海阿拉丁生化股份有限公司。
CR22E型高速冷冻离心机, 日本日立公司; F-7000荧光分光光度计, 日本岛津公司; PB-10 pH计, Sartorius仪器设备有限公司; TU-1901双光束紫外可见分光光度计, 北京普析通用仪器有限责任公司; SpectraMax 190酶标仪, 美国MD公司; 安捷伦6545LC/Q-TOF高效液相色谱-质谱仪。
1.3.1 采用PU辅助NADES提取RKP多酚
1.3.1.1 原料预处理
新鲜猕猴桃(RK)去皮, 水洗果皮去除果肉残渣, 烘干后粉碎过60目筛, 备用。
1.3.1.2 总多酚含量的测定
采用Folin-Ciocalteu比色法测定总多酚含量, 以没食子酸当量(gallic acid equivalents, GAE)/干物质(dry weight, DW)计[3]。 取0.1 mL不同浓度没食子酸标准液, 加2.5 mL 10%(V/V)福林溶液, 避光静置5 min, 再加2 mL 7.5 g· L-1 Na2CO3溶液, 50 ℃水浴90 s, 避光静置1 h后于765 nm测吸光度值。 以浓度为x轴、 吸光度值为y轴, 得到标准曲线为y=2.502 6x-0.012(相关系数R2=0.995 8)。
1.3.1.3 PU辅助NADES提取溶剂的筛选
根据Zhao等[8]方法稍加改进制备NADES。 将一定量的两组分和蒸馏水于烧杯中混合, 置于50 ℃水浴锅中不断搅拌至形成澄清透明溶液。
称取1.00 g样品置烧瓶中, 加入40 mL不同提取溶剂(6种NADES、 蒸馏水、 60%乙醇), 脉冲超声(工作及间隔时间均为2 s)提取功率400 W, 70 ℃提取20 min, 提取液8 000 r· min-1离心10 min过0.22 μ m滤膜后测定总多酚含量。
1.3.1.4 PU辅助NADES提取动力学
提取过程中, 每隔30~240 s取样测定总多酚提取率。 使用准一级和准二级动力学模型拟合实验数据进行动力学分析[4]:
准一级动力学方程
准二级动力学方程
式(1)和式(2)中: ce为平衡时提取率(mg GAE/g DW), ct为t时刻提取率(mg GAE/g DW), k1为准一级速率常数(min-1)、 k2为准二级速率常数(g· min-1· mg-1)。
1.3.2 RKP提取液多酚富集及成分鉴定
1.3.2.1 大孔树脂富集
称量10 g(DW)AB-8树脂(含水量70%), 用无水乙醇浸泡24 h, 水洗至无醇味, 湿法装柱, 将提取液稀释1倍后以2 BV· h-1上样。 吸附完成后依次用蒸馏水、 20%、 40%、 60%、 80%乙醇(V/V)以4 BV· h-1各洗脱5 BV, 分段收集洗脱液, 旋蒸、 冻干成粉末备用。
1.3.2.2 LC-MS2 Q-TOF鉴定多酚类物质
液相条件: C18色谱柱(3.0 mm× 100 mm× 2.7 μ m), 流速0.3 mL· min-1, 进样量10 μ L, 流动相为0.1%甲酸/水(溶剂A)和甲醇(溶剂B), 梯度洗脱系统为: 0~5 min, 5% B; 5~15 min, 5%~50% B; 15~20 min, 50%~70% B; 20~25 min, 70%~100% B。
质谱条件: 离子源: ESI; 负离子模式; 毛细管电压: 3.5 kV; 质谱扫描范围: 100~1 700 m/z; 二级质谱模式: Auto MS/MS; 碰撞能: 15和35 eV。
1.3.3 PCA对DPPH自由基清除及LDL氧化抑制能力分析
1.3.3.1 对DPPH自由基清除能力的测定
参考Hou等[9]方法并稍加修改。 制备0.012 5~0.8 μ g· mL-1的Vc标准液与PCA样液。 分别取2 mL于试管中, 加入2 mL DPPH溶液(0.1 mmol· L-1), 室温避光静置30 min后测定517 nm吸光度, 自由基清除率计算公式如式(3)
式(3)中: A0为未加样液的DPPH溶液吸光度; Ai为加入样液后DPPH溶液吸光度; Aj为样液吸光度。
1.3.3.2 对LDL氧化修饰抑制效果的测定
① LDL制备
采用肝素钠沉淀法制备LDL。 将300 mL血浆与3 000 mL沉淀液(50 000 U· L-1肝素钠, 0.064 mol· L-1柠檬酸三钠缓冲液, pH 5.04)混匀, 4 ℃、 1 000 g离心10 min; 再加入1 500 mL洗涤液(0.064 mol· L-1柠檬酸三钠缓冲剂, pH 5.11), 搅拌、 离心、 沉淀。 将所得LDL采用高盐缓冲液(160 g· L-1 NaCl、 10 mmol· L-1 Na2HPO4、 10 mmol· L-1 KH2PO4、 2.7 mmol· L-1 KCl, pH 7.4)溶解、 4 ℃透析24 h后采用Lowry法测定蛋白质浓度、 备用。
② 对CD产生的抑制动力学
用PBS缓冲液(pH 7.4)将LDL稀释至250 μ g· mL-1, 加入2 μ L 1 mmol· L-1 CuSO4诱导LDL氧化, 再加入2 μ L不同浓度PCA, 于酶标仪37 ℃测量10 h内234 nm吸光度来监测产生量, 绘制CD形成动力学曲线。
③ 对Trp荧光猝灭、 Lys氧化修饰、 脂褐素和总荧光物质产生的抑制效果
参照相关方法略加修改, 测定色氨酸(Trp)荧光猝灭变化情况。 取4.9 mL 500 μ g· mL-1的LDL溶液, 先加入50 μ L不同浓度(1、 5、 10 μ g· mL-1)PCA样液, 再加入50 μ L CuSO4(1 mmol· L-1)或去离子水, 37 ℃条件下孵育2.5 h, 采用激发波长(Ex)295 nm/发射波长(Em)330 nm测定Trp荧光猝灭强度, 采用Ex 280 nm/Em 300~450 nm扫描Trp荧光光谱。
采用Ex 350 nm/Em 400~550 nm和Ex 390 nm/Em 400~550 nm监测LDL在氧化过程中产生的活性醛及MDA修饰Lys残基荧光变化情况。
采用Ex 350 nm/Em 460 nm和Ex 360 nm/Em 430 nm检测脂褐素与荧光产物含量。
1.3.4 PCA与BSA相互作用的测定
1.3.4.1 荧光发射光谱
设置Ex 280 nm/Em 290~450 nm, 激发和发射光狭缝宽为5 nm, 扫描速度1 200 nm· min-1, 光电倍增管电压500 V。 BSA浓度为3× 10-5 mol· L-1, 连续滴加PCA, 每次10 μ L(最终浓度为0~2.28× 10-4 mol· L-1), 充分混合、 孵育5 min, 在283、 291和299 K测荧光强度。
1.3.4.2 同步荧光光谱分析
在同步荧光光谱中, 当Δ λ =15 nm时, Ex 275 nm/Em 260~285 nm只显示Tyr残基荧光; 当Δ λ =60 nm时, Ex 310 nm/Em 250~300 nm只显示Trp残基荧光, 测定温度均为291 K。
1.3.4.3 三维荧光光谱分析
测定Ex 200~400 nm/Em 200~600 nm范围内的三维荧光光谱, 狭缝宽度均为5 nm, 扫描速度60 000 nm· min-1。
1.3.4.4 紫外-可见光谱分析
在300 K记录190~550 nm波长范围内的吸收光谱。
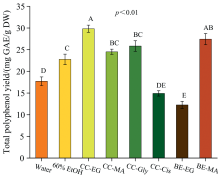
2.1.1 PU辅助NADES提取溶剂的筛选
NADES是氢键供体及氢键受体两类物质组成, 存在大量氢键形成位点, 可与目标组分广泛进行氢键缔合而具有较强的提取能力, 但NADES的粘度较传统溶剂更高[10]。 PU集中于探杆尖端释放超声波, 对原料结构的破坏效应及对溶剂的扰动作用更强、 传质效率高, 更适合协同NADES提取[4]。
为筛选出适合提取RKP多酚的NADES, 共制备了6种代表性的NADES进行筛选(见表1), 并与水和60%乙醇的提取效率进行比较。 结果如图1所示, RKP多酚的提取率从高到低依次为CC-EG> BE-MA> CC-Gly> CC-MA> 60%乙醇> 水> CC-Cis> BE-EG。 提取率最高的CC-EG的总多酚含量分别达到水和60%乙醇的1.68倍和1.31倍。 可能是因为CC-EG与RKP多酚极性相似, 且易与多酚类化合物形成氢键缔合, 提高了RKP中酚类物质的溶解度[2]。 选用CC-EG用于后续提取。
| 表1 天然低共融溶剂筛选表 Table 1 Natural deep eutectic solvent screening |
2.1.2 PU辅助NADES对RKP多酚提取动力学
以60%乙醇为对照, 进行了PU辅助NADES提取动力学研究, 结果如图2所示。 由图2(a)可知, CC-EG的饱和提取率与初始提取速度均显著高于60%乙醇。 准一级和准二级动力学模型方程、 参数和相关系数(R2)如表2所示。 无论对于CC-EG还是60%乙醇, 准二级动力学方程的线性及相关系数都较高[图2(b, c)], 说明颗粒内扩散和液膜扩散均为提取过程的速率限制步骤。 Fu等[4]得出的实验结论与本研究一致。
| 表2 PU辅助NADES提取RKP多酚准一级和准二级动力学方程 Table 2 Pseudo-first-order and pseudo-second-order dynamic equations for the extraction of RKP polyphenols by using PU-assisted NADES |
采用LC-Q-TOF-MS2对树脂富集得到的RKP多酚进行组成分析, 谱图解析过程如下: 根据精确分子质量、 同位素丰度、 同位素差计算分子式, 质量误差设定为5, 并根据加合离子模式选择可能的分子式; 再检索相关文献与MONA(https: //mona.fiehnlab.ucdavis.edu)、 PubChem(https: //pubchem.ncbi.nlm.nih.gov)等数据库, 对比二级质谱图, 推测化合物结构, 鉴定出的化合物如表3所示。
| 表3 LC-Q-TOF-MS2鉴定RKP提取物主要组分 Table 3 Major chemical constituents in RKP extract identified by LC-Q-TOF-MS2 |
PCA是存在于RKP中的典型酚酸, 具有抗癌、 保护心血管等众多药理功效[6]。 为了后续开发PCA, 对其清除DPPH自由基及抑制LDL氧化的功效进行了测试。
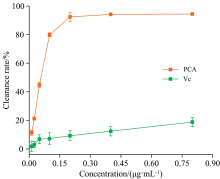
2.3.1 对DPPH自由基清除能力的测定
PCA对DPPH自由基清除结果如图3所示, 在0.012 5~0.8 μ g· mL-1浓度范围内, PCA的清除能力随浓度增大急剧增强, 清除率从11.69%急剧上升到92.65%, 清除率远高于阳性对照Vc, 显示出PCA对DPPH自由基极强的清除作用。 当浓度高于0.2 μ g· mL-1后清除能力达到平衡。
2.3.2 PCA对LDL氧化抑制效果的测定
人体内LDL在氧化应激环境中容易氧化成引起AS的ox-LDL[11]。 在发现PCA对DPPH具有极强清除能力的基础上, 进一步分析了其对ox-LDL产生的抑制效果。
2.3.2.1 对LDL氧化过程中CD产生和降解动力学测定结果
在氧化修饰早期, 活性氧与多不饱和脂肪酸双键发生夺氢氧化, 使双键断裂、 形成脂自由基。 该自由基分子重排形成更稳定的CD, 在230~235 nm有特征吸收。 脂质氧化分为滞后、 增殖和降解三个阶段。 可以通过监测CD产生的延滞时间及达到峰值的时间来评价样品对LDL氧化的抑制作用[11]。 图4显示了LDL氧化过程中CD的产生过程。 氧化初期, LDL内源抗氧化剂(如VE)使其免受氧化修饰。 随着脂质氧化的进行, 内源抗氧化剂被消耗, CD形成急剧增加。 促氧延滞时间最短, 添加不同浓度PCA后, 延滞时间明显延长。 促氧及10 μ g· mL-1的阳性对照BHT分别在50和80 min前后CD就开始快速增殖, 在270及330 min左右OD234达最大。 添加1和5 μ g· mL-1 PCA样品后, 在200及约450 min CD才加速增殖, 比促氧分别延迟了约150及400 min, 比阳性对照分别延迟了约120及370 min。 添加1 μ g· mL-1 PCA样品OD234峰值时间比促氧及BHT分别推迟了约240及180 min。 结果表明, PCA加入显著抑制了LDL氧化, 且抑制效果显著强于10倍浓度的阳性对照BHT。
2.3.2.2 PCA对LDL中载脂蛋白ApoB-100氧化修饰的保护
载脂蛋白ApoB-100是LDL唯一的蛋白组分, 其氧化修饰是LDL氧化的关键步骤[12]。 随着LDL氧化进行, ApoB-100构象发生改变, Trp被氧化修饰、 荧光猝灭, 荧光强度越低表示氧化程度越高。 通过荧光光谱测定PCA对ApoB-100氧化的保护效果结果如图5(a, b)所示。 促氧荧光强度最低。 加入不同浓度PCA后, Trp荧光强度随PCA浓度增加而上升, 呈现出良好的浓度依赖性, 表明PCA能够有效抑制ApoB-100氧化而保护Trp荧光被猝灭, PCA的抑制效果显著强于相同浓度BHT。 Chen等[12]研究表明, 杏仁皮多酚也可保护LDL氧化过程ApoB-100中Trp被氧化, 与本文结论相类似。
2.3.2.3 PCA对Lys残基氧化修饰的抑制作用
LDL氧化过程中产生的活性醛和MDA均会与Lys残基结合, 形成希夫碱, 导致荧光强度增强、 Lys残基活性降低。 PCA对Lys残基氧化修饰的抑制作用如图6(a, b)所示。 促氧荧光强度最高、 氧化程度最深。 添加不同浓度PCA后, 荧光强度显著下降且总体趋势不变, 降低程度与PCA浓度成正比。 1 μ g· mL-1 PCA荧光强度比10倍浓度的阳性对照更低, 表明PCA能有效抑制活性醛及MDA修饰Lys残基。 分析认为PCA能够结合活性醛及MDA, 以保护Lys残基不受氧化修饰。 有研究丁香对LDL氧化过程中荧光特性变化的影响时也得出了与本文类似的结果。
2.3.2.4 PCA对LDL氧化过程中脂褐素和总荧光物质产生的抑制作用
脂褐素和总荧光产物是脂质代谢产物与蛋白质过氧化形成的复合产物。 在LDL氧化修饰过程中, 嵌入外层的蛋白质与脂质反应形成脂褐素, 其在Ex 350 nm/Em 460 nm处具有荧光吸收, 它在体内的沉积量反映了机体衰老及受自由基损伤的程度。 LDL在Ex 360 nm/Em 430 nm处有微弱的荧光吸收, 但经LDL氧化修饰后该处荧光强度增强。 PCA抑制LDL氧化过程中脂褐素及总荧光产物生成结果如图7(a, b)所示。 促氧荧光强度最高, 表明Cu2+诱导LDL氧化产生了大量的脂褐素及荧光物质。 添加不同浓度PCA后, 荧光强度显著降低(p< 0.01), 表明PCA能有效抑制脂褐素及总荧光产物生成。 与大10倍浓度的BHT相比, PCA展现出更强的抑制效果(p< 0.01)。
PCA具有抗癌、 保护心血管等众多功效[6], 本研究也发现其具有很强的清除自由基及抑制LDL氧化功效。 猕猴桃等原料中的PCA经消化、 吸收进入人体内需与白蛋白结合后才能运输到全身各靶器官发挥作用[7]。 继续对PCA与BSA的相互作用进行研究, 以期为后续开发PCA相关健康食品提供参考。
2.4.1 PCA对BSA荧光猝灭机理的确定
荧光猝灭能够提供关于蛋白质构象转变、 亚单位结合和变性等信息; 荧光强度的变化可以归因于分子间相互作用, 包括激发态反应、 分子重排、 能量跃迁和基态络合物的形成[13]。 可以通过检测小分子与BSA的荧光猝灭来检测BSA与小分子之间的相互作用。 如图8(a— c)所示, 混合后BSA荧光强度随PCA浓度增加逐渐降低, 这可能是因为蛋白质的结构发生了变化, 说明PCA与BSA之间存在相互作用, PCA能够有效猝灭BSA内源荧光。
荧光猝灭机理包括动态猝灭和静态猝灭。 在动态猝灭过程中, 猝灭常数随温度升高而增大; 而在静态猝灭过程中, 猝灭常数随温度增加而减小[14]。 使用Stern-Volmer方程分析不同温度下的荧光数据可阐明荧光猝灭机制[7]。
式(4)中: F0和F分别为不存在和存在PCA时的荧光强度; KSV表示Stern-Volmer猝灭常数, [Q]表示猝灭剂(PCA)浓度; Kq是猝灭速率常数(2.0× 10-10 L· mol-1· s-1), τ 0是没有猝灭剂的生物分子的平均寿命(10-8 s)。
图9不同温度下PCA与BSA的Stern-Volmer线性图。 表4中KSV值随温度升高而降低, 说明PCA-BSA结合物在低温下更稳定, 且猝灭机理为静态猝灭。 Kq值均大于最大猝灭速率常数2.0× 1010 L· mol-1· s-1, 进一步证明猝灭机理为静态猝灭。 Ren等[15]在研究白藜芦醇与胰蛋白酶相互作用时得到了类似结果。
 | 图9 283、 291和299 K下PCA对BSA荧光猝灭的Stern-Volmer曲线Fig.9 Stern-Volmer curve for the fluorescence quenching of BSA by PCA at 283, 291 and 299 K |
| 表4 283、 291和299 K下PCA对BSA荧光猝灭的Stern-Volmer猝灭常数 Table 4 Stern-Volmer quenching constants of BSA by PCA at 283, 291 and 299 K |
2.4.2 PCA与BSA结合常数(Ka)及结合位点数(n)的确定
用于分析小分子和蛋白质之间相互作用的重要定量信息包括Ka和n。 基于静态猝灭机理, Ka和n可以由Double logarithmic方程确定[13]
式(5)中: Ka为结合常数, n为结合位点数。 由图10和表5可知, Ka值均大于104, 表明PCA与BSA的结合力较强, 且Ka值和n值均随着温度升高而升高, 表明结合为吸热反应, 升高温度有利于PCA与BSA的结合。 n值均约为1, 表明PCA与BSA之间配合物的化学计量比为1∶ 1, 即在其相互作用过程中, PCA与BSA之间只有一个结合位点。 Ying等[17]在研究姜黄素与胃蛋白酶相互作用时也得出与本文一致的结论。
 | 图10 283、 291和299 K条件下PCA与BSA相互作用的Double logarithmic曲线Fig.10 The double logarithmic curve of interactionbetween PCA and BSA at 283, 291 and 299 K |
| 表5 283、 291和299 K条件下PCA与BSA相互作用的结合常数和热力学参数 Table 5 The binding constants and thermodynamic parameters of interaction between PCA and BSA at 283, 291 and 299 K |
2.4.3 PCA与BSA结合作用热力学参数及作用力类型的确定
小分子与蛋白质之间的结合作用力包括静电作用、 氢键作用、 范德华力和疏水作用等[17]。 当Δ H> 0, Δ S< 0或Δ H> 0, Δ S> 0时, 表明主要作用力为疏水相互作用; 当Δ H< 0, Δ S< 0时, 范德华力和氢键为主要作用力; 当Δ H< 0, Δ S> 0时, 则静电相互作用为主要作用力。 蛋白质-配体结合的非共价力由以下方程计算的热力学参数确定。
式(6)和式(7)中: Δ G为吉布斯自由能; Δ H为焓变; Δ S为熵变; T为热力学温度(K); R为气体常数(8.314 J· mol-1· K-1)。 如表5所示, Δ G值均为负值, 表明PCA与BSA的结合过程属于自发进行; Δ H> 0, Δ S> 0, 表明PCA-BSA络合物的形成是一个由熵驱动的吸热反应, 疏水作用力对PCA与BSA的结合起主要作用[16]。
2.4.4 同步荧光光谱分析
同步荧光光谱可同时扫描激发与发射两个单色器波长, 其灵敏度高, 选择性好且干扰少, 常被用来检测配体对荧光团周围微环境的影响及蛋白质构象变化[15]。 同步荧光光谱特征荧光峰位置发生红移代表微环境极性升高, 发生蓝移代表微环境周围极性降低, Δ λ =15 nm和Δ λ =60 nm分别反映Tyr和Trp残基周围微环境的变化。 如图11(a, b)所示, 随着PCA浓度增加, 同步荧光强度逐渐减弱, 但减弱的程度不同。 当Δ λ =15 nm时, 随着PCA浓度增加, BSA特征峰的荧光强度从375.67持续猝灭到108.93。 当Δ λ =60 nm时, 荧光强度从1071.67持续猝灭到469.1; 此外, 特征荧光峰发生蓝移(277.6→ 274.6 nm)。 结果表明, Tyr极性及周围微环境不变, Trp周围微环境极性降低、 疏水性增加, 进一步验证了结合之后PCA引起BSA构象发生变化[18]。
2.4.5 三维荧光光谱分析
三维荧光光谱比常规荧光光谱更生动、 丰富地显示荧光物质的荧光强度随激发和发射波长范围的变化, 从而提供更多信息[19]。 游离BSA[图12(a)]与添加9.9× 10-5 mol· L-1 PCA[图12(b)]后的三维荧光光谱如图12所示, 峰1(Ex=280 nm)反映的主要是Trp和Tyr残基的本征荧光, Rayleigh峰为瑞利散射峰(λ Ex=λ Em)。 添加PCA后, 峰1的荧光强度显著下降, 表明PCA与BSA相互作用导致BSA空间构象发生变化、 改变了分子内部微环境, 导致Trp和Tyr残基荧光强度降低[16]。
2.4.6 紫外-可见光谱分析
动态猝灭只影响荧光团的激发态, 紫外-可见光谱保持不变。 而由于基态络合物的形成, 静态猝灭经常导致荧光团的紫外-可见光谱发生改变。 因此, 紫外-可见光谱是另一种简单、 直观验证猝灭类型的方法[18]。 为了验证PCA对BSA荧光的猝灭机理, 测量了PCA与BSA的紫外-可见光谱(图13)。 BSA在270~280 nm有一个吸收峰。 随着PCA浓度增加, 280 nm附近的吸光度值也随之增加, 表明形成了PCA-BSA复合物。 进一步验证了PCA-BSA复合物的形成是导致BSA荧光猝灭的原因, 作用机制为静态猝灭, 与前述荧光光谱检测结果一致。
(1)PU辅助NADES提取RKP多酚, 以摩尔比1∶ 2、 含水率20%的CC-EG提取RKP多酚提取率最高, 得率达29.84 mg GAE/g DW。 提取动力学实验研究表明, 准二级动力学模型更能解释提取过程。
(2)PCA对DPPH具有很强的清除能力, 清除率最高可达94.39%。 同时, PCA能够有效抑制LDL氧化过程中CD的生成及Trp、 Lys残基荧光光谱变化和脂褐素和总荧光产物的生成, 抑制效果与浓度成正比。
(3)通过荧光光谱和紫外-可见光谱对PCA与BSA的相互作用研究发现, PCA对BSA荧光猝灭通过静态猝灭机制进行, 反应过程自发进行, 疏水作用力在反应过程中起主要作用, Trp周围微环境极性降低、 疏水性增强; 三维荧光光谱也验证了上述结果。 本研究为进一步开发PCA在工业中的应用提供了参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|