作者简介: 张颖超, 1984年生, 燕山大学环境与化学工程学院副教授 e-mail: zhangyc@ysu.edu.cn
腐殖化是有机残体经微生物转化或化学氧化聚合形成腐殖质的固碳过程, 产物腐植酸(HA)所具有的活性基团对污染物的环境化学行为有重要影响。 天然矿物如含Mn/Fe/Al/Si的氧化物可以促进有机单体小分子物质(如多酚、还原性糖、氨基酸等)氧化聚合成HA。 作为天然氧化剂, 氧气可与金属氧化物协同促进非生物腐殖化, 并提高产物HA质量。 不同氧气浓度对金属氧化物促进的非生物腐殖化及有机质基团演化的影响尚不清楚。 该研究选择儿茶酚和甘氨酸作为腐殖化前体物, 分别代表多酚和蛋白质类物质降解的小分子。 采用氧化铁作为腐殖化强化剂。 对反应过程中的溶液及提取的HA进行紫外可见光谱(UV-Vis)、傅里叶变换红外光谱(FTIR)和X射线光电子能谱(XPS)分析。 结果表明, 在不同氧气浓度气氛下, 有机质芳构化程度(UV254)依次表现为: 21%氧气浓度> 40%氧气浓度>0%氧气浓度。 HA产量变化趋势与UV254结果一致, 且在21%氧气浓度下, HA产量较40%与0%氧气浓度提升了25%。 XPS光谱分析表明: 21%氧气促进了HA中胺基N向吡咯N的转化, 而40%氧气浓度则促进了胺基N向酰胺N的转化, 0%氧气浓度下HA仍有胺基N。 FTIR分析结果表明: ·OH促进芳香类物质环裂形成了HA中的含氧官能团(C=O, COOH)。 FTIR与UV-Vis的异质二维谱图分析结果表明, 氧气促进了氨基酸转化成HA的C=O基团及酰胺转化成HA的芳基与脂肪族基团。 结构方程模型(SEM)分析结果表明: 铁离子溶出量是影响HA产率的关键因素, 21%浓度的氧气通过促进铁离子的溶出加速了有机质的聚合。 此外, Fe2+/Fe3+与HA产率呈负相关, 说明氧气通过促进铁离子的转化间接影响了腐殖化反应。 氧气浓度影响了腐殖化产物的转化, 进而影响了HA的产量和官能团组成。 研究揭示了氧气浓度对腐殖化产物的影响, 为腐殖化理论的完善提供参考。
Humification is a carbon sequestration process where organic residues are transformed into humic substances (HS) through microbial conversion or chemical oxidation and polymerization. The active functional groups present in the resulting humic acids (HA) significantly impact the environmental chemical behavior of pollutants. Natural minerals containing Mn/Fe/Al/Si oxides can facilitate the oxidative polymerization of organic monomeric small molecules (e.g., polyphenols, reducing sugars, amino acids) into HA. Oxygen, as a natural oxidant, can synergistically enhance non-biological humification in the presence of metal oxides and improve the quality of the resulting HA. However, the mechanisms of abiotic humification enhancement by metal oxides under varying oxygen atmospheres and the impact on the evolution of organic matter remain unclear. This study used catechol and glycine as representative precursors for polyphenol and protein degradation, respectively, with iron oxide enhancing humification reactions. Solution and extracted HA samples were analyzed by ultraviolet-visible spectroscopy (UV-Vis), Fourier-transform infrared spectroscopy (FTIR), and X-ray photoelectron spectroscopy (XPS) during the reaction process. The results indicated that the aromatization of organic matter, as indicated by UV254, followed the order of 21%>40%>0% oxygen concentration. HA yields mirrored the UV254 findings, with an approximately 25% increase in HA production observed at 21% oxygen concentration compared to 40% and 0% oxygen concentrations. XPS spectroscopic analysis revealed that 21% oxygen concentration promoted the conversion of amino group N to pyrrole N in HA. In comparison, 40% oxygen concentration facilitated the conversion of amino group N to amide N, and under 0% oxygen concentration, a substantial amount of amino group N remained in HA. FTIR analysis indicated that ·OH generated from the aromatic compound ring cleavage contributed to oxygen-containing functional groups(C=O, COOH) in HA. FTIR combined with hyperspectral 2D maps from UV-Vis suggested that oxygen's involvement promoted the conversion of amino acids into C=O in HA and the transformation of amides into aromatic and aliphatic moieties in HA. Structural equation modeling (SEM) indicated that releasing iron ions was a key factor in promoting HA yield, and 21% oxygen concentration accelerated organic matter polymerization by enhancing iron ion release. Furthermore, the divalent iron/trivalent iron ratio was negatively correlated with HA yield, implying that oxygen indirectly affected humification by promoting iron ion conversion. In conclusion, changes in oxygen concentration affect the transformation of humification products, subsequently influencing HA yield and functional group composition. This study reveals the impact of oxygen concentration on humification products, offering references for refining humification theory.
腐植酸(HA)是土壤肥力的“ 生命核” , 占土壤有机碳的80%, HA的形成过程(腐殖化)对土壤储碳控碳具有积极的促进作用[1]。 HA具有独特的活性官能团, 如氨基、羧基、羟基和酚基等, 对环境污染物的行为归驱具有重要调控作用[1]。 研究腐殖化过程中有机质的演化对于土壤碳汇动态平衡具有重要意义[2]。 自然界动植物残体分解产生的小分子物质如氨基酸, 多酚与单糖等可作为腐殖化前体物, 经微生物分解与合成或地球物理化学作用形成富含多种活性官能团的复杂大分子有机酸混合物— — 腐殖质[1]。 根据在酸碱性水溶液中溶解度的不同, 腐殖质分为可以溶于酸、碱和水的橙黄色的富里酸(FA), 不溶于酸、但溶于碱的腐黑色HA, 以及不溶于酸、碱与水溶剂的黑色胡敏素[3]。 依据反应条件的不同, 腐殖化可分为生物路径与非生物路径, 较微生物主导的生物路径, 金属氧化物促进的非生物腐殖化反应具有不受微生物生长条件的限制, 反应条件可控, 产物可定向合成等优势而被广泛关注[3, 4]。 金属氧化物如含Mn/Fe/Al/Si的氧化物可作为路易斯酸接受有机质氧化产生的电子, 促进还原性单糖、多酚和氨基酸等腐殖化前体物小分子在相对较短的时间内缩聚形成类腐殖质, 比生物腐殖化路径更快速、高效, 且所得的类腐殖质产品之间无显著差异, 均高度芳构化, 与土壤中腐殖化度最高的腐殖质品质相当[5]。 在金属氧化物促进有机质聚合方面: 铁氧化物> 锰氧化物> 铝氧化物> 硅氧化物[3]。 铁作为土壤结构体胶结物质重要组分之一, 铁氧化物储量丰富, 广泛存在于土壤和沉积物中, 其赋存形态影响着环境中有机质的迁移, 转化与分布[6]。 氧化铁对土壤HA的形成与土壤固碳有积极的促进作用[7]。 如氧化铁可通过吸附/共沉淀优先去除大分子有机物, 并在此过程中保护有机质不被分解[8]。 自然环境下, 氧气可与水分子产生具有更高氧化活性的羟基自由基(· OH), 产生的· OH在促进有机质小分子氧化缩聚发挥重要作用[9]。 · OH还可促进木质纤维素类物质的降解进而加速腐殖化反应[10]。 研究表明, 氧气可作为天然氧化剂促进HA含量的增加[2], 氧化铁与氧气可协同促进腐殖化反应[4]。 然而氧气及其浓度对腐殖化影响的研究目前仍不明晰。
本研究选择作为木质纤维类降解单体的小分子代表儿茶酚, 与作为蛋白质降解产物的小分子代表甘氨酸, 以氧化铁为强化剂, 构建不同氧气浓度下的非生物腐殖化体系。 将现代无损测定溶解性有机质(DOM)的谱学识别技术(UV-Vis, FTIR, EEM, XPS)引入腐殖化产物研究中[11], 考察不同浓度氧气对非生物腐殖化反应DOM结构和组成的变化差异。 采用光谱学联用技术结合二维相关光谱和结构方程模型(SEM)解析方法, 多角度全方位地揭示不同氧气浓度对腐殖化产物特性的动态差异, 为深入了解富氧化铁的土壤基质氧气含量变化对有机质结构基团组成和谱学特征的影响机制, 以及腐殖化理论的完善提供参考。
儿茶酚、甘氨酸、磷酸二氢钠(NaH2PO4)与磷酸氢二钠(Na2HPO4)、 硫柳汞试剂、 香豆素、 氧化铁粉末均为分析纯试剂, 分别采购自上海迈瑞尔化学技术有限公司、 北京百灵威科技有限公司、 西陇科学有限公司、 北京百灵威科技有限公司、 上海阿拉丁试剂有限公司与天津市科密欧化学试剂有限公司。
1.2.1 非生物腐殖化体系的构建
将氧化铁粉末按照1∶ 75的质量比(固体∶ 液体, w/v)加入不同的反应容器中, 经过100 W超声3 min, 以促进矿物颗粒在介质中均匀分散。 将调整至0.01 mol· L-1浓度的有机前体物加入悬浮液中, 构建腐殖化反应体系。 为模拟21%氧气浓度气氛, 反应瓶通过其顶部的玻璃管导入环境空气。 对于0%氧气浓度气氛, 通过容器底部向反应溶液持续通入氮气15 min以排除体系的溶解氧, 随后将反应瓶用橡胶塞密封。 将各反应容器的外壁覆盖锡纸以避光, 同时设置反应温度为35 ℃, 并将各腐殖化模拟体系置于130 rpm的恒温磁力搅拌器(博纳科技有限公司, 中国)。 为确保实验结果的准确性, 可靠性和重复性, 无菌腐殖化模拟体系设定了两个空白对照组: 空白1仅含缓冲溶液, 用于确认实验体系的无菌状态; 空白2仅含氧化铁, 旨在评价铁离子非生物源的溶出情况。
1.2.2 实验
采用儿茶酚和甘氨酸作为腐殖化反应前体物小分子, 同时添加氧化铁作为反应的强化剂。 将上述体系分别置于不同氧气浓度氛围下(0%氧气、 21%氧气和40%氧气)进行反应。 采用0.2 mol· L-1 Na2HPO4/NaH2PO4的缓冲溶液作为非生物腐殖化反应的基质, 并向缓冲溶液中添加0.01 mol· L-1盐酸以调节反应体系的pH至8.0。 在不同的反应时间点(0、 120、 200、 300、 440、 580和700 h)采集反应液1 mL并对样品进行离心(4 000 rpm, 10 min), 所得的上清液经稀释后用于表征有机质的组成。
腐殖化产物聚合度的表征采用紫外-可见分光光度仪(UV-1800, 日本), 扫描波段为200~800 nm; 傅里叶红外分光光度计(Nicolet Nexus 870, 美国), 扫描波数范围为400~4 000 cm-1。 有机碳浓度的测定采用总有机碳分析仪(TOC-V CSN, 日本), 游离铁离子含量的测定使用邻菲咯啉显色法[12], 羟基自由基(· OH)含量的测定采用荧光分光光度计(HitachiF 7000, 日本)对7-羟基香豆素探针分子所释放的荧光强度信号进行分析。 按照国际腐殖质协会(IHSS)推荐的方法对HA和FA分别进行提取和纯化[2]。
傅里叶红外光谱(FTIR)及紫外-可见光谱(UV-Vis)数据通过2D-shige软件进行二维相关光谱分析。 所有数据处理与计算均在MATLAB R2019a(MathWorks Inc., USA)环境下进行。 腐殖化过程中影响因素的定量识别与评估, 采用IBM SPSS Amos 25软件包含的结构方程模型(SEM)进行统计分析。
紫外吸收光谱显示, 254 nm处的吸光值(UV254)可用于表征含有C=C和C=O键的芳香族化合物[13]。 图1为不同氧气浓度下各反应体系溶液的暗色化度变化。 空白组1的UV254值低于仪器检测限, 而且在整个反应过程中未观察到任何微生物生长迹象, 进一步验证了腐殖化反应液为无菌的非生物反应基质。 所有体系的暗色化度随着反应时间的推移而逐渐增加, 尤其是在21%和40%氧气浓度气氛下的反应体系, 在整个反应过程中二者暗色化度均高于0%氧气浓度气氛的体系, 表明氧气浓度影响了腐殖化体系暗色化物质的形成[2]。 0%氧气浓度的体系在接近600 h时的暗色化度出现了明显的下降趋势。 随着氧气浓度的升高, 暗色化度并未呈现增加趋势, 反而各体系的暗色化度表现出相反的趋势, 表明氧气与氧化铁可能发挥协同促进腐殖化的作用[13]。 值得关注的是, 在300 h后, 0%氧气浓度气氛下体系的暗色化度增长速度较慢, 而在21%和40%氧气浓度气氛下, 暗色化度增长速度加快, 进一步证实了氧气具有促进有机质氧化聚合进而形成暗色化物质的作用[2]。
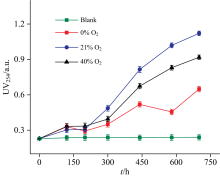 | 图1 254 nm处紫外可见光谱的吸光度值变化2.2 腐植酸与富里酸的含量Fig.1 Changes in the absorbance at 254 nm in four different oxidation environments |
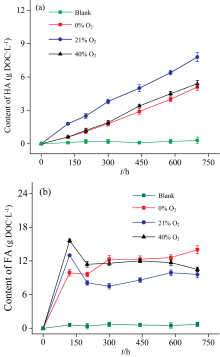
图2(a)与(b)为不同氧气浓度条件下, 各反应体系内HA与FA含量的变化趋势。 从腐殖化过程中HA含量的动态变化可以看出, 所有条件下HA含量均呈现逐渐增长的趋势。 在不同氧气浓度气氛的影响下, HA含量的增长顺序为21%> 40%> 0%。 结合紫外吸收系数UV254的分析, 推测21%氧气浓度条件下有利于芳香族化合物向HA的转化。 对FA含量的分析表明, 在21%及40%氧气浓度气氛下, FA含量先增后减, 而在0%氧气浓度气氛下, FA含量则表现为持续上升的趋势。 结果表明, 氧气浓度是影响FA向HA转化过程中的重要因素。 FA的含量在40%氧气浓度气氛下始终高于21%氧气浓度气氛, 且在40%氧气浓度气氛产生的HA含量低于21%氧气浓度体系, 表明40%氧气浓度抑制了FA到HA的转化。
在氧化铁强化的腐殖化过程中, 氧化铁可作为路易斯酸接受有机物氧化聚合产生的电子[14]。 不同氧气浓度下铁离子的溶出情况如图3(a)所示。 各反应条件下, 铁离子的含量在整个反应过程中呈逐渐增加的趋势。 在整个反应过程中, 空白2中未检测到铁离子的释放, 有效地排除了氧化铁在磷酸盐缓冲体系中物理性释放铁离子的可能性。 在0%氧气浓度下, 铁离子浓度在反应300 h后达到饱和, 无进一步溶出现象。 相比之下, 在21%和40%的氧气浓度气氛下, 铁离子持续溶出, 其溶出量遵循以下趋势: 0%氧气浓度气氛< 40%氧气浓度气氛< 21%氧气浓度气氛。 这一现象揭示了氧气浓度显著影响铁离子的溶出行为, 其中21%氧气浓度促进了氧化铁的氧化过程, 而40%氧气浓度则显示出一定的抑制效应。 如图3(b)所示, 在无氧条件下, 羟基自由基未被检测到, 表明氧气是诱导产生· OH的主要因素[15]。 在有氧条件下, 氧化铁对羟基自由基的催化转化作用得到增强, 尤其在21%氧气浓度气氛下, 其转化效率较40%氧气浓度气氛下高出20%。
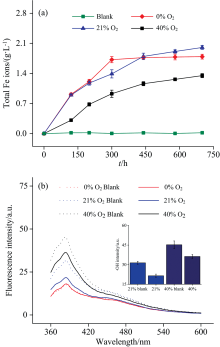 | 图3 (a)不同时间下溶出的总铁离子含量变化与 (b)羟基自由基荧光强度变化2.4 有机质官能团的转化Fig.3 Changes in (a) the dissolved total iron ion content and (b) hydroxyl radical fluorescence intensity |
图4(a)为溶液紫外吸收光谱在不同氧气浓度下的变化情况。 波长214 nm的吸收峰对应酰胺基团[2], 230 nm的吸收与FA含量相关[13], 而260和280 nm的吸收与氨基酸含量相关[16]。 由图可知, 随着氧气浓度的增加, 相较于氨基酸和FA的吸收峰, 酰胺基团的吸收峰受到更强烈的扰动, 表明氧气参与了有机物的氧化聚合反应。 图5(a)展示了随氧气浓度增加各体系形成的HA一维红外吸收光谱的变化。 在图中, 波长850 nm对应芳环中的C— H振动, 1 050 nm归属于多糖/碳水化合物中的C=O振动, 1 200 nm对应酰胺基团的C— O— C振动, 1 450 nm对应脂肪族中的C— H振动, 1 600 nm对应芳基中的C=C振动, 而波长1 700 nm对应羧基官能团[17]。 结果显示, 氧气浓度的升高导致HA的特征吸收峰强度发生了不同程度的变化, 并且出现了吸收峰的重叠。 这表明不同浓度氧气参与的腐殖化过程对HA分子的结构和活性官能团产生了不同程度的影响。
二维相关光谱(2D COS)通过维度扩展, 将一维光谱信号延伸至二维空间, 有效解决了传统一维光谱分析中因官能团峰位重叠而导致的微弱信号识别问题[10]。 该技术不仅显著提升了光谱解析度, 还能够捕捉化学基团的动态变化, 并揭示分子内部及分子间的复杂相互作用机制。 为深入揭示氧气在腐殖化过程中所涉及的特定官能团的作用机制, 本研究应用2D COS技术, 可精确追踪DOM结构的动态演变, 并识别结构变化中的细微差异[10]。 图4(b)为不同体系溶液在210~290 nm的二维UV-Vis同步谱图, 其中214 nm处观察到一个显著的主吸收峰, 而在260 nm附近则显示出一个较弱的次吸收峰。 表明相对于氨基酸类物质, 酰胺基团的转化对不同氧气浓度气氛的响应更为敏感。 在异步光谱图4(c)中, 观察到两个交叉峰位于(230 nm, 214 nm)和(265 nm, 230 nm)。 根据NODA法则可以推测出有机质基团转化的顺序为: 230 nm> 214 nm> 265 nm[18]。 表明氧气浓度对有机质基团转化顺序依次为: 类富里酸→ 酰胺基团→ 氨基酸。 图5(b, c)为各体系腐殖化产物HA在750~1 750 cm-1处的二维红外谱。 同步谱图5(b)在1 200和1 150 cm-1处呈现出两主动峰, 1 200 cm-1处的峰位强度要高于1 050 cm-1处, 且二者均为正值, 表明在HA形成过程中, 酰胺基团比多糖/碳水化合物中的C=O键更易受氧气浓度变化的影响, 并且两种官能团的构象变化趋势相似。 异步谱图中的谱带变化如图5(b)所示, 根据NODA法则, 氧气浓度变化对HA官能团影响顺序依次为: 850> 1 050> 1 200> 1 450> 1 600> 1 700 cm-1。 对应的官能团分别为: 芳基→ 多糖/碳水C=O→ 酰胺基团→ 脂肪族C— H→ 芳基→ 羧基。 因此, 氧气促进了芳香族化合物的环裂解, 进而形成HA中的含氧官能团[4]。
为明确HA官能团的红外光谱与相应溶液的紫外光谱之间的谱带分配与对应关系, 研究采用了UV-Vis与FTIR技术相结合的异质二维光谱分析方法。 如图6(a, b)所示, 同步二维光谱中显现出八个显著的主动峰: (850 cm-1, 214 nm)、 (1 050 cm-1, 214 nm)、 (1 200 cm-1, 214 nm)、 (1 450 cm-1, 214 nm)、 (1 500 cm-1, 214 nm)、 (850 cm-1, 280 nm), (1 050 cm-1, 280)与(1 200 cm-1, 280 nm)。 这些峰表明, 溶液中的氨基酸在转化过程中形成了HA的芳基C— C键、 多糖/碳水化合物中的C=O键以及酰胺基团的C— O— C键。 这些数据还揭示了酰胺基团的转化与HA中芳基C=C键和脂肪族C— H键的形成密切相关。 在异步二维光谱图中, 观察到六个较为明显的主动峰, 分别是: (1 050 cm-1, 280 nm)、 (850 cm-1, 214 nm)、 (1 050 cm-1, 214 nm)、 (1 200 cm-1, 214 nm), 以及(1 500 cm-1, 214 nm)与(1 700 cm-1, 214 nm)。 依据NODA法则, 相应的基团在腐殖化过程中的反应顺序为214 nm> 850, 1 050, 1 200, 1 500, 1 700 cm-1; 280 nm> 1 050 cm-1。 结果表明, 氧气不仅促进了氨基酸转化形成HA中的C=O官能团, 而且有助于酰胺基团转化形成HA中的脂肪胺结构。
通过对HA进行XPS表征, 进一步探讨了氧化环境对HA氮元素(N)组成的影响。 图7(a, b, c)为HA样品N 1s XPS谱图, 其中HA中的N主要存在于三种化学状态: 胺基N(— NH2)、 酰胺N(— CONH— )以及吡咯N(— N— )[2]。 研究表明, 0%氧气浓度气氛下, HA中的N的主要以胺基N形式存在。 在21%氧条件中, HA中的N主要以吡咯N形态出现; 而在40%氧气氛围下, 酰胺N形式占主导。 这一发现表明, 在有机反应过程中, 氧气作为氧化剂促进了胺基N向吡咯N和酰胺N的转化过程: 在21%氧浓度气氛下, 胺基N转化为吡咯N, 在40%氧浓度气氛下则进一步转化为酰胺N。 吡咯N基团被认为是HA颜色加深的关键因素, 这与笔者上述关于UV254吸光度和HA含量变化结果一致。
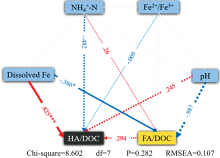
构建结构方程模型(SEM)可用于识别HA形成过程的关键因素[19]。 如图8所示, 总铁溶出量与HA含量之间呈显著正相关性(p< 0.000 1)。 溶出的铁离子对HA形成和暗色化具有直接的促进作用[6]。 此外, 氧气浓度也是影响铁离子溶出量的重要因素。 在21%氧气浓度气氛下, 铁离子的溶出得到促进。 结合2.2与2.3节分析, 含氧环境有利于促进氧气诱导下产生的· OH参与腐殖化反应。 氧气与氧化铁协同促进了整个系统的腐殖化进程及其产物的腐殖化程度。 在40%氧气浓度气氛下, 铁离子的溶出受到抑制, 从而限制了腐殖化前体物质的氧化聚合。 FA含量与HA含量呈正相关, 这与参考文献[5]研究结果不符。 主要是在氧化铁缓慢氧化的过程中, 腐殖质前体物形成较多的FA, 而后形成的FA逐渐转化为HA。 pH值与FA含量呈负相关(-0.987), 与HA呈正相关(0.245)。 这主要归因于溶液腐殖质的形成降低了pH。 Fe2+/Fe3+与HA含量呈负相关, 源于三价铁能吸附DOC(溶解性有机碳), 从而进一步抑制体系的矿化过程[8]。 氨氮含量与HA含量呈负相关, 与腐殖化过程中的氨氮转化相关, 氨氮是腐殖化过程中有机质转化中的重要前体物质[18, 19], 高浓度氨氮在HA形成过程具有一定的消极作用。
(1)相对于0%和40%氧气浓度气氛, 21%氧气浓度气氛更有利于铁氧化物促进的非生物腐殖化反应。 XPS结果表明, 21%氧气浓度气氛促进了胺基N向吡咯N的转化, 而40%氧气浓度时转化为酰胺N。
(2)氧气促进有机质的芳环断裂, 从而在HA中形成富含氧的官能团。 氨基酸的转化影响了HA中C=O的形成, 而酰胺的转化则影响了HA中芳基和脂肪族基团的组成。
(3)SEM显示铁离子的溶出量与HA产量之间存在显著的正相关关系, 同时氧气浓度影响着铁离子的溶出量。 氧气和氧化铁协同促进了氧化铁强化腐殖化反应, 并使氧气参与到腐殖化过程中。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|